咖啡湿法发酵中产醇酵母的筛选及产醇条件优化
赵桐桦,徐心悦,罗麟霜,万丽琼,索玉凯
云南民族大学民族医药学院,民族药资源化学国家民委-教育部重点实验室(昆明 650500)
咖啡的产量、消费量和经济产量均位列世界首位,是世界三大饮料之一[1]。云南省咖啡种植面积、产量和产值均占全国98%以上,是我国咖啡的主产区,主要种植在普洱、保山、德宏、临沧、西双版纳等地[2-3]。在咖啡加工生产中,除了能收获咖啡豆以外,还会产生大量的咖啡果皮、种壳和果胶残渣等副产物[4]。其中咖啡果皮可以占到咖啡鲜果的50%左右,这导致云南省每年将有50 t吨果皮亟待处理[5]。因此,怎样实现咖啡副产物的综合利用,对于贯彻云南咖啡产业的健康绿色发展至关重要。
乙醇由于具有环保、可再生及辛烷值高等优点,被认为是极具发展前景的可再生清洁能源之一[6]。以农业废弃物和木质纤维素为原料的第二代乙醇工业生产技术不仅降低了燃料乙醇的生产成本,还可以解决农林废弃物对环境的不利影响[7]。咖啡果皮作为咖啡产业的废弃物,被证实富含糖类、纤维素和半纤维素等物质,是生物乙醇发酵的优质原料[8]。与此同时,咖啡湿法发酵液中含有大量酵母,其不仅可以有效利用咖啡果皮中的糖类物质,还对咖啡中的绿原酸、咖啡酸等抑菌物质具有良好的抗性[9]。因此,试验从云南小粒咖啡湿法发酵液中分离优良的产醇酵母,并对其培养条件进行优化,从而为以咖啡果皮为原料的乙醇发酵奠定前期基础。
1 材料与方法
1.1 材料
小粒咖啡湿法发酵液采自云南省保山市潞江坝,于4 ℃冷藏备用。
1.2 培养基
1) YPD培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,固体YPD培养基添加琼脂20 g/L。
2) 发酵培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖250 g/L,固体发酵培养基添加琼脂20 g/L。
1.3 试剂
酵母粉、蛋白胨(中国赛默飞世尔科技有限公司);葡萄糖(天津市致远化学试剂有限公司);黄豆粉(上海源叶生物科技有限公司);琼脂(广州赛国生物科技有限公司);正丙醇(上海麦克林生化科技股份有限公司);无水乙醇(上海阿拉丁生化科技股份有限公司)。
1.4 仪器与设备
THZ-98A恒温振荡器(上海一恒科技有限公司);TP600 PCR仪(北京宝日医生物技术有限公司);PB-10酸度计(赛多利斯科学仪器有限公司);SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);DHP-9082B电热恒温培养箱(上海一恒科技有限公司);D-37520小型台式离心机(德国希格玛实验室离心机公司);7890B气相色谱仪(安捷伦科技有限公司)。
1.5 产醇菌株的筛选鉴定
在小粒咖啡湿法发酵后期取样,并于4 ℃保存,备用。在超净台中,对咖啡发酵液样品进行梯度稀释,得到10-1,10-2,10-3,10-4,10-5,10-6和10-7梯度的稀释液。将7个梯度稀释液分别涂布至YPD固体培养基,于28 ℃培养2~4 d,待平板上长出菌落,对其进行划线培养分离。将菌落接种于YPD液体培养基,选取在发酵过程中能够散发出酒香的菌株。将产醇菌株再次接种于发酵培养基并发酵,使用气相色谱仪测定乙醇质量浓度。对产醇质量浓度最高的菌株进行5.8S rDNA转录间隔区(internal transcribe spacer,ITS)测序,并采用MEGA6.0软件以Neighbor Join方法构建系统进化树。
1.6 单因素试验
为优化菌株的产醇条件,分别对发酵时间(12,24,36,48,60,72,84,96和108 h)、发酵温度(24,28,32和36 ℃)、氮源种类(酵母粉、蛋白胨、牛肉膏和黄豆粉)及添加量(10,20,30,40和50 g/L)、初始pH(2.0,3.0,4.0,5.0和6.0)进行单因素试验。
1.7 Box-Behnken试验设计
在单因素试验的基础上,进一步采用Box-Behnken模型设计试验,选取发酵时间(A)、发酵温度(B)、黄豆粉添加量(C)、初始pH(D)作为自变量,以乙醇质量浓度(Y)为响应值,进行响应面分析,确定最佳发酵工艺条件。Box-Behnken试验因素与水平见表1。

表1 Box-Behnken试验因素与水平
1.8 统计分析
所有试验做3个平行,2个重复。采用SPSS 16.0、Origin 2021和Design-Expert 12软件进行数据分析和作图。
2 结果与分析
2.1 产醇菌株的筛选
从小粒咖啡发酵液中共分离到20余株菌,其中3株可以在发酵过程中产生酒香。如图1所示,3株菌在YPD固体平板上形成的菌落质地均匀,形状呈圆形,乳白色,菌体表面光滑湿润,黏稠,易挑起,比细菌菌落大而厚,形态学观察初步认定筛选菌株为酵母菌属。

图1 3株酵母菌的菌落形态
如表2所示,在250 g/L糖浓度下,YMU01、YMU02和YMU03的乙醇质量浓度分别为92.30,76.07和99.72 g/L。因此,后续试验中将对YMU03的产醇条件进行优化。

表2 3株菌株所产的乙醇质量浓度
2.2 产醇菌株的鉴定
对YMU03菌株的ITS部分序列进行PCR扩增,测序结果表明片段的有效长度为597 bp。将得到的序列与NCBI数据库中的序列进行同源性比较,选取与该序列同源性较高的菌株所对应的ITS序列,并使用Neighbor Join法构建系统发育进化树。如图2所示,菌株YMU03与异常威克汉姆酵母(Wickerhamomyces anomalus)的ITS序列同源性较高,且与W.anomalusF-X19-4聚于同一个分支,同源性达99%以上,可初步确定该菌株为W.anomalus。
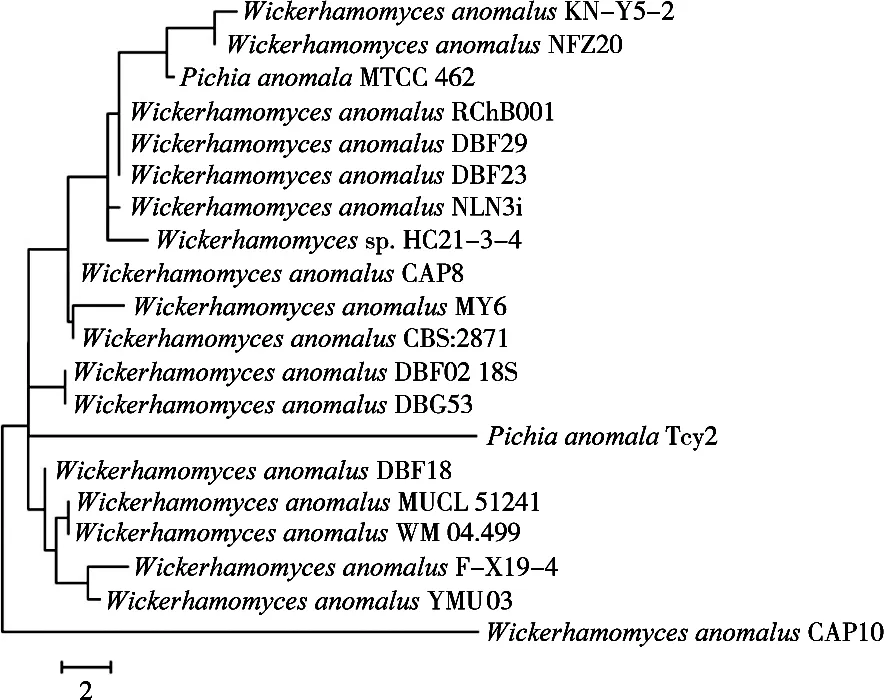
图2 菌株YMU03基于ITS序列进化树
2.3 单因素对产醇的影响
如图3(A)所示,发酵时间为72 h时,乙醇质量浓度达97.54 g/L,72 h之后随着时间的延长,乙醇质量浓度不断下降,这可能是培养基中营养成分逐渐消耗殆尽,以及细胞代谢废物的累积所导致。如图3(B)所示,发酵温度也会对乙醇发酵产生影响,发酵温度28 ℃时,菌株的产醇质量浓度达到最高值,为101.41 g/L。在以酵母粉、蛋白胨、牛肉膏为氮源时,该菌株的乙醇质量浓度较低,而以黄豆粉为氮源时,乙醇质量浓度达113.37 g/L(图3C)。为确定黄豆粉的添加量,考察不同添加量黄豆粉对乙醇质量浓度的影响。结果表明,随着黄豆粉添加量的升高,该菌乙醇质量浓度逐渐升高,添加量为40 g/L时乙醇质量浓度最高(图3D)。如图4(E)所示,初始pH也对YMU03的产醇有较大影响。pH 5.0时,乙醇质量浓度最高,为91.23 g/L。pH<5.0时,乙醇质量浓度随着pH的增加而增大,pH大于5.0时,乙醇质量浓度会逐步降低。因此,优化pH的最佳范围是4.0~6.0。

图3 发酵时间(A)、发酵温度(B)、氮源种类(C)、黄豆粉添加量(D)、初始pH(E)对乙醇质量浓度的影响
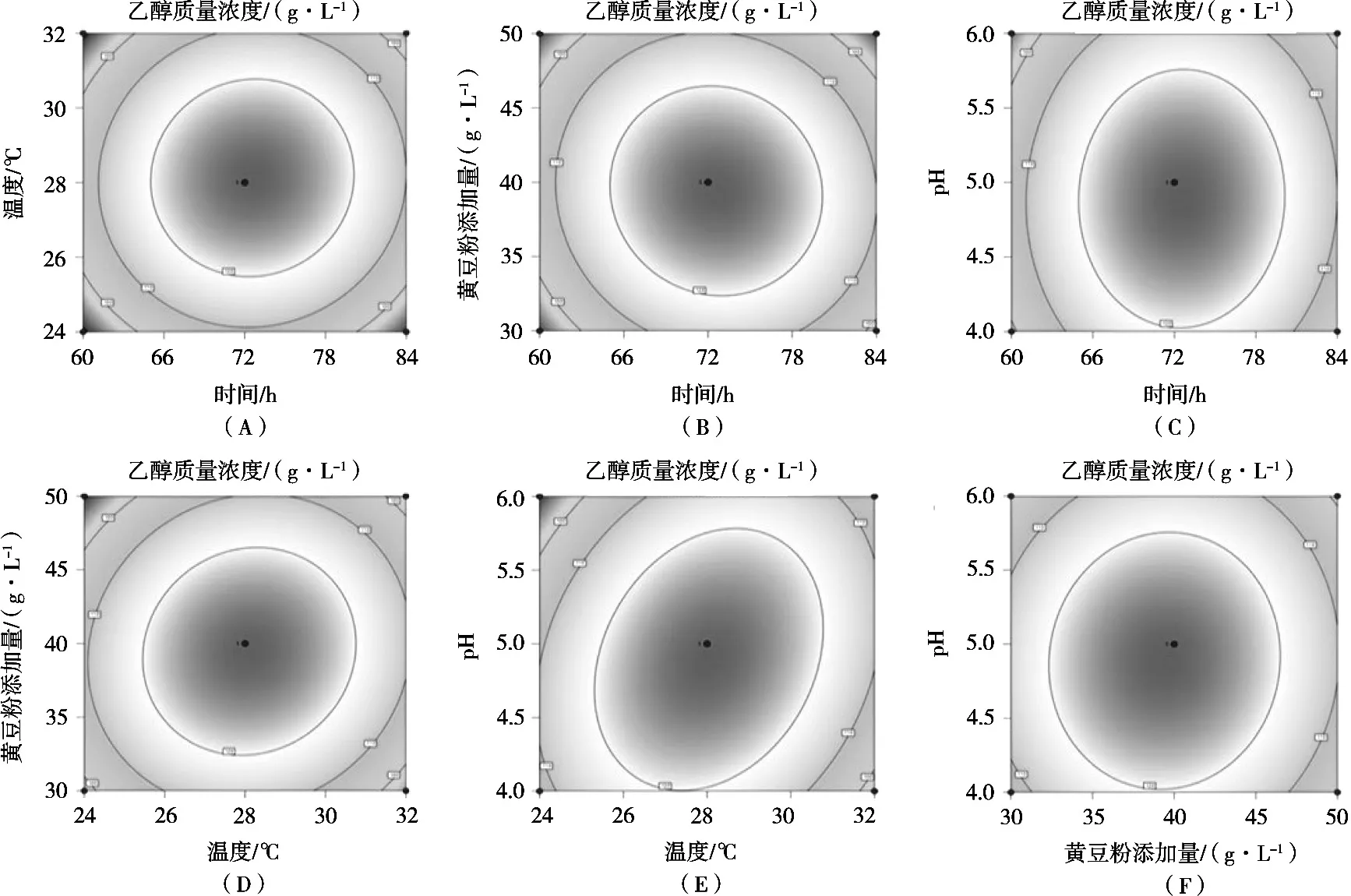
图4 各因素交互作用的等高线图
2.4 Box-Behnken优化试验结果分析
根据单因素发酵试验的结果,选取发酵时间(A)、发酵温度(B)、黄豆粉添加量(C)、初始pH(D)作为自变量,每个因素设置3个水平,以乙醇质量浓度(Y)为响应值,设计Box-Behnken响应面试验,其因素水平和试验结果如表3所示。
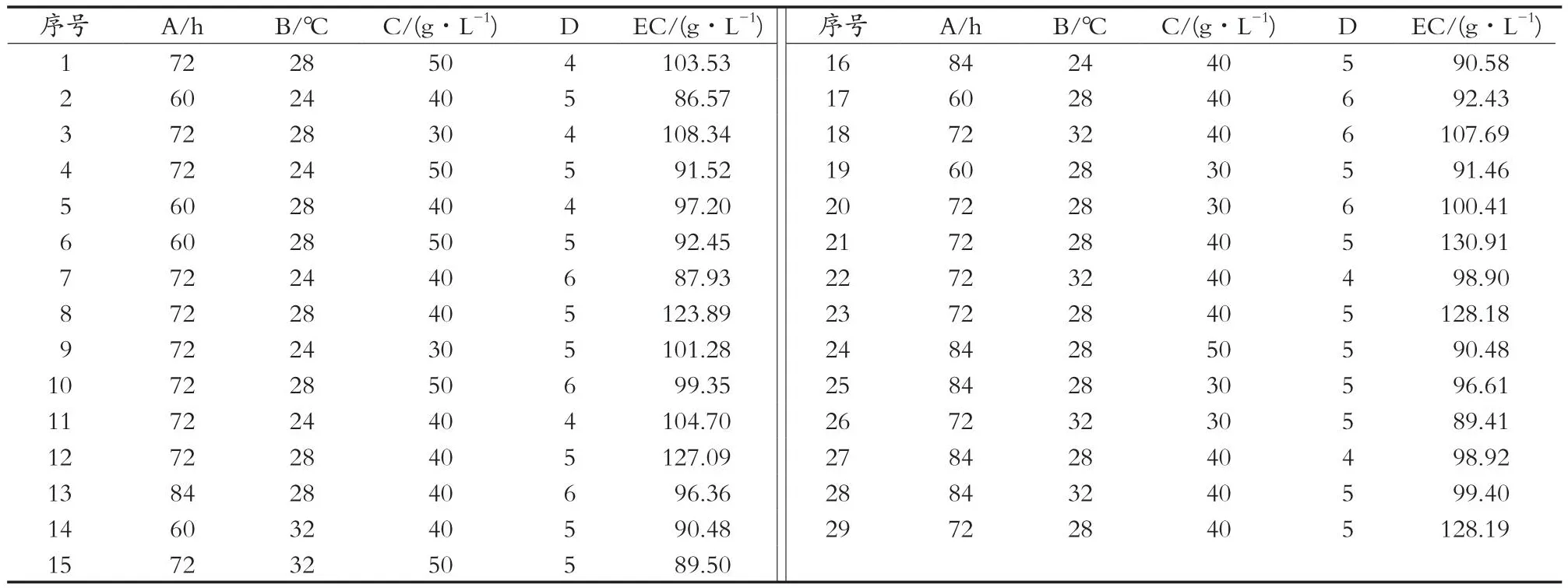
表3 Box-Behnken试验设计及结果
利用Design-Expert 12软件对上述试验结果进行分析,可以得到以乙醇质量浓度为响应值的回归方程:Y=127.65+1.81A+1.07B-1.72C-2.29D+1.23AB-1.78AC+0.552 5AD+2.46BC+6.39BD+0.937 5CD-19.52A2-17.64B2-15.60C2-10.42D2。
该回归方程的相关系数R2为0.960 6,接近于1.0,说明试验值与预测值接近,拟合度较好;矫正系数Radj2为0.921 1,进一步证实这一结论。模型P<0.000 1,表明模型差异性极其显著,表示方程与实际情况拟合程度较好,能够用于反映乙醇质量浓度与各因素之间的关系。失拟项P>0.05,说明失拟项差异不显著,表明其他因素对试验影响很小,可应用于乙醇发酵条件的优化。
2.5 响应曲面交互作用分析
如图4所示,发酵时间、发酵温度、黄豆粉添加量和发酵培养基初始pH的变化对乙醇质量浓度的影响可以通过两两之间的等高线图表示。等高线呈椭圆形说明所选研究因素之间的交互作用显著,呈圆形则说明所选研究因素之间的交互作用不显著[10-12]。发酵时间与发酵温度、黄豆粉添加量与pH的等高线呈现近似圆形,说明交互作用不显著。发酵温度与pH、发酵温度与黄豆粉添加量的等高线呈椭圆形,说明交互作用显著。
对响应面结果进行最优化分析,YMU03菌株产醇的最适条件为发酵时间72.6 h、发酵温度28.0 ℃、黄豆粉添加量39.4 g/L、初始pH 4.9。在此条件下进行发酵,YMU03菌株的产醇浓度达127.9 g/L。考虑到实际情况,进行验证试验,重复3次,发酵产乙醇的结果值为127.5±0.87 g/L,与预测值相接近。
3 结论
为筛选云南小粒咖啡发酵液中的产醇酵母,试验对发酵后期脱胶液中的菌种进行筛选及产醇条件优化,发酵试验表明菌株YMU03具有优良的产醇能力。在单因素试验基础上,分析发酵时间、发酵温度、黄豆粉添加量和初始pH这4个因素对发酵产乙醇质量浓度的影响,依据试验结果设计四因素三水平29个试验。经过Design-Expert 12软件的响应面优化分析,结果表明,在发酵时间72.6 h、发酵温度28.0 ℃、黄豆粉添加量39.4 g/L、初始pH 4.9的条件下进行发酵,YMU03的产醇浓度可达127.9 g/L。考虑到实际情况,进行验证试验,重复3次,发酵产乙醇的结果值为127.5±0.87 g/L,与预测值127.9 g/L相接近。实测值与模型预测值相接近,说明所建模型、采用的优化方法与实际情况拟合程度较高,结果可靠,适用于菌株YMU03进行乙醇发酵的条件优化和分析。优化后菌株YMU03的产醇浓度比未优化前提高27.8 g/L,能大幅增加原材料的利用率,节省生产成本。后续可将菌株YMU03用于咖啡果酒及以咖啡废弃物为底物的乙醇发酵,促进咖啡产业的可持续发展。

