利伐沙班颗粒的制备及影响因素考察
陆纪宏,张 涛,林 琳,王丽春,姚建标
1.浙江金华康恩贝生物制药有限公司,金华 321016;2.浙江康恩贝制药股份有限公司,金华 321100
利伐沙班(rivaroxaban)[1-6]是一种具有生物利用度的凝血因子Ⅹa的选择竞争性抑制剂,其能够选择性地阻断Ⅹa因子的活性位点,且不需要辅因子(如抗凝血酶Ⅲ)参与就可以发挥作用。利伐沙班通过口服给药,进入机体后,通过内源性及外源性途径将Ⅹ因子活化为Ⅹa因子(FⅩa),在凝血级联反应中发挥重要作用。其由Bayer AG和美国强生公司(Johnson)共同开发,其中美国强生公司负责美国市场,Bayer AG拥有除美国以外全球其他市场的销售权。目前在国内上市的原研药剂型主要为片剂,商品名为Xarelto。为了提高部分人群(如吞咽障碍者)的用药顺应性,于2015年在日本推出的原研药——利伐沙班细粒剂(fine granules),商品名为Xarelto,规格分别为10、15 mg。2017年Bayer AG以2.2类在国家药品监督管理局药品评审中心(center for drug evaluation, CDE)申请国内进口注册,目前还在审批中。目前,利伐沙班片剂一般采用湿法制粒,制得的颗粒比较紧实,在水中的溶解性差,溶出度偏低,故本研究未借鉴片剂的制粒工艺。有研究将利伐沙班过200目筛,用黏合剂先对利伐沙班原料进行制粒,再将处理过的利伐沙班颗粒与一水乳糖一起用流化床制粒[7],该工艺比较繁琐,利伐沙班原料过筛难度大,制得的颗粒容易含量不均匀。本研究将利伐沙班原料直接溶于含十二烷基硫酸钠的黏合剂中,用流化床制粒,将含有原料的浆液直接喷雾到水溶性的填充剂等辅料上,工艺简单,改善了产品的流动性、溶出度、含量均匀性。以日本市售利伐沙班颗粒作为参比制剂,对自制利伐沙班颗粒的体外溶出行为进行研究,同时对自制利伐沙班颗粒和原研药进行高温、高湿以及光照条件影响因素考察。
1 仪器与试药
1.1 仪器
Pilotlab L型流化床[博世包装技术(杭州)有限公司];SYH-10 L型三维运动混合机(常州轩宇干燥设备有限公司);TM30-04型四列充填包装机(江苏仅一联合智造有限公司);XPE105型分析天平、FE28型pH计均购自梅特勒-托利多仪器有限公司;Acquity Arc 2998PDA型高效液相色谱仪(Waters);KQ800 KDE型超声波清洗器(昆山市超声仪器有限公司);SNTR-8400A型智能溶出仪(SHIMADZU Excellence in Science);UN110 Plus型自然对流烘箱(Memment);KBF115型恒温恒湿箱、KBF720型恒温恒湿箱、KBF-LQC240E5.2型光照箱均购自德国宾德公司(BINDER);FT2000A型颗粒和粉末特性分析仪(瑞柯仪器有限公司)。
1.2 试药
利伐沙班原料药、利伐沙班对照品、利伐沙班杂质对照品,质量分数≥99.8%,均为自制;原研利伐沙班颗粒(Bayer AG,商品名为Xarelto);羟丙甲纤维素E5(美国陶氏化学公司);颗粒乳糖F100(德国Meggle公司);甘露醇(广西南宁化学制药有限责任公司);乙腈(色谱纯,默克股份两合公司);磷酸(色谱纯)、磷酸钠(色谱纯)均购自TEDIA公司;盐酸[色谱纯,赛默飞世尔科技(中国)有限公司];醋酸(色谱纯)、醋酸钠(色谱纯)均购自国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,色谱纯,Scharla公司)。
2 方法
2.1 溶出行为考察
按照2020年版《中华人民共和国药典》(以下简称《中国药典》)中的方法对样品的溶出行为进行考察。取原研产品,分别以0.1 mol·L-1氯化氢(HCl)溶液、6.94 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 6.8磷酸盐缓冲液(phosphate buffer saline, PBS)、pH 4.5醋酸盐缓冲液和pH 6.8 PBS 900 mL[7]作为溶出介质,用桨法(75 r·min-1),于5、10、15、20、30、45、60、90、120 min取样(6.94 mmol·L-1SDS-pH 4.5醋酸盐缓冲液介质取样到45 min),取溶液适量,过滤,取续滤液作为供试品溶液。另精密称取利伐沙班对照品适量,加乙腈溶解,用溶出介质溶解制成每1 mL中约含11 μg利伐沙班的溶液作为对照品溶液。用高效液相色谱法检测利伐沙班的含量[8-10]。以十八烷基硅烷键合硅胶作为填充剂,以乙腈-水(40∶60)作为流动相,检测波长为250 nm,柱温为40 ℃,精密量取10 μL,注入液相色谱仪,记录色谱图,同法测定自制产品的溶出量。用外标法以峰面积计算溶出量。
2.2 含量均匀度测定方法
取利伐沙班颗粒1袋,置于量瓶中,加溶剂[0.01 mol·L-1的磷酸溶液-乙腈(40∶60)]溶解,超声使颗粒溶解完全,冷却至室温,用溶剂定容,过滤,取续滤液适量,用溶剂溶解并稀释,制成每1 mL中约含利伐沙班0.2 mg的溶液,作为供试品溶液;另精密称取利伐沙班对照品适量,用溶剂[0.01 mol·L-1的磷酸溶液-乙腈(40∶60)]稀释制成每1 mL中含0.2 mg利伐沙班的溶液,作为对照品溶液。精密量取上述溶液5 μL注入液相色谱仪中,用外标法以峰面积计算含量。取原研利伐沙班颗粒用相同的方法进行含量检测。
2.3 有关物质检测方法
2.3.1色谱条件 C18色谱柱(4.0 mm×55 mm,3 μm);流动相:流动相A为0.01 mol·L-1的磷酸溶液,流动相B为乙腈;检测波长:250 nm;流速:1.0 mL·min-1;进样量:5 μL;柱温:40 ℃。
2.3.2检测方法 取利伐沙班颗粒细粉适量,精密称定,加混合溶剂溶解制成每1 mL中约含利伐沙班0.5 mg的溶液,超声,过滤,取续滤液作为供试品溶液;精密量取供试品溶液1 mL,置于100 mL量瓶中,用溶剂稀释至刻度,摇匀,作为对照品溶液。称取杂质A、杂质B、杂质C、杂质D、杂质E和杂质F各适量,用供试品溶液溶解并稀释,制成约含各杂质5 μg的溶液,作为系统适用性溶液。用高效液相色谱法《中国药典》2020年版四部通则0512)测定[11-13]。取系统适用性溶液5 μL,注入液相色谱仪,记录色谱图,各物质峰的分离度应符合要求,再精密量取对照品溶液和供试品溶液各5 μL,分别注入液相色谱仪,记录色谱图,供试品溶液的色谱图中如有杂质峰,扣除溶剂峰后,杂质A(乘以校正因子2.8)、杂质B(乘以校正因子1.4)、杂质C(乘以校正因子1.3)、杂质D、杂质E(乘以校正因子1.4)和杂质F(乘以校正因子1.2)的峰面积均不得大于对照品溶液主峰面积的0.2倍(0.2%),其他单个未知杂质峰面积不得大于对照品溶液主峰面积的0.1倍(0.1%),各杂质峰面积经校正后的总和不得大于对照品溶液主峰面积的0.5倍(0.5%)。
3 结果
3.1 外观和规格的选择
原研利伐沙班颗粒的规格有2种,分别为10和15 mg。考虑到规格的增加只是包装内容物质量的等比例增加,故选择规格为10 mg的利伐沙班颗粒进行研究。
3.2 自制利伐沙班颗粒的处方工艺与质量
3.2.1样品制备 称取处方量的原料药及辅料,将羟丙甲纤维素与十二烷基硫酸钠溶于水中。在该溶液中加入微粉化的利伐沙班,制得混悬液[14-16]。在流化床造粒机中将该悬浮液喷到乳糖、甘露醇粉末上,制得含药颗粒。将含药颗粒加入多向运动混合机中,加入胶态二氧化硅与草莓香精,混合15 min,出料,用充填包装机进行包装。
3.2.2利伐沙班颗粒粉体学参数的考察 对原研及自制利伐沙班颗粒的松密度、振实密度、休止角、卡尔指数等粉体学指标进行检测。结果见表1、表2。根据对原研利伐沙班颗粒的检测结果,将自制利伐沙班颗粒的休止角暂定为25°~35°,卡尔指数暂定为12%~20%[17-18]。
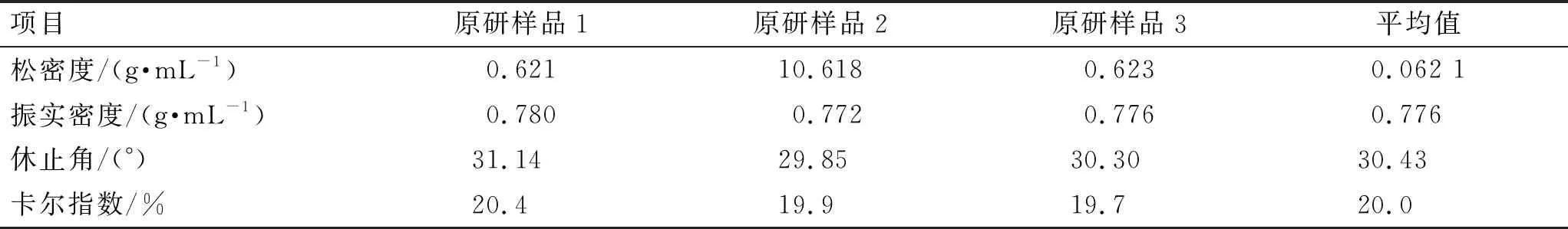
表1 原研利伐沙班颗粒的粉体学检测结果

表2 自制利伐沙班颗粒的粉体学检测结果
3.2.3含量均匀度测定 根据2.2项下的方法,对原研利伐沙班颗粒和自制利伐沙班颗粒的含量和含量均匀度进行检测。经检测,原研利伐沙班颗粒含量的平均值为99.6%(3次样品检测结果分别为99.8%、100.2%、99.6%),含量均匀度的平均值为6.1(3次样品检测结果为初试6.3、初试5.8、初试6.2)。自制利伐沙班颗粒含量的平均值为100.2%(3次样品检测结果分别为100.2%、99.8%、100.5%),含量均匀度的平均值为5.0(3次样品检测结果分别为初试4.6、初试4.9、初试5.5)。自制利伐沙班颗粒的含量及含量均匀度与原研利伐沙班颗粒相当。
3.2.4原研利伐沙班颗粒的溶出行为考察 根据2.1项下的方法对原研利伐沙班颗粒的溶出行为进行考察。在0.1 mol·L-1HCl溶液、pH 4.5醋酸盐缓冲液和pH 6.8 PBS中,30 min的溶出度均低于80%;在6.94 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 6.8 PBS中,30 min的溶出度均在80%以上。结果见图1。

图1 原研利伐沙班颗粒在不同溶出介质中的溶出曲线
3.2.5原研利伐沙班颗粒与自制利伐沙班颗粒在不同溶出介质中的溶出曲线比较 根据2.1项下的方法,比较原研利伐沙班颗粒和自制利伐沙班颗粒在不同介质中的溶出曲线,结果见图2。原研利伐沙班颗粒和自制利伐沙班颗粒溶出曲线相似因子f2值结果见表3。

注:A.0.1 mol·L-1 HCl溶液;B.6.94 mmol·L-1 SDS-pH 4.5醋酸盐缓冲液;C.1.73 mmol·L-1 SDS-pH 4.5醋酸盐缓冲液;D.1.73 mmol·L-1 SDS-pH 6.8 PBS;E.pH 4.5醋酸盐缓冲液;F.pH 6.8 PBS。

表3 自制利伐沙班颗粒与原研利伐沙班颗粒的溶出曲线相似因子f2值
溶出曲线是评价口服固体制剂质量的重要依据,对原研利伐沙班颗粒和自制利伐沙班颗粒溶出曲线进行比较,2种制剂在各溶出介质中,溶出行为的相似因子f2均大于50,表明二者在0.1 mol·L-1HCl溶液、6.94 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 4.5醋酸盐缓冲液、1.73 mmol·L-1SDS-pH 6.8 PBS、pH 4.5醋酸盐缓冲液和pH 6.8 PBS中的溶出行为基本一致。
3.3 原研利伐沙班颗粒和自制利伐沙班颗粒的影响因素考察
3.3.1高温实验 称取利伐沙班原研颗粒和自制颗粒置于称量瓶中,保存于40、60 ℃条件下,分别于0、5、10 d取样,对样品溶出度、含量及有关物质进行考察[19-21],结果见表4。由表4可见,在高温条件下,自制利伐沙班颗粒的含量和溶出度均合格,有关物质无显著变化,与原研利伐沙班颗粒相当。

表4 高温实验的结果
3.3.2高湿实验 称取利伐沙班原研颗粒和自制颗粒置于称量瓶中,保存于湿度分别为75%、92.5%条件下,分别于0、5、10 d取样,对样品含量、溶出度及有关物质进行考察,结果见表5。
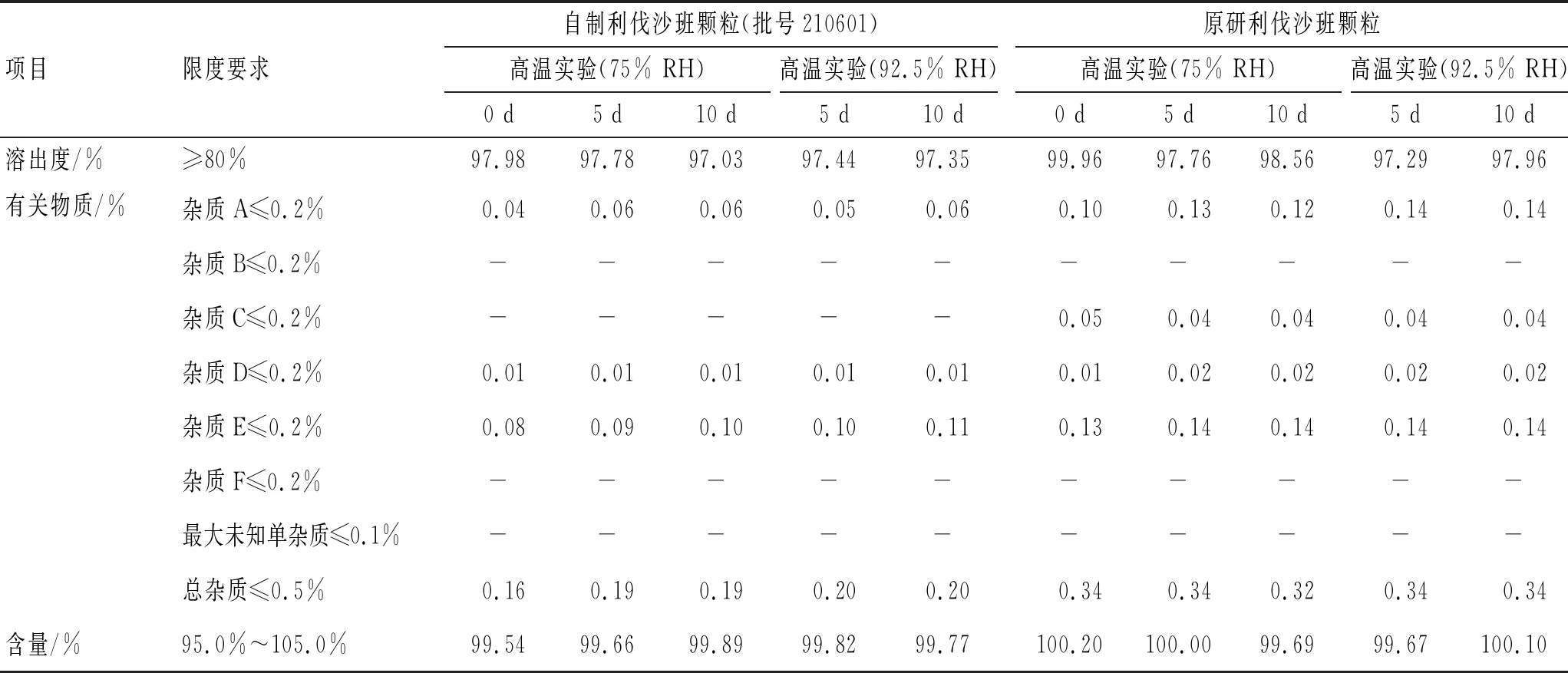
表5 高湿实验的结果
由表5可见,在高湿条件下,自制利伐沙班颗粒的含量和溶出度均合格,有关物质无显著变化,与原研利伐沙班颗粒相当。
3.3.3光照实验 称取原研利伐沙班颗粒和自制利伐沙班颗粒置于称量瓶中,保存于(4 500±500) lx条件下,分别于0、5、10 d取样,对样品含量、溶出度及有关物质进行考察,结果见表6。
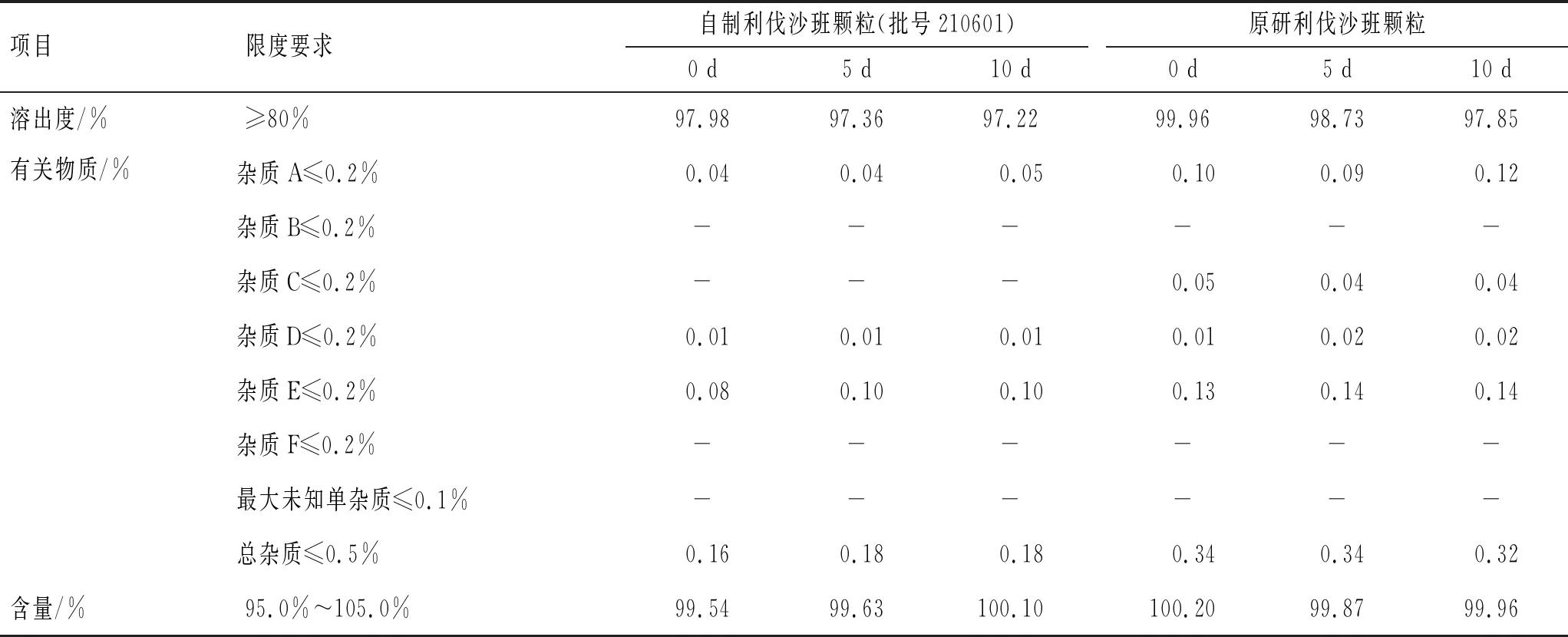
表6 光照稳定性实验的结果
由表6可见,在光照条件下,自制利伐沙班颗粒的含量和溶出度均合格,有关物质无显著变化,与原研利伐沙班颗粒相当。
4 讨论
利伐沙班是难溶性药物,而利伐沙班颗粒又是小规格制剂,单剂含量稍有变化将影响用药的安全性,因此制备利伐沙班颗粒的关键问题是解决颗粒的流动性及含量的均匀度问题。采用流化床制粒,将利伐沙班分散到含有SDS的溶液中制成混悬液,喷雾到乳糖、甘露醇等载体上,既解决了含量的均匀性问题,又解决了颗粒的流动性及溶出度等问题。用该工艺制备的颗粒流动性、含量均匀度及溶出度均良好。同时影响因素实验结果表明,与原研利伐沙班颗粒相比,自制利伐沙班颗粒在高温、高湿、光照条件下的含量、溶出度、有关物质均无显著变化,性质稳定。

