血清sFas、IL-17对急性淋巴细胞白血病化疗效果的预测价值*
雷小茹,戴进前,任婧婧,袁茂文
西安市中心医院血液科/西安市血液病研究所,陕西西安 710000
急性淋巴细胞白血病(ALL)占全部成人急性白血病的20%~30%[1]。有研究报道显示,ALL经过系统性治疗后,完全缓解(CR)率可达70%~90%,3~5年无病生存率为30%~60%,而未达到CR的患者则需要接受挽救治疗,提高其生存率[2]。有学者指出,细胞凋亡是化疗药物抑制肿瘤细胞增殖的重要机制之一[3]。据文献报道,跨膜蛋白(Fas)介导的细胞凋亡在白血病的发生和发展中发挥着重要作用,而血清可溶性Fas(sFas)是一种受体蛋白,因Fas基因转录本剪切酶出现异常,缺乏跨膜区的Fas大量形成,并从细胞膜脱落形成sFas,影响细胞凋亡[4]。另有学者指出,炎症反应在恶性肿瘤的发病机制中发挥着重要作用,与肿瘤细胞增殖、侵袭及血管生成密切相关[5]。而白细胞介素(IL)-17可与其受体相互结合后介导不同的炎症反应,不仅可引起慢性炎症反应,还可加快慢性炎症反应的进程,参与肿瘤的发生和发展[6]。本研究重点分析血清sFas、IL-17对ALL患者化疗效果的预测价值,现报道如下。
1 资料与方法
1.1一般资料 选取2018年5月至2021年12月西安市中心医院收治的110例ALL患者作为研究对象,根据化疗效果分为化疗无效组(20例)和化疗有效组(90例)。纳入标准:(1)ALL符合《中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)》[7]中相关诊断标准;(2)经骨髓象、血液检查等确诊;(3)费城染色体阴性;(4)年龄<60岁。排除标准:(1)肝、肾等脏器功能不全;(2)合并严重感染性疾病;(3)合并其他恶性肿瘤;(4)合并自身免疫性疾病;(5)伴有认知障碍、精神障碍;(6)非原发性白血病;(7)既往有白血病相关放、化疗史;(8)经腰椎穿刺检查结果证实伴有中枢神经系统受累。所有患者及家属均知情同意并签署知情同意书。本研究经西安市中心医院伦理委员会审核通过。
1.2化疗方案 参照《中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)》[7]相关内容实施治疗,全部患者依据病情和实际情况选用VDP方案联合环磷酰胺和左旋门冬酰胺酶组成的VDCLP方案治疗,具体内容包括静脉注射长春新碱(深圳万乐药业有限公司,国药准字:H44021772,规格:1 mg)2 mg,1次/周,共4周;于化疗第1~3天、第15~17天静脉注射柔红霉素(深圳万乐药业有限公司,国药准字:H44024361,规格:20 mg)40~60 mg/d;口服泼尼松(广东南国药业有限公司,国药准字:H44021868,规格:5 mg)40~60mg/(m2·d),每日一次,于治疗第15天开始逐步减量。于治疗第1、15天静脉注射环磷酰胺(深圳市凯利维医疗器械有限公司,国药准字:H32024654)600 mg/m2。于治疗第19~28天静脉注射左旋门冬酰胺酶(Kyowa Hakko Kogyo Co.,Ltd.,批准文号:H20090520)6 000 U/m2。也可采用Hyper-CVAD方案治疗,一般以4周为基础。化疗期间予以止吐、器官保护等常规支持治疗;伴有出血患者予以成分输血;伴有感染者早期予以抗菌药物治疗。
1.3化疗效果判定及分组方法 所有患者均于诱导治疗第28天时评估化疗效果,参照《中国成人急性淋巴细胞白血病诊断与治疗指南(2016年版)》[7]中相关内容进行判定。(1)完全缓解(CR):外周血无原始细胞,无髓外白血病(无淋巴结肿大、脾大,无皮肤、牙龈浸润,无中枢神经浸润);骨髓三系造血恢复,原始细胞≤5%;外周血中性粒细胞计数>1.0×109/L;血小板计数(PLT)>100×109/L;4周内无复发。(2)CR伴血细胞不完全恢复(CRi):PLT<100×109/L和(或)外周血中性粒细胞计数≤1.0×109/L,其他满足CR的标准。总反应率=(CR例数+CRi例数)/总例数×100%。将治疗完成后达到上述CR和CRi标准的ALL患者纳入化疗有效组(90例),剩余患者纳入化疗无效组(20例)。
1.4资料收集 设计基线资料调查表,详细统计患者的临床资料,包括性别、年龄、体质量指数、吸烟史、饮酒史、免疫表型、危险度分层、化疗方案。
1.5实验室指标检测 所有患者均于入院第2天清晨采集空腹静脉血6 mL[分为2支试管(抗凝试管和离心试管)]和骨髓。(1)血常规:取1支静脉全血标本,于-80 ℃环境下保存待检。采用日本希森美康XN9000全自动血细胞分析仪检测血红蛋白(Hb)、白细胞计数(WBC)、红细胞计数(RBC)及PLT。正常参考值范围为Hb:男性120~160 g/L,女性110~150 g/L;RBC:男性(4.0~5.5)×1012/L,女性(3.5~5.0)×1012/L;WBC:成人(4.0~10.0)×109/L;PLT:(100~300)×109/L。(2)血清sFas、IL-17:取1支试管标本,以3 000 r/min离心10 min,离心半径为10 cm,离心后取血清于当日检测。分别采用深圳晶美生物工程有限公司、上海恒远生物科技有限公司的试剂盒,均以酶联免疫吸附试验检测血清sFas、IL-17水平。(3)融合基因筛查:取骨髓或外周血标本检测。

2 结 果
2.1化疗效果 110例ALL患者治疗后有82例达到CR,8例达到CRi,总反应率为81.82%(90/110)。
2.2化疗无效组和化疗有效组基线资料比较 化疗无效组和化疗有效组性别、年龄、体质量指数、吸烟史、饮酒史、免疫表型、危险度分层、化疗方案比例比较,差异均无统计学意义(P>0.05)。见表1。

表1 化疗无效组和化疗有效组基线资料比较[n(%)或
2.3化疗无效组和化疗有效组6项指标水平比较 化疗无效组血清sFas、IL-17水平均明显高于化疗有效组,差异均有统计学意义(P<0.05);化疗无效组和化疗有效组Hb、WBC、RBC和PLT水平比较,差异均无统计学意义(P>0.05)。见表2。

表2 化疗无效组和化疗有效组6项指标水平比较
2.4多因素Logistic回归分析 将血清sFas、IL-17水平作为自变量,将ALL患者化疗效果(无效=1,有效=0)作为因变量,进行多因素Logistic回归分析,结果显示,血清sFas和IL-17分别每增加1个单位,ALL患者化疗无效的风险就增加2.171、2.151倍(P<0.05)。见表3。
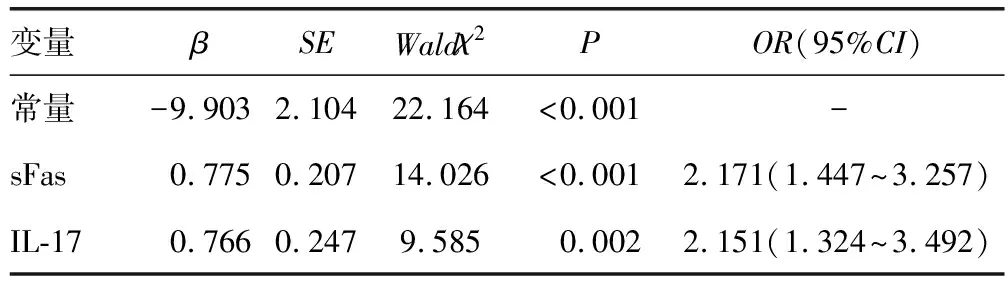
表3 多因素Logistic回归分析
2.5血清sFas、IL-17水平对ALL患者化疗效果的预测价值 将ALL患者入院第2天血清sFas、IL-17水平作为检验变量,ALL患者化疗效果(无效=1,有效=0)作为状态变量,ROC曲线分析结果显示,ALL患者入院第2天血清sFas、IL-17水平单项及联合检测对ALL患者化疗效果预测的ROC曲线下面积(AUC)分别为0.762、0.752、0.874,2项指标联合检测的预测价值最好。见表4、图1。
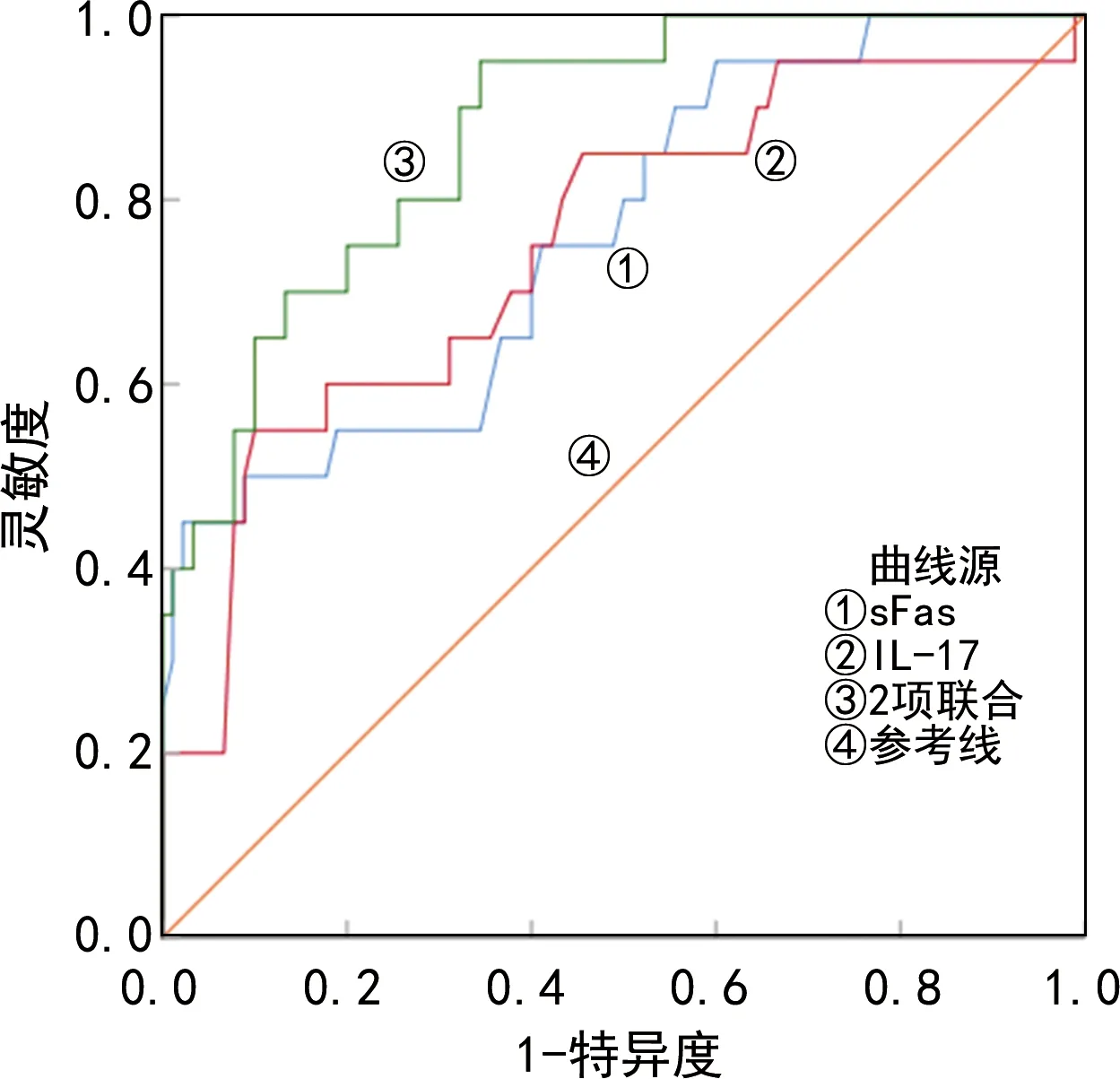
图1 血清sFas、IL-17水平单项及联合检测预测ALL患者化疗效果的ROC曲线

表4 血清sFas、IL-17水平对ALL患者化疗效果的预测价值分析
2.6血清sFas、IL-17水平与ALL患者实验室指标水平的相关性 Pearson相关分析结果显示,ALL患者血清sFas、IL-17水平与Hb、WBC、RBC、PLT和ECOG评分均无关(P>0.05)。见表5。
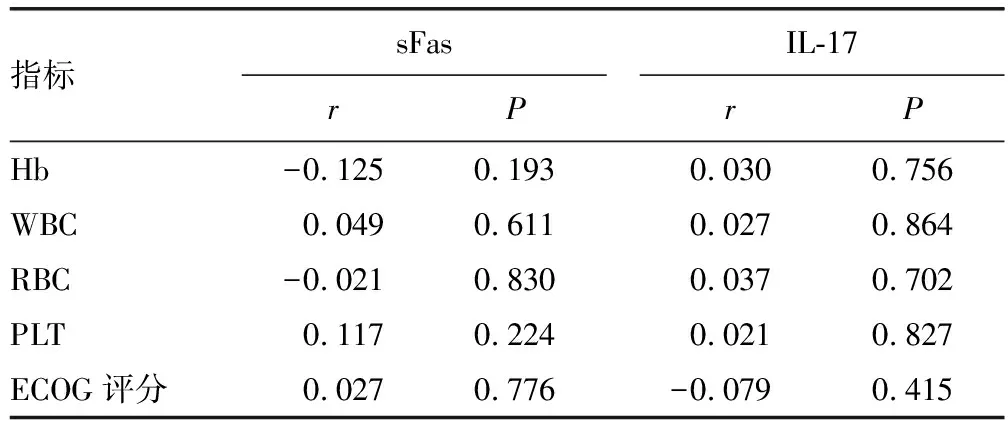
表5 血清sFas、IL-17水平与ALL患者实验室指标水平的相关性
2.7不同临床特点ALL患者血清sFas、IL-17水平比较 不同临床特点(免疫表型和危险度分层)ALL患者血清sFas、IL-17水平比较,差异均无统计学意义(P>0.05)。见表6。

表6 不同临床特点ALL患者血清sFas、IL-17水平比较
2.8血清sFas、IL-17水平与不同临床特点ALL患者的相关性 点二列相关性分析结果显示,血清sFas、IL-17水平与ALL患者免疫表型、危险度分层均无关(P>0.05)。见表7。

表7 血清sFas、IL-17水平与不同临床特点ALL患者的相关性
3 讨 论
近年来,随着化疗方案的改进、医疗技术的进步等,临床对于成人ALL常采用多种药物联合的强化疗方案进行诱导治疗,可更早获得CR,且CR率已明显提高[8]。但仍有部分ALL患者接受治疗后未达到CR,还需接受其他治疗,远期疗效并不理想,长期生存率较低,患者预后风险较高[9]。秦晓璐等[10]研究表明,102例初诊费城染色体阴性ALL患者中,经4周诱导治疗后,CR率为79.41%,仍有近20%的患者未达到CR,不利于患者预后。本研究结果显示,110例ALL患者治疗总反应率为81.82%,与上述研究结果相近,甚至略高,分析原因可能与本研究中的疗效标准包含了治疗后达到CRi有关,患者数量得以增加,比例更高。目前,ALL患者病情判断、疗效监测仍然是临床上研究的重点、热点,且已开展了大量的相关研究。有研究表明,细胞和分子遗传学异常对ALL患者病情进展和治疗反应具有较大影响,染色体检查对于ALL的诊断、治疗和预后具有重要意义[11]。在染色体数目异常中,二倍体组(超二倍体,即有50条或更多染色体数目;亚二倍体,<46条染色体)与临床预后具有相关性,其中超二倍体预后好,约6%~7%的成人ALL具有超二倍体,但ALL患者同时具有超二倍体和染色体结构异常易出现耐药,化疗效果不好,预后差[12]。染色体结构异常包括染色体易位和染色体缺失等,虽具有不同的临床症状和免疫表型,但具有共同的特点,如发病时WBC升高,易发生髓外浸润和耐药,常规化疗效果差,预后不良[13]。由上述内容可知,通过检测ALL患者的染色体情况,有助于指导后续治疗方案的选择和优化,但染色体检查过程较为繁杂,操作难度高,检查时间通常较长,可能会延误患者的治疗,不利于普及,而且价格昂贵,也难以重复检查。
曾瑶等[14]研究表明,促进细胞凋亡是化疗药物杀伤肿瘤细胞的主要作用机制之一,化疗药物常通过抑制BCL-2与C-MYC的表达促进细胞凋亡,并且某些化疗药物可诱导肿瘤细胞的Fas表达,是药物杀伤肿瘤细胞的机制之一,如顺铂。Fas是肿瘤坏死因子(TNF)受体家族的一个受体,可通过两种途径介导细胞凋亡,一种途径是Fas可诱导过度活跃的Fas阳性免疫细胞凋亡,促进机体维持免疫自稳;另一种途径是可诱导异常细胞凋亡,充分发挥免疫监视作用[15]。而血清sFas是经过替代剪切的mRNA突变体编码翻译的缺乏跨膜编码序列功能区的蛋白质,这种突变主要是由于Fas基因内含子7/外显子8区的插入缺失所致,发生这种突变后会影响细胞凋亡反应[16]。IL-17是一类主要由活化CD4+淋巴细胞产生的具有促进炎症反应的细胞因子,能激活T淋巴细胞,作用于多种细胞和组织,并且可诱导间质细胞分泌炎性和造血细胞因子,如IL-6、IL-8,也可诱导成纤维细胞支持CD34造血祖细胞的生长和分化,与自身免疫性疾病和肿瘤的发生和发展密切相关[17]。何光翠等[18]研究表明,达到CR的急性白血病患者血清IL-17水平明显低于未缓解患者,证明IL-17与急性白血病的发生和发展有关。本研究发现,血清sFas、IL-17与ALL患者病情和化疗效果存在一定的关系,探寻其中可能的原因为血清sFas可导致正常Fas难以发挥凋亡作用,引发肿瘤细胞免疫逃逸,使肿瘤细胞逃避机体通过Fas系统途径的免疫清除机制,肿瘤细胞未得到有效清除,仍大量增殖、生长,进而影响化疗效果,增加化疗无效的风险[19]。而IL-17可与IL-6受体相互结合,进而介导炎症反应,加快炎症反应进程,形成肿瘤局部炎症反应微环境,进而促进肿瘤细胞逃逸和化疗的耐药性,降低化疗效果,增加ALL患者化疗无效的风险[20],这一研究结论与任峰等[21]研究结果基本一致,表明治疗无效的ALL患者血清IL-17水平明显高于治疗显效的患者,证实了IL-17与ALL患者化疗效果存在一定的关系。本研究ROC曲线分析结果显示,血清sFas、IL-17对ALL患者化疗效果具有良好的预测价值,且以2项指标联合检测预测价值更好。
综上所述,血清sFas、IL-17与ALL患者化疗效果相关,且可作为早期预测因子,2项指标联合检测的预测价值更好。但本研究仍存在一定的不足,如血清sFas、IL-17是否会相互作用影响ALL患者的化疗效果和病情进展尚不得知,本研究并未进行具体分析,其中机制并不清楚。本研究为观察性研究,仅阐述了部分血清sFas、IL-17在ALL发生和发展中的作用和机制,未来还需开展更多的研究进一步探索、分析,以此证实本研究的结论,拓宽血清sFas、IL-17在ALL诊疗中的应用范围。

