治疗前全身免疫炎症指数对结直肠癌临床病理及预后影响的Meta分析*
侍科辰,张文斌
新疆医科大学第一附属医院胃肠(肿瘤)外科,新疆乌鲁木齐 830000
结直肠癌(CRC)是胃肠道常见恶性肿瘤,是一种多步骤、多阶段及多基因参与的细胞遗传性疾病[1],占每年全球新诊断癌症的10.2%。因CRC死亡占所有癌症相关死亡人数的9.2%[2],早期诊断的CRC患者5年生存率约为90%,而延迟诊断的CRC患者5年生存率下降至13%[3]。目前,与CRC患者预后有关的ras突变状态、BRAF突变和微突变等生物标志物需进行侵入性操作,并且依赖于特定的实验室设备[4-5]。因此,迫切需要一种方便、经济的非侵入性检测方法来预测CRC患者的预后,以及评估CRC手术的治疗效果。肿瘤的发生、发展涉及多种炎症细胞和多种炎症介质的作用[6-7],全身炎症反应和局部免疫反应之间的相互作用被认为是癌症的第7个标志。全身免疫炎症指数(SII)计算方法为血小板计数×中性粒细胞计数/淋巴细胞计数,其从常规实验室检测中容易得出。大量研究已证明包括SII在内的多种炎症指数对恶性肿瘤预后的预测价值[8-19],但结果并不一致。CHEN等[9]的研究表明,高SII组患者总生存期(OS)及无进展生存期(PFS)均明显低于低SII组患者;另一些研究中高SII与CRC患者的预后不良无明显关联[10,14,17]。因此,本研究采用Meta分析的方法对相关研究进行系统评价,评估治疗前SII与CRC患者临床病理及预后的相关性,为临床医生快速、高效判断患者预后提供辅助工具,现报道如下。
1 资料与方法
1.1资料来源 本研究遵照PRISMA指南,计算机检索6个医学数据库(4个英文数据库:PubMed、EMBASE、Web of SCIence、Cochrane Library;2个中文数据库:中国知网、万方数据库)发表的关于SII对CRC患者预后影响的临床研究,检索时限为建库至2022年5月,根据纳入和排除标准筛选文献。英文检索词:colonic neoplasms OR colorectal neoplasms OR colon cancer OR rectal cancer OR rectal cancers OR rectal tumor OR colorectal cancer OR CRC OR colorectal tumor OR colorectal carCInoma AND systemic immune-inflammatory index OR SII OR systemic-immune-inflammation index OR systemic immune-inflammation index。中文检索词:结直肠癌、结直肠恶性肿瘤、结肠癌、结肠恶性肿瘤、直肠癌、直肠恶性肿瘤、系统免疫炎症指数、全身免疫炎症指数、血小板计数×中性粒细胞计数/淋巴细胞计数。根据参与者、干预措施、比较、结果和研究设计准则建立纳入和排除标准。纳入标准:(1)经组织病理学检查证实的CRC患者;(2)治疗前测定SII;(3)手术治疗、化疗联合靶向治疗或新辅助化疗前检测SII;(4)研究评估治疗前SII与CRC患者预后的关系;(5)提供风险比(HR)和95%置信区间(CI)。排除标准:(1)随访数据不完整的患者;(2)合并患有其他癌症的患者;(3)会议摘要、病例报告、综述、信件、社论和评论文章。
1.2方法 由2名研究人员从符合条件的研究中独立提取数据,并交叉核对结果。纳入数据包括第一作者姓名、发表年份、作者国家、患者数量、患者年龄、患者性别、研究类型、随访时间、组织学类型、肿瘤分期、治疗方法、SII最佳截断值及其选择方法、OS和(或)PFS的HR及其相应的95%CI和研究终点。OS和PFS分别是主要和次要终点。使用纽卡斯尔-渥太华量表(NOS)评估纳入研究的方法学质量[20]。NOS评分为0~9分,>6分的研究被认为是高质量研究。
1.3文献检索和质量评价 共检索74篇文献,去除重复文献,反复阅读摘要和全文,剔除不符合纳入标准的文献,最终纳入13篇文献[8-15,17-19,21-22],共5 132例CRC患者纳入此Meta分析。文献检索和筛选流程见图1。
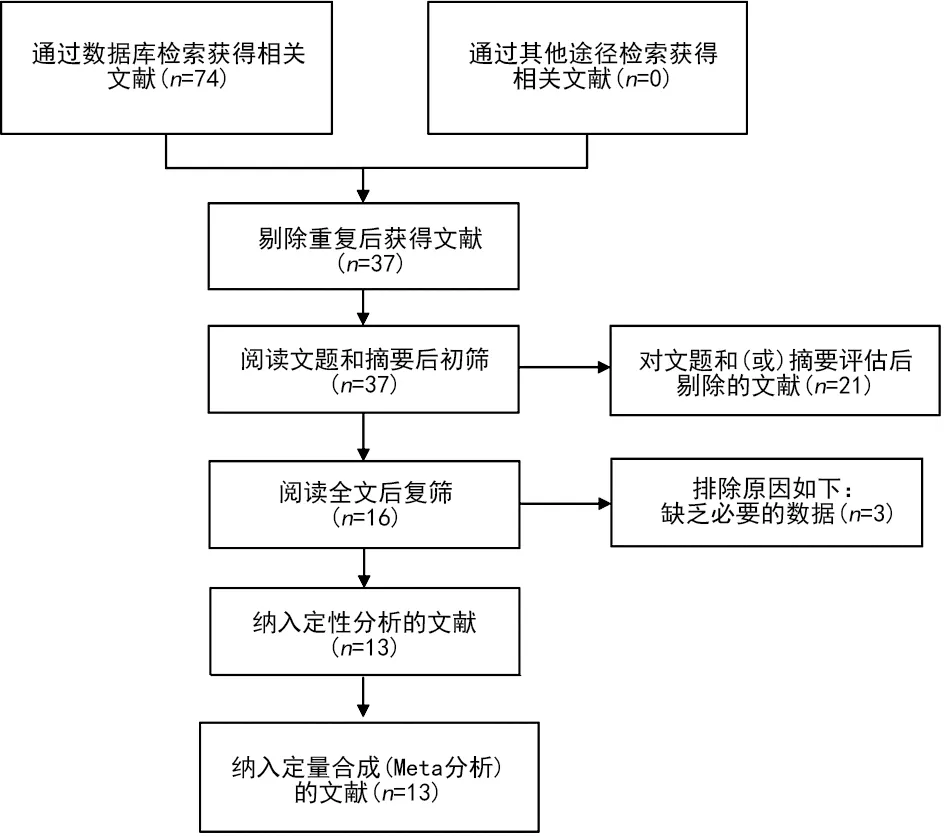
图1 文献检索和筛选流程
1.4统计学处理 采用STATA17.0统计软件进行Meta分析。通过CochraneQ检验和HigginsI2统计量检验评估研究间的异质性。纳入研究间异质性显著(I2>50%,P≤0.05),采用随机效应模型合并效应量;纳入研究间无显著异质性(I2≤50%,P>0.05),采用固定效应模型合并效应量。采用敏感性分析评估纳入研究的稳定性,采用Egger检验评估发表偏倚,检验水准:α=0.05。
2 结 果
2.1Meta分析中纳入文献的主要特征 纳入的文献发表时间为2016-2020年,其中12篇文献(中国[9-15,17-19,21]、日本[22])在亚洲人群中进行研究,1篇文献(意大利[8])在亚洲以外人群中进行研究。纳入研究的患者数量95~1 383例;纳入研究的患者年龄16~90岁;随访时间21.7~64.0个月;纳入的癌症类型中12项为CRC研究[8-10,12-15,17-19,21-22],1项为结肠癌研究[11]。13篇文献[8-15,17-19,21-22]的研究终点是OS,9篇文献[8-10,13-15,17-18,21]的研究终点是OS和PFS。13篇文献[8-15,17-19,21-22]提供了SII与大肠癌临床病理特征的相关性数据。12篇文献[9-15,17-19,21-22]为回顾性研究,1篇文献[8]为前瞻性研究。纳入文献特征见表1。13篇文献NOS评分均≥6分,均为高质量研究。
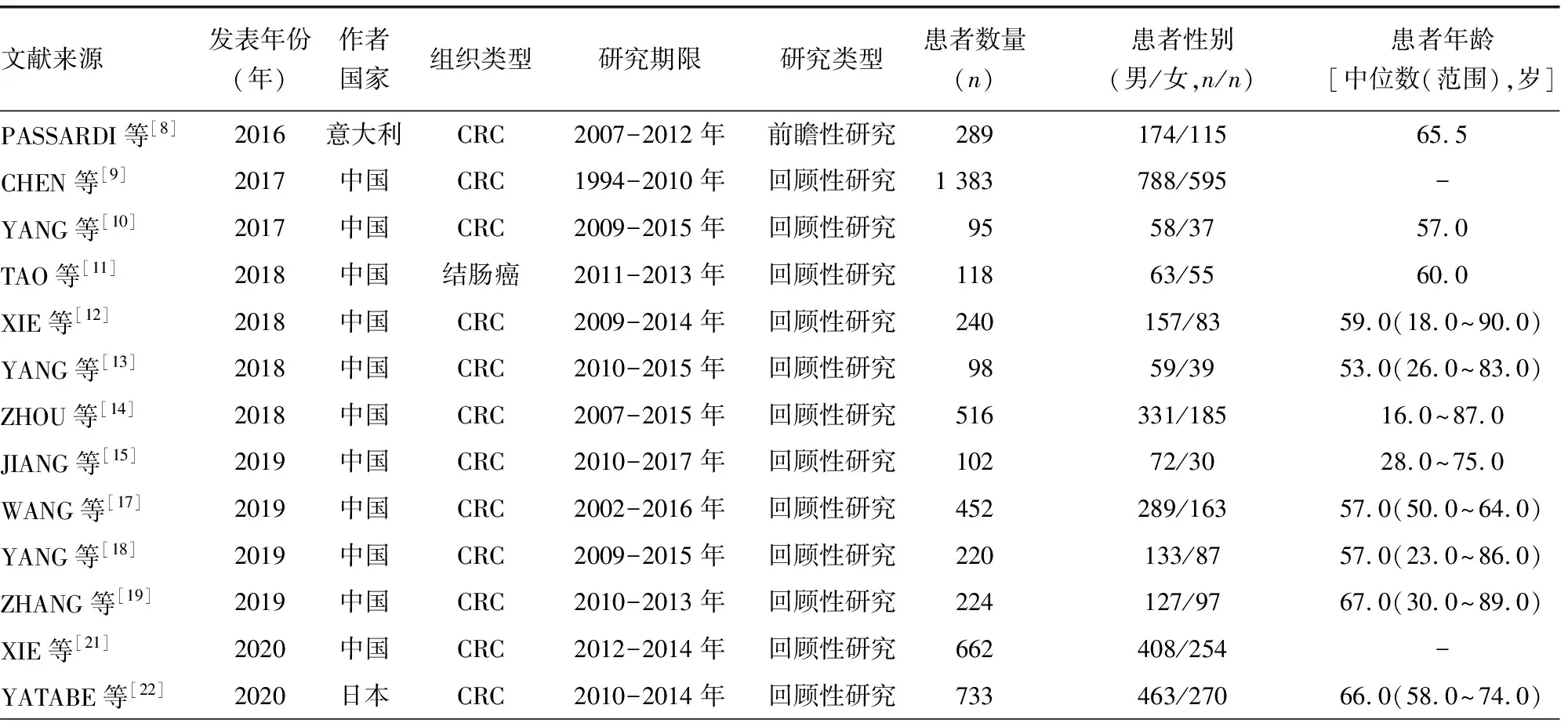
表1 Meta分析中纳入文献的主要特征
2.2Meta分析
2.2.1CRC患者SII与OS间合并HR和95%CI的亚组分析 13篇文献[8-15,17-19,21,22]共5 132例CRC患者分析了SII与OS的相关性,纳入文献间存在显著异质性(I2=82.5%,P<0.001),采用随机效应模型合并分析,结果显示,高SII组患者OS明显低于低SII组,差异有统计学意义(HR=1.67,95%CI:1.29~2.17,P<0.001);而在关于高SII组患者的OS亚组分析中发现,无论地理位置、样本量、治疗方式、TMN分期和NOS评分如何,治疗前高SII均与低OS相关(P<0.05)。见表2。
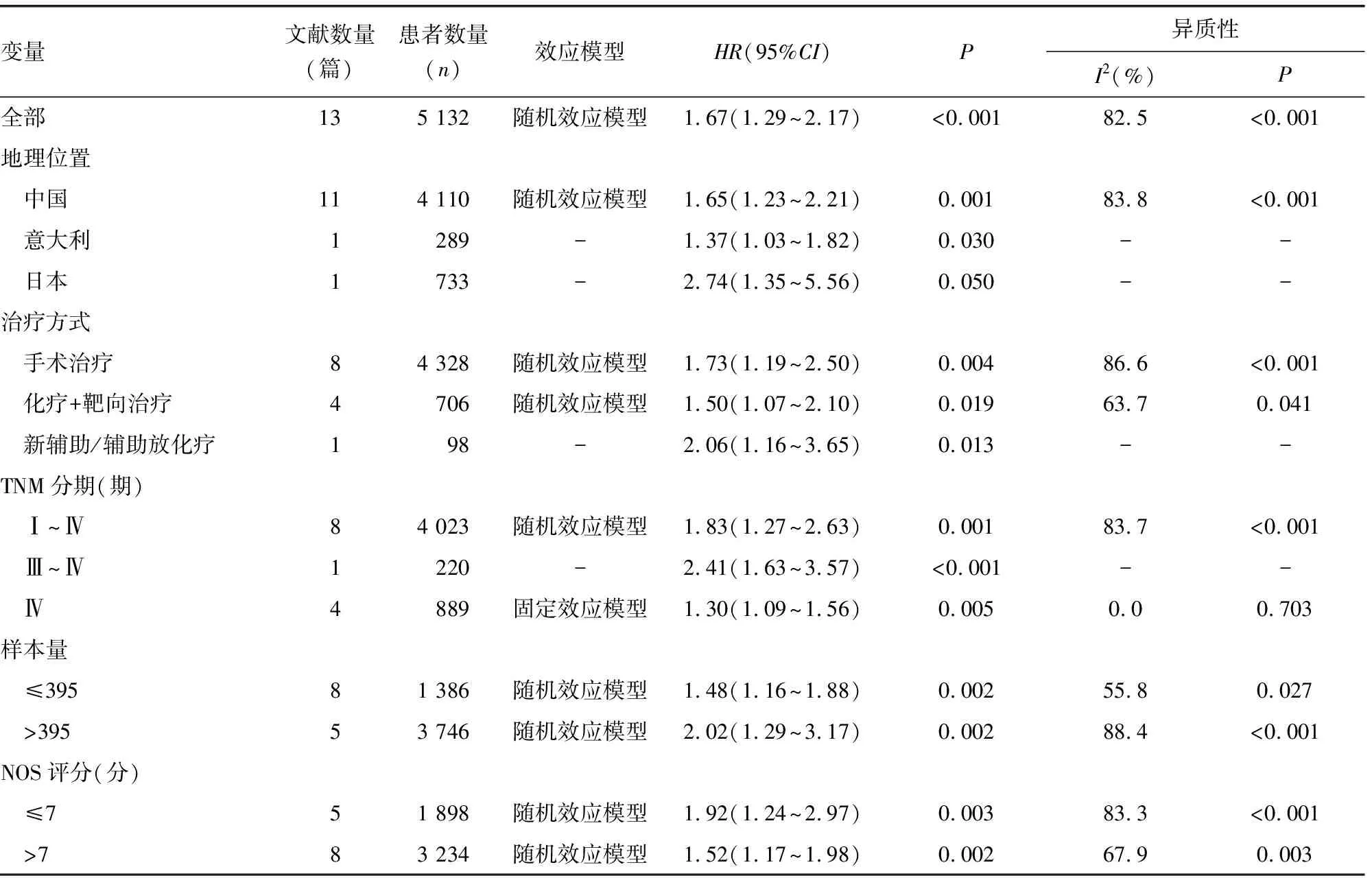
表2 CRC患者SII与OS间合并HR和95%CI的亚组分析
2.2.2CRC患者SII与PFS间合并HR和95%CI的亚组分析 9篇文献[8-10,13-15,17,18,21]共3 817例CRC患者分析了SII与PFS的相关性,纳入文献间存在显著异质性(I2=89.0%,P<0.001),采用随机效应模型合并分析,结果显示,高SII组患者PFS明显低于低SII组,差异有统计学意义(HR=1.74,95%CI:1.26~2.40,P=0.001)。而在关于高SII组患者的PFS亚组分析中发现,无论样本大小、NOS评分高低,治疗前高SII均与低PFS相关(P<0.05),与地理位置、治疗方式、TNM分期均无关(P>0.05)。见表3。
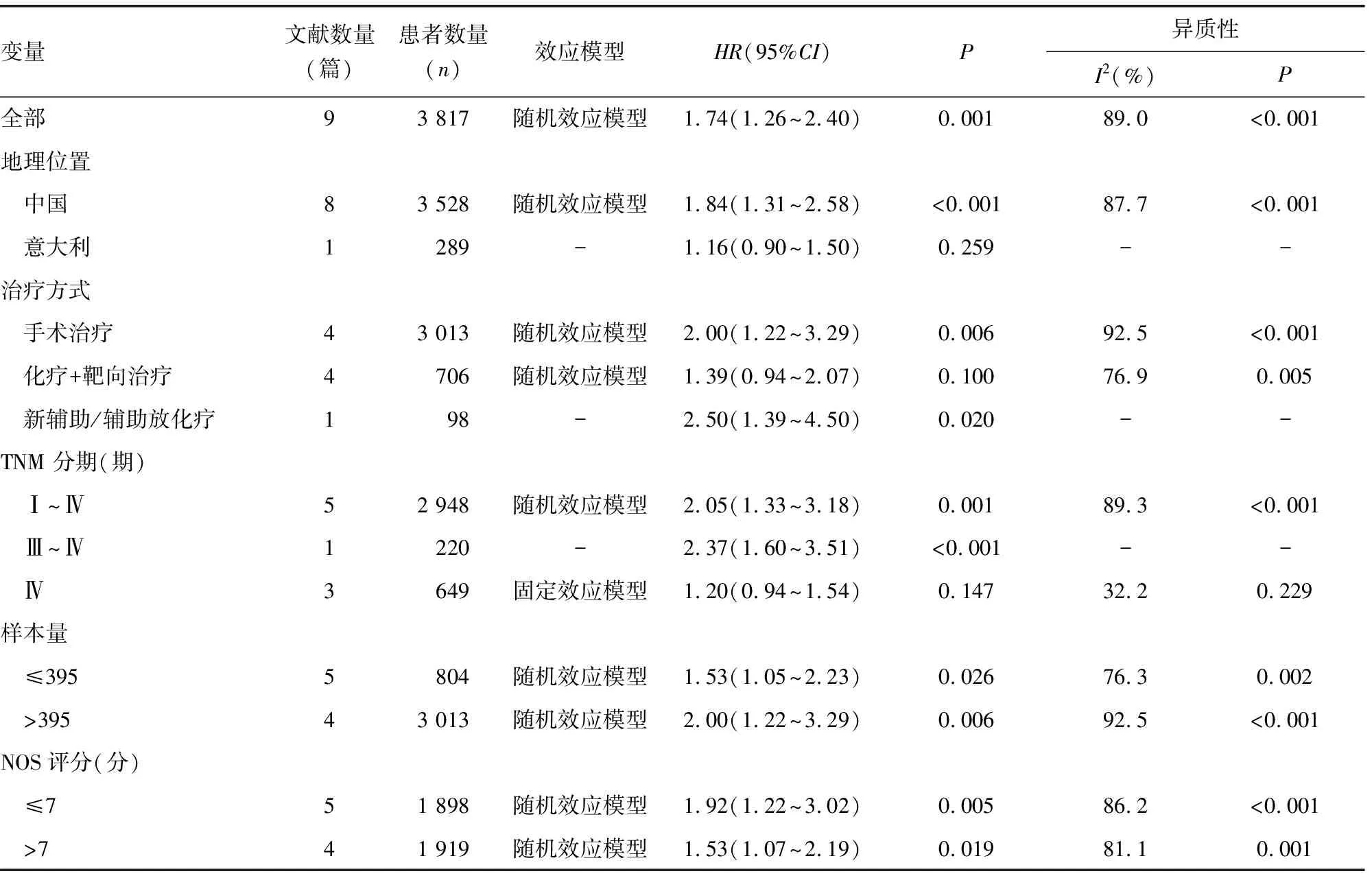
表3 CRC患者SII与PFS间合并HR和95%CI的亚组分析
2.2.3SII与CRC临床病理特征分析 通过纳入13篇文献[8-15,17-19,21,22]共5 132例患者评估SII与相关临床病理特征的关联。临床病理特征:性别(男、女)、肿瘤分化程度(低分化、中/高分化)、肿瘤位置(左侧与右侧)、远处转移(是、否)、淋巴结转移(是、否)、年龄(>60岁、≤60岁)和肿瘤最大径(≥ 5 cm、<5 cm)。结果显示,CRC患者高SII与低分化肿瘤(OR=1.73,95%CI:1.38~2.17,P<0.001)、有远处转移(OR=1.79,95%CI:1.00~3.18,P=0.049)、东部合作肿瘤处理团体评分(ECOG)为1~2分(OR=1.98,95%CI:1.39~2.84,P<0.001)、肿瘤最大径≥5 cm(OR=1.49,95%CI:1.18~1.88,P=0.001)、肿瘤位置在直肠及左半结肠(OR=1.22,95%CI:1.01~1.47,P=0.039)均有关;CRC患者高SII水平与性别(OR=0.89,95%CI:0.78~1.02,P=0.098)、淋巴结转移(OR=1.35,95%CI:0.81~2.26,P=0.249)、年龄(OR=1.16,95%CI:0.97~1.39,P=0.100)均无关。见表4。
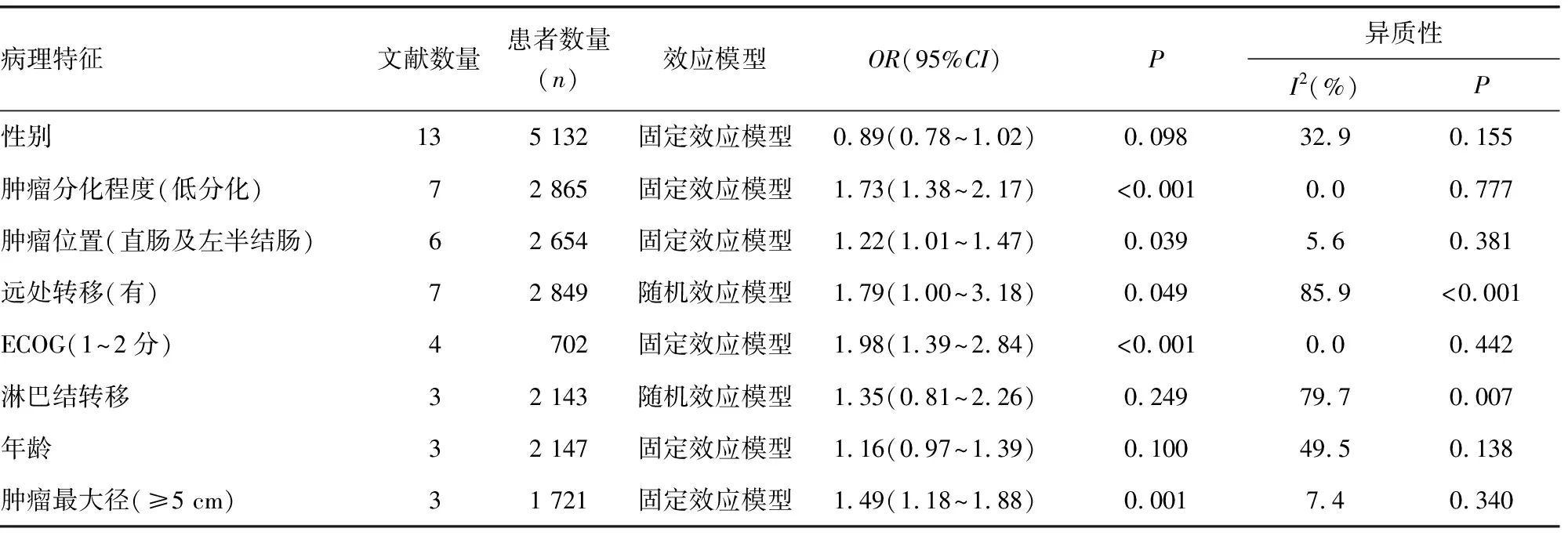
表4 SII与CRC临床病理特征分析
2.2.4敏感性分析与发表偏倚 敏感性分析结果显示,移除每项研究后合并HR无明显改变,表明本研究结果具有良好的稳定性;通过Egger检验确定所纳入研究的发表偏倚,结果显示,SII在CRC患者OS(P=0.10)与PFS(P=0.468)分析方面具有明显的对称性,不存在发表偏倚。
3 讨 论
本研究通过纳入13篇文献综合分析发现,治疗前高SII意味着CRC的恶性程度更高,同时,与CRC患者的预后不良明显相关(P<0.001)。近年来,肿瘤微环境在肿瘤免疫学领域受到越来越多的关注,有研究表明,肿瘤的发生和发展涉及多种炎症细胞和多种炎症介质作用[23]。SII所包含的中性粒细胞计数、淋巴细胞计数和血小板计数均与肿瘤的发生和发展密切相关,反映了宿主的炎症反应和免疫反应之间的平衡。高SII对应于高血小板计数/中性粒细胞计数和(或)低淋巴细胞计数。因此,治疗前SII升高表明肿瘤微环境中免疫细胞浸润,处于高度炎症反应状态[24]。外周血中性粒细胞的存在通常与癌症患者的预后不良相关[25]。有研究发现,中性粒细胞可诱导产生白细胞介素、肿瘤坏死因子和粒细胞集落刺激因子,从而促进肿瘤细胞增殖、肿瘤相关血管生成和远处转移[26]。
目前,有研究表明,SII作为一种简便且廉价的炎症因子标志物,与多种恶性肿瘤的预后存在关联性。一项关于SII与多种恶性肿瘤预后的Meta分析发现,治疗前高SII与较差的OS明显相关[27]。ZHANG等[28]研究证明,SII可以作为晚期胰腺癌患者预后的独立预测因素。MIRILI等[29]研究表明,高SII与经典霍奇金淋巴瘤患者的低OS(PFS)明显相关,可作为1项经典霍奇金淋巴瘤患者预后的独立预测因素。
既往关于SII对CRC患者的预后研究存在争议。本研究收集了13项临床研究共5 132例患者的数据,以阐明SII在CRC患者预后中的作用。本研究通过对地理位置、样本量、治疗方式、TMN分期和NOS评分进行亚组分析发现,高SII是包括OS和PFS在内的长期生存结果的一项强有力的预后标记物。此外,本研究通过评估SII与相关临床病理特征的关联发现,CRC患者高SII与低分化肿瘤、有远处转移、肿瘤位置在直肠及左半结肠处、ECOG为1~2分、肿瘤最大径≥5 cm均有关。
本研究的局限性:(1)纳入的文献大多为回顾性研究,无法精准控制选择标准,导致研究之间存在无法避免的异质性;(2)在纳入的研究中,SII的分界值和确定方法不统一,可能会造成结果偏差;(3)存在一些不可控制的混杂因素或其他偏倚。但本研究提供了大样本数据,且文献质量评估均为高质量研究。本研究进行了亚组分析以降低异质性,同时,通过敏感性分析确定异质性来源,本研究结果相对客观、可靠。
综上所述,在CRC患者中,治疗前高SII与较差的OS和PFS相关。此外,治疗前高SII提示肿瘤恶性程度较高,远处转移风险较大。SII可作为CRC患者的预后标志物,可为临床医生快速、高效判断患者预后提供依据。由于本研究的局限性,本研究结果需在多中心、大规模的前瞻性研究中进行深入探讨。

