miR-181b 通过靶向PTEN 调控缺血性脑卒中后血管新生的作用和机制研究
张 烨,庄雪明,王 静,徐海婷,王忠祥,王诗波,张 莉,唐广满
缺血性脑卒中是脑血管疾病常见类型,也是老年人死亡的常见病因, 主要病理为脑血管灌注不足,导致脑组织局部缺血、坏死,进而出现神经功能障碍。在脑动脉阻塞后, 脑梗死恢复区的血管内皮细胞增殖,形成新生血管,保护神经细胞[1]。 因此,如何促进血管新生成为缺血性脑卒中治疗的关键点。 微小RNA(mircoRNA,miRNAs)是一类非编码RNA,在调控细胞各种生物学功能中发挥重要作用。 最近研究发现,miRNAs 在调控脑梗死血管新生中扮演着重要角色[2~4]。miR-181b 是最近发现的一种miRNA, 在调控肿瘤、心脑血管疾病中发挥作用[5,6]。 葛丽等[7]研究发现,miR-181b 在动脉粥样硬化血管内皮细胞中低表达,上调miR-181b 可抑制细胞凋亡、促进细胞增殖。 但miR-181b 与缺血性脑卒中后血管新生的关系尚不清楚。 人张力蛋白同源物基因 (phosphate and tension homology deleted on chromosome 10,PTEN) 是一种与侵袭和血管生成过程有关的致癌基因,上调PTEN 可抑制多种疾病的血管生成[8~10]。 研究发现,miR-21-5p可通过PTEN/肌醇磷脂-3-激酶(phosphatidylinositol-3-kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threoninekinase,AKT)通路调控脑梗死后血管内皮细胞功能[11]。但miR-181b 是否亦能调控PTEN 影响血管新生尚不清楚。 笔者研究通过构建大鼠脑缺血模型, 观察miR-181b 对大鼠脑组织血管生成的影响, 并通过体外实验探讨miR-181b 对血管内皮细胞增殖、迁移的影响及可能机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
65 只SPF 级雄性SD 大鼠, 鼠龄10 ~12 周,体质量50 ~280 g。 购自江苏集萃药康生物科技股份有限公司,动物许可证号SCXK(苏)2018-0008。 动物饲养于无锡恒泰实验动物养殖有限公司, 昼夜交替12 h,温度24 ℃,湿度45%。 动物实验经中国人民解放军联勤保障部队第九〇四医院伦理委员会批准(20220012)。
1.1.2 细胞与主要试剂
人脐静脉血管内皮细胞 (human umbilical vein endothelial cells,HUVEC)(上海弘顺生物科技有限公司,中国)。
达氏修正伊氏培养液/营养混合(Dulbecco’s modified Eagle’s medium/nutrient mixture F-12,DMEM/F-12)、胰酶及青霉素/链霉素(上海如吉生物科技发展有限公司, 中国);miR-NC 质粒、miR-181b mimics质粒、 野生型 (wild type,WT)-PTEN 载体、 突变型(mutant,MUT)-PTEN 载体及聚乙二醇(polyethylene glycol,PEG)包备的脂质体(北京擎科生物有限公司,中国);Lipofectamine 2000、CCK-8 (cell counting kit-8)试剂盒及Matrigel 胶(武汉卡诺斯科技有限公司,中国);2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)试剂(武汉华翔科洁生物技术有限公司,中国);荧光素酶报告试剂盒(艾美捷科技有限公司,中国);Mir-X miRNA First-Strand Synthesis Kit(TAKARA 生物有限公司,日本);兔抗鼠簇分化抗原34(cluster of differentiation 34,CD34)、山羊抗鼠血管内皮生长因子 (vascular endothelial growth factor,VEGF)、 兔抗鼠磷酸酯酶-张力蛋白同源物(phosphatase and tensin homolog,PTEN)、二抗(北京普鲁顿生物科技有限公司,中国);异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、 藻红蛋白(phycoerythrin,PE)标记的二抗及4',6-二脒基-2-苯基吲哚(4',6-diamidino 2-phenylindole,DAPI)(北京中杉金桥生物有限公司,中国)。
1.1.3 仪器
酶标仪(南京贝灯医疗器械有限公司,中国);聚合酶链式反应 (polymerase chain reaction,PCR)仪(ABI 公司, 美国);ZEISS Axio Zoom.V16 蔡司荧光显微镜(蔡司,德国)。
1.2 方法
1.2.1 动物实验
1.2.1.1 动物模型制备与分组 随机将65 只大鼠分为假手术组15 只,其余50 只大鼠进行建模。50 只大鼠成功建模45 只,成功率90%。将45 只建模成功的大鼠随机分为模型组、miR-NC 组及miR-181b 组,每组15 只。
使用大脑中动脉线栓法进行大鼠脑缺血再灌注模型的制备。 具体步骤如下:将SD 大鼠采用乙醚麻醉后,放置于操作台上,消毒;解剖出右侧颈总动脉、颈外动脉和颈内动脉;在颈内、外动脉交汇处用丝线将颈内动脉挂线阻塞,2 h 后解除丝线; 等待大鼠清醒后采用Zea-Longa 神经功能评分法判断建模的成功与否(评分≥2 分提示建模成功,<2 分提示建模失败)。
1.2.1.2 大鼠治疗方法 假手术组大鼠暴露颈内、外动脉后不进行结扎, 其他组处理与模型组大鼠一样。术后6 h 对各组大鼠进行干预:miR-NC 组大鼠给予尾静脉注射PEG-miR-NC(2 mg/kg,1 次/天);miR-181b组大鼠给予尾静脉注射PEG-miR-181b(2 mg/kg,1次/天);模型组、假手术组大鼠给予尾静脉注射PEG包备的空载脂质体(2 mg/kg,1 次/天)。 所有大鼠治疗2 周后进行后续实验。
1.2.1.3 大鼠改良神经功能缺损评分 分别于治疗前、治疗后14 d,对大鼠进行大鼠改良神经功能缺损评分(modified neurological severity score,mNSS),该评分共包括运动、感觉、平衡木、反射消失或动作异常等项目,满分18 分,分值越高,神经系统损伤越重。
1.2.1.4 脑组织TTC 染色 治疗14 d 后安乐死各组大鼠,无菌下获取脑组织,于-80 ℃条件下冷冻,制备2 mm 的冰冻切片。 在室温下使用2,3,5-氯化三苯基四氮唑 (2,3,5-triphenyltetrazolium chloride,TTC)染料孵育30 min。 然后将切片在4 ℃条件下用4%多聚甲醛中固定、 保存。 采用Image J 软件计算梗死面积(梗死部位呈灰白色)。
1.2.1.5 免疫荧光检测脑组织中CD34、VEGF 表达将各组大鼠脑组织用甲醛溶液浸泡48 h 后, 石蜡包埋,制备切片5 μm;依次通过二甲苯、梯度酒精脱水,柠檬水高压修复抗原,山羊血清室温封闭1 h后加入CD34(1 ∶200)、VEGF(1 ∶250)一抗4 ℃冰箱过夜, 其次复温后加入对应的二抗室温避光孵育1 h,洗涤3 次后加入含有DAPI 的封片剂封片;干燥,倒置荧光显微镜拍照,用Image J 软件分析荧光强度。
1.2.2 体外实验
1.2.2.1 细胞培养及分组 对HUVEC 使用DMEM/F-12 培养液(含10%胎牛血清、1%青霉素/链霉素)。培养条件:体积分数5%CO2、37°C,待细胞融合达到80%时传代。 取传3 代的细胞进行转染,使用Lipofectamine 2000 将不同物质转染至HUVEC, 分为Control 组(正常培养)、miR-NC 组(转染miR-NC 空质粒)及miR-181b 组(转染miR-181b mimics 质粒)。各组细胞继续培养24 h 后进行后续实验。
1.2.2.2 实时荧光定量聚合酶链反应 收集各组细胞及脑组织,加入1 mL Trizol 试剂提取总RNA。 使用miRNA 逆转录试剂盒、TB Green 荧光定量试剂盒检测miR-181b 表达水平,U6 为内参。 反应体系(25 μL):TB Green Advantage Premix(2X)12.5 μL,上下游引物各0.5 μL,ROX Dye (50X) 0.5 μL,cDNA 2.0 μL,ddH2O 9 μL。 循环条件:95 ℃5 s,60 ℃20 s,共40 个循环。检测细胞、组织miR-181b 表达水平。相对表达量用2-△△Ct法计算。
miR-181b 上、下游引物:5′-ATGGTTCGTGGGTTCACA-3′,5′-GTGGCTAAGTTCCGACG-3′;U6 上、 下游引物:5′-TACAGAGAAGATTAGCATGGCCCCTG-3′,5′-ACACGATTCGTGAAGCGTTCCATA-3′。
1.2.2.3 CCK-8 检测细胞增殖能力 制备单细胞悬液,将2×103个细胞接种到96 孔板。 培养24 h、48 h及72 h 后加入10 μL CCK-8 溶液,于37 ℃条件下避光培养4 h, 用酶标仪检测450 nm 处的光密度(optical density,OD)值。
1.2.2.4 划痕实验检测细胞迁移能力 取对数生长期的细胞,用胰酶消化后,按照每孔2×105个细胞接种到6 孔板, 待细胞融合达到80%时在板底部使用白色枪头划线,再磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤3 次后,换成无血清培养液继续培养24 h;然后再光学显微镜下拍照,测量细胞间距离。 迁移率(%)=(0 h 细胞间距离-24 h 时细胞间距离)/0 h细胞间距离×100%。
1.2.2.5 成管实验 首先把Matrigel 胶与无血清培养液按照1 ∶2 比例铺到24 孔板中。 然后将制备好的细胞悬液,按照3 × 104/孔细胞接种到板中,继续培养4 h 后光学显微镜下拍照,任意选取5 个视野,测量内皮细胞伸出分支的长度即为成管长度。两个细胞之间的连接数量即为连接数,细胞之间形成的网孔即为网孔数,取平均值。
1.2.2.6 荧光素酶报告实验 通过TargetScan 在线网站 (http://www.targetscan.org/) 预测miR-181b 与PTEN 的靶向关系。 将miR-NC 或miR-181b mimics分别与WT-PTEN、MUT-PTEN 载体共转染至HUVEC 细胞,继续孵育48 h 后收集各孔细胞,裂解各组细胞并收集上清液,然后按照试剂盒说明检测细胞荧光素酶相对活性。
1.2.2.7 Western blot 检测 收集各组细胞及脑组织,加入细胞裂解溶液提取总蛋白,于100 ℃煮5 min 后检测蛋白浓度及纯度。 制备10%分离胶及5%浓缩胶,每孔中加入30 μg 蛋白样品,在110 V 电压下将蛋白转移到聚偏二氟乙烯膜上,用5%无脂牛奶室温下封闭1 h,加入PTEN(1 ∶1 000)、β-actin(1 ∶1 000)一抗,4°C 条件下过夜。 次日将PVDF 膜与二抗室温下孵育1 h,加入发光液,曝光,用Image J 分析灰度值,采用目标蛋白/β-actin 表示蛋白相对表达量。 检测细胞、组织中PTEN 表达水平。
1.3 统计学方法
使用SPSS 21.0 统计软件进行分析。 计量资料使用均数± 标准差表示,数据呈正态分布时,多组间行ANOVA 检验,两组间使用SNK-q 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 动物实验
2.1.1 4组大鼠改良神经功能缺损评分比较
治疗前各组大鼠mNSS 差异无统计学意义 (F=0.003,P>0.05)。治疗14 d 后,与假手术组比较,模型组大鼠mNSS 升高 (q 检验统计量= 17.420,P<0.05); 与miR-NC 组比较,miR-181b 组大鼠mNSS降低(t=14.730,P<0.05)。 提示造模成功。 见表1。
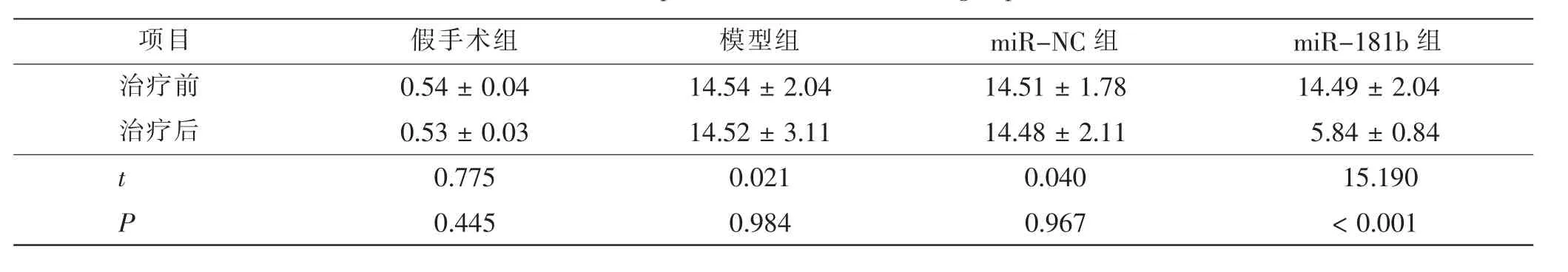
表1 4 组大鼠mNSS 比较Tab.1 Comparison of mNSS of rats in 4 groups
2.1.2 4组大鼠脑梗死面积比较
与假手术组(0.08±0.01)比较,模型组大鼠脑梗死面积增加(79.11±9.05。 t=34.000,P<0.05)。 与miR-NC 组(71.01 ± 7.23)比较,miR-181b 组大鼠脑梗死面积降低(24.12±5.32。t=21.160,P<0.05)。 见图1。
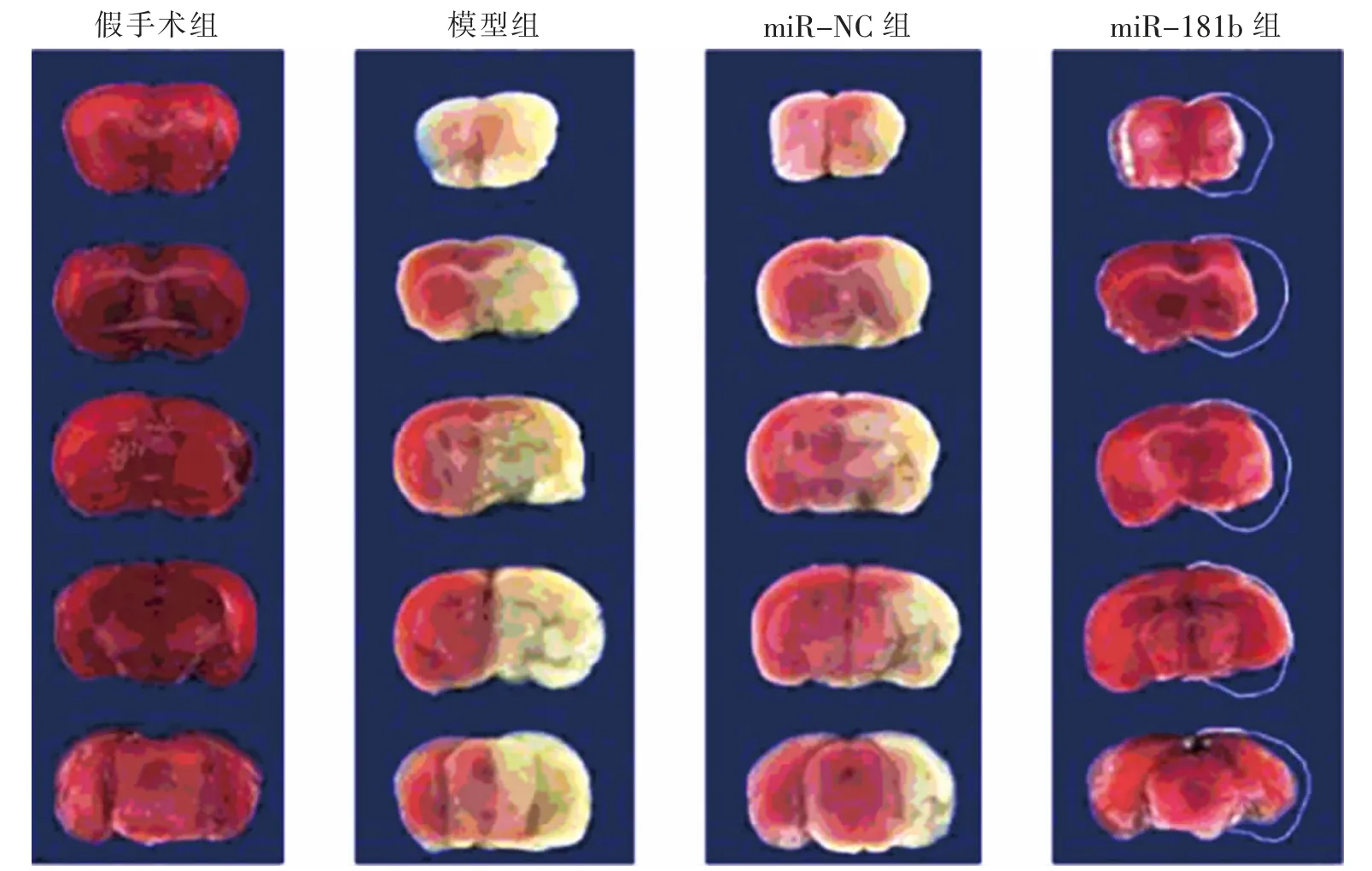
图1 4 组大鼠脑梗死面积比较Fig.1 Comparison of cerebral infarction area of rats in 4 groups
2.1.3 4 组大鼠脑组织中miR-181b 表达水平比较
与假手术组(0.74±0.11)比较,模型组大鼠脑组织中miR-181b 表达下降(0.14±0.02。t=20.780,P<0.05)。 与miR-NC 组(0.16±0.03)比较,miR-181b 组大鼠脑组织中miR-181b 表达升高 (3.02±0.45。 t=24.56,P<0.05)。
2.1.4 4组大鼠脑组织中CD34、VEGF 蛋白表达水平比较
与假手术组比较, 模型组大鼠脑组织中CD34、VEGF 阳性细胞率 (45.03 % ± 5.22 % vs 76.11 % ±6.02%、25.06%±5.11%vs 89.43%±8.07%)及蛋白表达水平(0.25±0.06 vs 0.91±0.09、0.21±0.04 vs 0.89±0.11)下降(t=15.37、26.27、23.63、22.50,P<0.05)。 与miR-NC 组比较,miR-181b 组大鼠脑组织中CD34、VEGF 阳性细胞率(68.73%±7.04%vs 43.76%±5.17%、21.43%±5.02%vs 0.23%±0.06%) 及蛋白表达水平(0.91±0.09 vs 0.86±0.12、0.72±0.09 vs 0.19±0.02)升高(t=11.26、14.88、18.19、22.26,P<0.05)。 见图2、3。
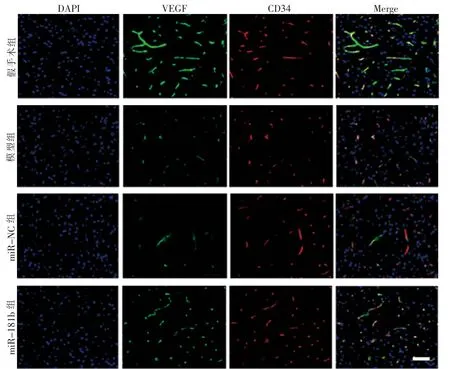
图2 免疫荧光检测4 组大鼠脑组织CD34、VEGF 蛋白表达(50 μm)Fig.2 Diagrams of CD34 and VEGF expression in brain tissue by immunofluorescence in 4 groups(50 μm)

图3 Western blot 检测4 组脑组织CD34、VEGF 表达电泳图Fig. 3 Electrophoretograms of CD34 and VEGF expression in brain tissue by Western blot in 4 groups
2.2 体外实验
2.2.1 3组细胞miR-181b 表达水平
Control 组与miR-NC 组细胞miR-181b 表达水平(0.24±0.06、0.25±0.07)比较,差异无统计学意义(t=0.188,P>0.05);而miR-181b 组细胞miR-181b表达水平(2.31±0.32)高于miR-NC 组(t=10.890,P<0.05)。
2.2.2 过表达miR-181b 对HUVEC 增殖、迁移的影响
Control 组与miR-NC 组细胞24 h、48 h 及72 h OD 值、迁移率(0.24±0.03 vs 0.23±0.03、0.34±0.04 vs 0.31 ± 0.03、0.63 ± 0.05 vs 0.58 ± 0.04、0.33 ± 0.04 vs 0.34±0.06)差异无统计学意义(OD 值:t=0.480、1.414、2.041,P > 0.05。 迁移率:t = 0.480,P > 0.05)。 miR-181b 组细胞48 h 及72 h OD 值、迁移率高于miR-NC组(0.47±0.05 vs 0.34±0.04、0.99±0.06 vs 0.63±0.05、0.87 ± 0.11 vs 0.34 ± 0.06)(OD 值:t = 6.245、17.29,P<0.05。 迁移率:t=7.326,P<0.05)。 见图4。

图4 过表达miR-181b 对HUVEC 迁移的影响Fig.4 Diagram of effect of overexpression miR-181b on HUVEC migration
2.2.3 过表达miR-181b 对HUVEC 成管作用的影响
Control 组与miR-NC 组成管长度(1 234±103 vs 1 253±104)、分支长度(1 524±111 vs 1 563±109)、连接数(18±1 vs 19±2)和网孔数(4±1 vs 5±1)比较,差异无统计学意义(t=0.225、0.434、0.775、1.519,P>0.05)。 miR-181b 组成管长度(2 484±105)、分支长度(1 234±103)、连接数(53±6)和网孔数(21±3)高于miR-NC 组 (t = 14.43、14.97、9.311、8.337,P<0.05)。 见图5。

图5 过表达miR-181b 对HUVEC 成管作用的影响Fig.5 Diagrams of effect of overexpression miR-181b on angiogenesis of HUVEC
2.2.4 miR-181b 与PTEN 的靶向关系
Control 组与miR-NC 组细胞PTEN 蛋白表达水平比较(0.43±0.07 vs 0.42±0.08),差异无统计学意义(t =0.163,P>0.05);而miR-181b 组细胞PTEN 蛋白表达水平(0.12±0.02)低于miR-NC 组(t=6.301,P<0.05)。
与假手术组比较,模型组大鼠脑组织PTEN 蛋白表达水平(0.93±0.05 vs 0.31±0.04)升高(t=16.770,P<0.05)。 与miR-NC 组比较,miR-181b 组大鼠脑组织PTEN 蛋白表达水平(0.37±0.02 vs 0.96±0.08)降低(t=12.390,P<0.05)。
miR-181b 与PTEN 核苷酸存在结合位点。 WTPTEN + miR-181b 组细胞荧光素酶活性低于WTPTEN + miR-NC 组 (0.21 ± 0.01 vs 1.00 ± 0.01)(t =61.19,P<0.05)。 这些结果提示两者存在靶向调控关系。 见图6。

图6 3 组细胞PTEN 蛋白表达水平电泳图(A)和miR-181b 与PTEN 基因核苷酸结合位点(B)Fig.6 Electrophoretogram of PTEN protein expression level(A)and nucleotide binding site of miR-181b and PTEN(B)in 3 groups
3 讨论
缺血性脑卒中是一种全球性疾病,其发病率和死亡率均较高,目前尚无有效的治疗方法。普遍认为,在脑卒中后脑功能的恢复高度依赖于血液供应的有效恢复[1]。血管生成是一种生理过程,通过现有血管的延伸或扩展来形成新的血管。 这一过程依赖于内皮细胞, 并受到多种血管生成刺激因子和抑制因子的调控。 miRNAs 是一种约22 nt 的RNA, 通过与mRNA目标的3′非翻译区 (3′-untranslated region,3′-UTR)结合,介导转录后调控。 研究表明,miRNAs 在多种缺血性疾病中血管生成的调控中发挥重要作用[12~14]。 然而,血管生成相关的miRNAs 在血管生成的调控机制还有待进一步探讨。
miR-181b 是近年来发现的miRNA 重要类型,在调控血管生成中发挥重要作用。 Wang Y 等[15]发现miR-181b 促进食管癌的血管生成, 而另外研究表明miR-181b 抑制HUVEC 在体外的迁移和管形成[16]。最近研究发现,miR-181b 在缺血性脑卒中动物模型及细胞模型中表达[17],但miR-181b 是否参与调控了缺血性脑卒中血管生成尚不清楚。 笔者研究结果表明,miR-181b 在脑缺血再灌注模型大鼠脑组织中低表达,与前面研究结果一致。 mNSS 是评价脑缺血严重程度及治疗效果的常用指标。 研究结果显示,模型大鼠mNSS 明显降低,说明脑缺血再灌注大鼠存在严重的脑缺血损伤,提示造模成功;miR-181b 过表达质粒治疗后,模型大鼠的mNSS 明显下降,提示miR-181b上调改善了脑缺血大鼠的神经功能。脑梗死面积是评价神经元损害最为直接的指标。 笔者研究结果显示,miR-181b 过表达质粒治疗后的脑梗死面积显著下降,提示miR-150 可改善脑缺血梗死面积的增加。 上述结果证明miR-181b 过表达对脑缺血大鼠具有一定的改善功能。
为进一步探索miR-181b 对脑缺血大鼠脑组织中血管生成的影响, 笔者观察了脑组织中CD34、VEGF 的表达,结果发现,miR-181b 过表达质粒治疗后的大鼠脑组织高表达CD34、VEGF。 VEGF 是调控血管生成的关键因子,与受体结合后促进血管内皮细胞的增殖、迁移等,促进血管新生,改善微循环,保护神经细胞。CD34 是血管内皮细胞的标志物,其表达水平与血管数量成正比。 随后体外实验观察了miR-181b 对HUVEC 增殖、迁移及成管的影响,结果表明,上调miR-181b 可促进HUVEC 增殖、迁移及成管,提示miR-181b 过表达可促进血管新生。
miRNAs 一般与下游的靶基因结合后发挥作用,通过生物信息学网站预测发现,miR-181b 与PTEN mRNA 核苷酸存在结合位点,提示两者可能存在调控关系。 PTEN 在调控细胞侵袭和血管生成中扮演着重要角色[18]。 最近研究发现,多种miRNAs 可靶向PTEN调控缺血性疾病, 如miR-499a 可通过靶向PTEN 减轻缺血性脑卒中的星形细胞介导的炎症反应[19]。 此外,microRNA-221 通过调控PTEN/PI3K/AKT 途径调节内皮细胞功能参与缺血性脑卒中的研究[20]。笔者研究结果显示,缺血再灌注大鼠脑组织高表达PTEN 蛋白,经过miR-181b 过表达质粒治疗后PTEN 表达水平明显降低。 随后的体外实验进一步表明, 过表达miR-181b 的HUVEC 低表达PTEN, 提示miR-181b与PTEN 存在靶向关系。最后荧光素酶实验结果提示miR-181b 可负性调控PTEN。
但笔者研究也存在一些问题需要进一步解决。第一,miR-181b 在缺血性脑卒中患者外周血中表达情况需要进一步明确;其次,PTEN 对HUVEC 功能的影响需要基础研究探索。
综上所述,miR-181b 在缺血再灌注损伤大鼠脑组织中低表达, 上调miR-181b 可通过负性调控PTEN 促进新生血管生成从而保护脑组织,有望成为缺血性脑卒中的治疗靶点。

