原发性胆汁性胆管炎的肝脏硬度值与脾静动脉血流学参数的相关性分析
商 宁,黄秀香,田楠楠,陈美玲,叶迎宾,张 嫄
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是以肝内中小胆管炎症损伤为主的自身免疫性肝病[1]。 由于肝内胆汁排泄受阻,肝脏功能易出现异常[2]。 当发展为肝硬化时,PBC 患者的脾静脉和脾动脉血流量也会发生变化[3]。 目前检测脾脏血流学参数主要用彩色多普勒超声技术,用于评估肝纤维化程度主要采用瞬时弹性成像技术 (transient elestography,TE),此两种方法具有简便、快速、无创等优点。 笔者研究通过对PBC 患者的肝脏硬度值 (liver stiffness measurement,LSM)与各肝纤维化分期的脾静脉、脾动脉的血流学参数的相关性分析, 为预判PBC 患者肝脏疾病进展程度提供有效的临床诊断依据。
1 资料与方法
1.1 临床资料
选择2019年1月至2020年6月分别在北京佑安医院和邯郸市传染病医院就诊的PBC 患者83 例(PBC 组),其中男性10 例,女性73 例;年龄45 ~75岁, 平均年龄51.2 岁(标准差11.1 岁); 病程2.8 ~12.4年,平均病程7.2年(标准差3.5年)。以上患者均符合PBC 诊断标准[4],排除其他原因引起的肝病。 所有肝脏穿刺活检需征得患者本人同意后并签署知情同意书,同时该研究通过了医院伦理委员会审批。
另选取医院正常体检者50 例(对照组),其中男性11 例,女性39 例;年龄34 ~62 岁,平均年龄50.3岁(标准差10.2 岁)。 对照组中所有对象血液指标正常,均无肝病病史且肝脏彩超正常。
两组年龄、性别差异无统计学意义(t/χ2=3.624、2.324,P>0.05),具有可比性。
1.2 方法
1.2.1 彩色多普勒超声检查
患者取仰卧位,平静呼吸。 采用美国GE logiq E9型彩超仪进行诊断,设置频率为3.5 ~10.0 MHz。脾静动脉测量由1 名高年资的医师按照仪器说明书要求进行。 测量参数:脾脏厚径(mm)、脾脏长径(mm)、脾静脉内径(mm)、脾静脉最大流速(cm/s)、脾静脉平均流速(cm/s)、脾动脉最大流速(cm/s)、脾动脉最小流速(cm/s)、脾动脉阻力指数(splenic artery resistance index,SRI)。 以上参数均测量3 次取其平均值。
1.2.2 肝硬度检测
采用法国Echosens 公司的肝硬度检测仪, 凸阵探头,探头频率1 ~6 MHz。 要求患者空腹仰卧位,屏住呼吸后,选择患者右侧腋前线到腋中线第7 ~8 肋间,每次均由同一医师按照操作说明严格操作。 连续成功获得10 次回波,以中位数代表最终检测结果,即LSM,单位为kPa,当成功率(成功获得回波次数/总发射次数×100%)≥60%时结果可靠。 全部检查均由2 名受过专业培训的超声科医师完成。
1.2.3 病理组织检查
选取PBC 患者的固定肝穿组织,由北京佑安医院病理科的1 名具有5年以上经验的病理医师统一阅片。 观察胆管增生、小叶间胆管损伤、肝脏纤维化、小叶肉芽肿、小叶肝细胞坏死、胆色素聚集、单核细胞炎症、Mallory 小体等病理指标。 根据Scheuer 分期评分系统对标本进行病理分期:Ⅰ期为小胆管炎期,Ⅱ期为细小胆管增生期,Ⅲ期为瘢痕期,Ⅳ期为肝硬化期。
1.3 统计学方法
采用SPSS 19.0 软件进行统计分析。正态分布计量资料以均数± 标准差表示,组间比较采用独立样本t检验。计数资料以百分比表示,组间比较采用χ2检验。非正态分布计量资料以中位数四分位间距[M (P25~P75)]表示。 多组间比较采用F 检验,组间两两比较采用Mann-Whitney U 检验,PBC 患者的LSM 与脾脏血流学参数的相关性分析采用非参数Spearman 分析。P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 病理分期
根据Scheuer 分期评分系统对标本进行病理分期:Ⅰ期18 例,Ⅱ期20 例,Ⅲ期9 例,Ⅳ期36 例。
2.2 两组肝脏硬度值与脾脏血流学参数比较
PBC 组LSM 明显高于对照组(P<0.01)。 脾脏厚径、长径和内径均大于对照组(P<0.01)。脾动脉最大流速和SRI 值PBC 组明显高于对照组(P>0.01)。 见表1。
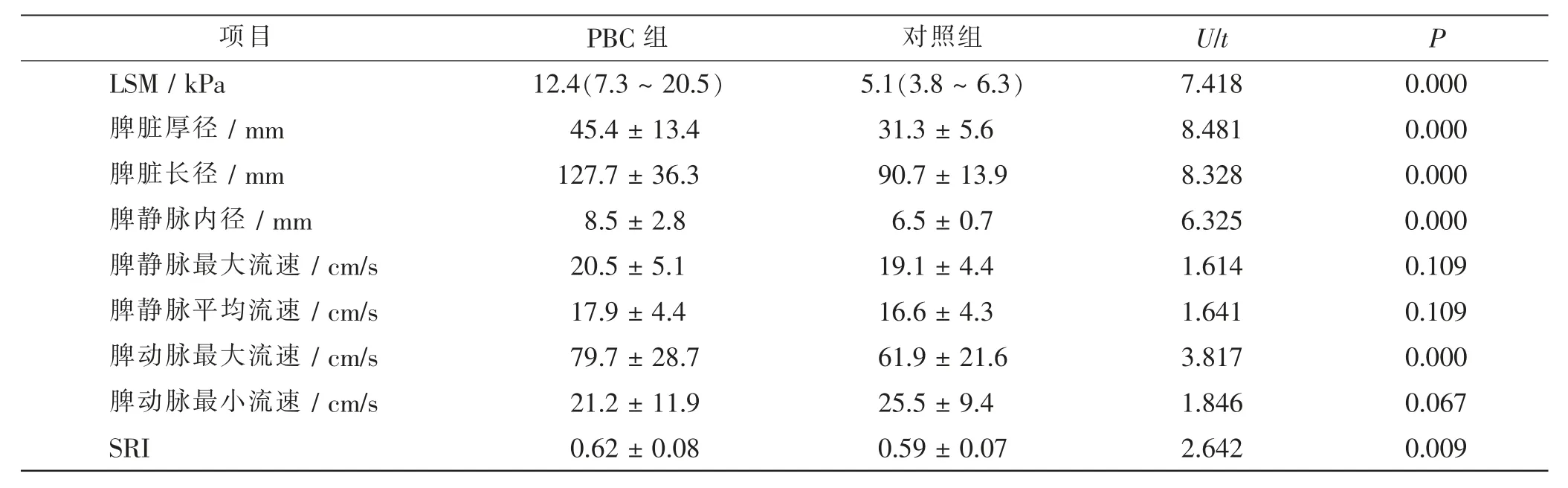
表1 两组LSM 与脾脏血流学参数比较Tab.1 Comparison of LSM and splenic blood flow parameters between 2 groups
2.3 PBC 患者脾脏血流学参数按肝纤维化分期的比较
在PBC 的各肝纤维化分期中,LSM、 脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速、SRI 差异有统计学意义(F=14.555、44.831、32.813、24.693、3.407、11.080,P<0.05)。 在PBC 患者中,Ⅳ期的LSM、脾脏厚径、脾脏长径、脾静脉内径、SRI 均高于Ⅰ期和Ⅱ期(P<0.05)。 Ⅲ期的LSM、脾脏长径、脾静脉内径均高于Ⅰ期和Ⅱ期(P<0.05)。 见表2。
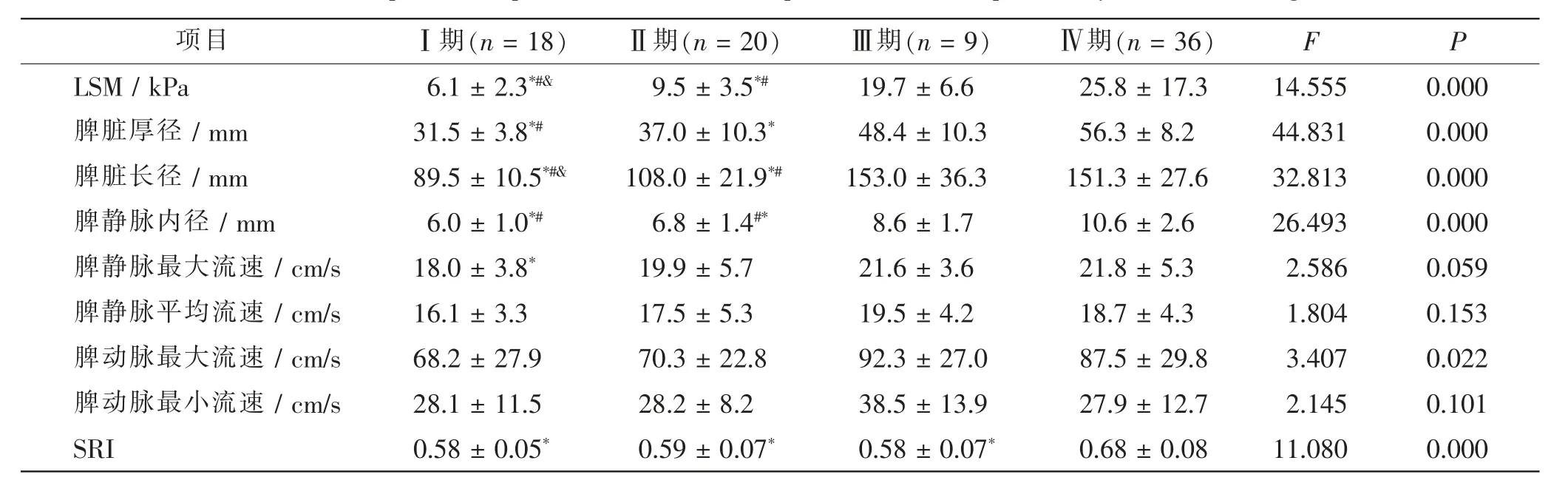
表2 PBC 患者脾脏静动脉血流学参数按肝纤维化分期进行比较Tab.2 Comparison of splenic venous blood flow parameters in PBC patients by liver fibrosis stage
2.4 肝脏硬度值与脾脏血流学参数的相关性分析
PBC 患者的LSM 与病理分期、脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速、SRI 分别呈正相关性 (r = 0.754、0.695、0.686、0.660、0.243、0.373,P =0.000、0.000、0.000、0.000、0.027、0.001), 与脾静脉最大流速、脾静脉平均流速和脾动脉最小流速无相关性(P>0.05)。
3 讨论
TE 检测LSM 值,能有效地对肝纤维程度进行评估,为临床治疗措施的选择提供依据[5]。 近年来,中国文献[6~9]报道了LSM 与各种肝炎肝硬化的肝纤维化程度呈正相关,且经过抗病毒治疗的慢性乙型肝炎肝硬化患者的LSM 值下降有利于肝脏炎症改善[10]。有研究报道,LSM 数值与丙氨酸氨基转移酶(alanine aminotransferase,ALT)呈正相关[11],合并腹水的肝硬化患者的LSM 明显高于未合并腹水的肝硬化患者[12],可见TE 是预判各种肝病肝纤维化程度的有效辅助诊断方法。
笔者研究提示,PBC 患者的LSM 明显高于对照组(P<0.01),由于PBC 患者经历了小胆管炎期、细小胆管增生期、瘢痕期、肝硬化期,以上4 期是炎症期到肝纤维化由轻到重的延续, 是LSM 值逐渐升高的过程。 Ⅳ期和Ⅲ期高于Ⅰ期、Ⅱ期(P<0.05),这也说明了LSM 随PBC 患者的肝纤维化严重程度呈现升高的趋势。 在PBC 的Ⅳ期与Ⅲ期中, 两者差别不明显,笔者认为是Ⅲ期例数少导致的,需要加大样本量再一步验证。
肝硬化患者血流动力学发生复杂变化导致高动力循环的异常变化[13~16],其脾脏被动充血,以血管生成为特征的组织增生、纤维化、脾肿大和脾淋巴组织增生过度[17]。 这些形态和功能改变可能影响脾静动脉内径和厚度的改变[18],以及脾脏动静脉循环中的超声微泡移动, 从而导致脾静动脉血流参数发生变化[19]。肝硬化患者的脾静脉内径与肝功能Child-Pugh 分级评分呈正相关(P<0.05)[16]。 脾脏厚度增加为门静脉血栓形成的独立因素,增加了门静脉血栓形成的风险[20]。有食管静脉曲张(esophageal varices,EV)脾脏厚径及脾脏长径明显高于无EV 组[21]。笔者研究提示,PBC患者脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速和SRI 均高于对照组(P<0.05),且脾脏厚径、脾静脉内径随肝纤维化分期的升高呈现增高的趋势,较其他项目变化明显。可见脾脏厚径和脾静脉内径与肝纤维病理分期密切相关, 在PBC 的辅助诊断中有较高的临床价值。
笔者研究中,PBC 患者的LSM 与病理分期、脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速、SRI分别呈正相关性(r=0.754、0.695、0.686、0.660、0.243、0.373,P = 0.000、0.000、0.000、0.000、0.027、0.001),提示PBC 患者的LSM 随脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速、SRI 的增高而增高,且与肝纤维病理分期发展相一致。 说明LSM 在诊断PBC 患者的肝纤维化程度有一定的可行性,可以通过超声检查对肝脏硬度做进一步预断。
综上所述,PBC 患者的LSM 与病理分期、脾脏厚径、脾脏长径、脾静脉内径、脾动脉最大流速、SRI 呈正相关, 可为临床评估PBC 疾病进展提供参考性依据。 但由于Ⅲ期样本量有限,对数据的统计分析有一定的影响。因此,后期将加大样本量,进一步分析肝脏硬度与脾静动脉血流学参数的相关性。

