一种可以应用于脂滴成像的希夫碱类衍生物
程文静,张 瑜,王 林,甄 帅,呼 蕾
脂滴是真菌、植物和动物体内普遍存在的富含脂质的细胞器, 在多种生物过程中起着至关重要的作用[1]。 细胞内脂质小滴(lipid droplets,LD)是富含脂质的球形细胞器, 它是内质网(endoplasmic reticulum,ER) 衍生的细胞器, 主要由甘油三酯和胆固醇酯组成,并被磷脂单分子膜和相关蛋白包围,使它们与所有其他细胞器区分开,被认为是用于能量存储的惰性储存库[2]。 LD 是具有生命力的动态物体,其具有必要的细胞分配功能,包括膜运输、融合和参与信号转导通路。最近的证据表明,LD 和许多生理过程都与脂质代谢、信号转导及细胞凋亡有关[3]。 近年来人们对LD产生了极大的兴趣。 LD 的异常蓄积与肥胖、 高脂血症、肝囊肿、动脉粥样硬化和肾癌等癌症有关[4]。此外,LD 还与炎症和传染病有关[5]。据报道,LD 参与了各类病原体的传染病发病机制,如病毒[6]、细菌[7]、真菌[8]、原生生物[9],这表明LD 参与宿主对感染的先天性和适应性免疫反应。 宿主LD 也可能被利用作为病原体逃避免疫系统适应的一部分,并作为细胞内病原体的能量来源[10,11]。 因此,准确监测LD 对分析其生物代谢至关重要,有助于诊断相关早期疾病。
脂滴的固有环境是亲脂性的。 据此判断具有高疏水性的亲脂性有机染料可能具有潜在的脂滴染色能力。 带受体-供体的有机染料通过引入大杂环来增加受体的吸电子能力, 得到的有机染料通常表现出更红的荧光、 更高的疏水性和更大的双光子吸收截面,但细胞穿透性较低。 因此应调整疏水性和细胞渗透性之间的平衡。然而实现这一目标的空间非常有限。另一方面,基于二萘酰亚胺的供体-受体分子已被证明是活体细胞荧光检测和生物成像的优异探针[12]。通过引入二萘酰亚胺的受体单元, 笔者合成了一个新的基于芘的希夫碱类脂滴荧光探针——1 氢-苯并异喹啉衍生物[1-pyrenecarboxaldehyde,2-(2,3-dihydro-1,3-dioxo-2-propyl-6-yl)hydrazone,BPD],用于活细胞中的脂滴可视化并实现了对脂滴的可视化成像, 为实时检测脂滴动态水平提供了一种可行的方案。
1 材料与方法
1.1 实验材料与仪器
1.1.1 实验材料
4-溴-1,8-萘二甲酸酐、正丙胺、80%水合肼、1-芘甲醛、冰醋酸、无水乙醇、甲醇、二氯甲烷(分析纯。富宇化工,中国)、普朗克127(中国阿拉丁试剂公司)。
1.1.2 实验仪器
V-550 紫外可见分光光度计 (SHIMADZU 岛津公司,日本);F-4700 荧光光谱仪(日立公司,中国);FM4 积分球;MercuryPlus-400 核磁共振光谱仪(Bruker 布鲁克公司, 瑞士);WATERS I-Class VION IMS QTof 质谱仪 (沃特世科技公司, 美国);Nikon A1MP(尼康公司,日本);120 kV 投射电子显微镜(赛默飞科技公司,美国)。
1.2 方法
1.2.1 探针分子的合成方法
探针分子的合成分为三步。首先以4-溴-1,8-二萘酸酐和丙胺为原料在无水乙醇溶剂中合成S1,然后将S1 与过量的80%水合肼反应得S2, 之后进一步与1-比甲醛反应得到脂滴探针分子芘希夫碱类的衍生物BPD。 合成路线如图1。
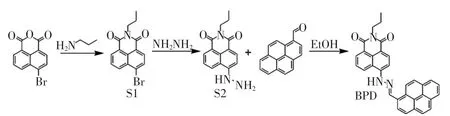
图1 探针BPD 的合成路线Fig.1 Diagram of synthetic route of probe BPD
1.2.1.1 4-溴-N-丙基-1,8-萘二甲酰亚胺(S1)的合成 分别称取1 108 mg 的4-溴-1,8-萘二甲酸酐(4 mmol)和236 mg 正丙胺(4 mmol),置于20 mL 甲醇溶液中,于氮气氛围下剧烈搅拌升温于85 ℃,随着反应的进行,体系颜色由浅黄色变为浅棕色。 持续反应8 h 后,将整个体系冷却至室温,有浅棕色固体析出、过滤,用冰甲醇溶液反复洗涤3 次,然后放入温度设置为40 ℃的真空干燥箱中干燥, 得到粗产物4-溴-N-丙基-1,8-萘二甲酰亚胺,即S1。
1.2.1.2 6-肼基-2-丙基-1H-苯并异喹啉-1,3-(2H)-二酮(S2)的合成 将312 mg 4-溴-N-丙基-1,8-萘二甲酰亚胺溶液(0.8 mmol)置于圆底烧瓶中,加入15 mL 甲醇溶液,之后滴加1.5 ~2.0 mL 80%水合肼溶液(大大过量)于圆底烧瓶中,于下剧烈搅拌下回流过夜;随着反应的进行,体系颜色由浅棕色逐渐变为橙色,反应完成后,倒入100 mL 冰水中,有大量沉淀析出,过滤,用冰水反复洗涤3 ~5 次,于真空干燥箱干燥后得粗产物, 经真空干燥后得到目标产物6-肼基-2-丙基-1H-苯并异喹啉-1,3-(2H)-二酮,即S2。
1.2.1.3 芘希夫碱类的衍生物BPD 的合成 将240 mg 6-肼基-2-丙基-1H-苯并异喹啉-1,3-(2H)-二酮(0.5 mmol)和115 mg 1-芘甲醛(0.5 mmol)置于盛有10 mL 的圆底烧瓶中,加入1 滴冰醋酸溶液,回流反应5 h;冷却至室温后析出大量红橙色沉淀,过滤,于真空干燥箱中干燥后得到红橙色固体,用甲醇溶液进行重结晶最终得到目标产物,即芘希夫碱类的衍生物BPD。
1.2.2 结构表征方法
用MercuryPlus-400 核磁共振光谱仪测量化合物的核磁共振氢谱(nuclear magnetic resonance1H spectrum,1H-NMR);F-4700 荧光光谱仪用于测试荧光光谱;FM4 积分球用于测试荧光量子产率;WATERS IClass VION IMS QTof 质谱仪用于测试高分辨质谱。
1.2.2.1 荧光光谱测试 称取目标分子2.4 mg,转移至干燥的容量瓶中。 用二甲基亚砜(dimethyl sulfoxide,DMSO)定容至5 mL,得到浓度为10–3mol/L 的探针分子母液。 荧光光谱测量时激发和发射狭缝均为2.5 nm,激发波长380 nm,在不同溶剂的发射波长为510 ~600 nm。
1.2.2.2 光物理特性和pH 依赖性测试 研究BPD在DMSO、乙腈、丙酮四氢呋喃甲苯正己烷常用溶剂中的光物理特征(V-550 紫外可见分光光度计)。为了在生理环境中监视细胞中的脂滴, 探针应在较宽的pH 范围内保持稳定性。 因此,分别测量了在各种pH环境下的BPD 的荧光光谱。 通过荧光强度变化来表征探针的稳定性。
1.2.3 探针BPD-纳米颗粒的制备和测量
为了使其具有水溶性, 将10 mg 探针BPD 溶于10 mL 四氢呋喃中,加入80 mg 普朗克F127(一种两亲性聚合物),超声溶解后,迅速倒入100 mL 去离子水中,搅拌12 h,待有机溶剂挥发后,得到水溶性的BPD 纳米颗粒(nano-particles,NP),使用超滤离心管浓缩至10 μmol/L。 对其进行动态光散射(dynamic light scattering,DLS) 测试, 使用透射电子显微镜(transmission electron microscopy,TEM)进行测试。
1.2.4 选择性测试和细胞实验
V-550 紫外可见分光光度计用于测试吸收光谱;徕卡共聚焦显微镜(德国,SP8 DIVE)用来进行共聚焦成像实验。
通过测试光密度, 研究底物F-、Cl-、Br-、I-、CN-、CO32-、NO2-、PO32-、SCN-、SO32-、ClO-、H2O2、SO42-、Al3+、Ca2+、Co2+、Cr2+、Cu2+、Fe3+、Hg2+、Mg2+、Ni+、Zn2+、循环肿瘤DNA(circulating tumor DNA,ctDNA)、半胱氨酸(Cysteine,Cys)、谷胱甘肽(Glutathione,GSH)、同型半胱氨酸(hyperhomocysteinemia,Hcy)、牛血清蛋白(bovine serum albumin,BSA)、总胆固醇(total cholesterol,TC)、葡萄糖(glucose)对BPD 荧光特性的研究。 荧光强度与对照组无太大变化,则说明研究底物对探针无识别干扰。 使用共聚焦显微镜进行了生物成像,BPD 探针孵育Hela 细胞30 min,反复洗涤3 次后,放置于共聚焦显微镜下成像,采用四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT) 进行探针BPD 的细胞毒性测试。
1.3 统计学方法
采用SPSS 20.0 软件进行统计学分析。 计量资料用均数±标准差表示,两组比较行t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 目标分子的结构表征
BPD 分子的核磁共振峰提示结构为1H-NMR(400 MHz,DMSO-d6),δ:0.90 (t,J = 8.2,3H),1.95(m,2H),3.89(t,J=8.4,2H),7.88(m,2H),8.22(t,J =8.2,1H),8.33(t,J = 12.0,2H),8.39(m,5H),8.42(d,J=12.0,1H),8.49(d,J=8.0,1H),8.73(t,J=8.4,2H),8.85(d,J = 8.4,1H),11.69(s,1H)。 MS(mass m/z):482.1794[M+H]+。 见图2。
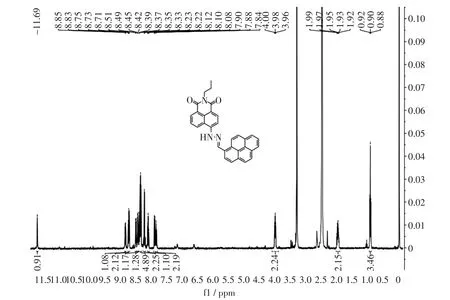
图2 BPD 探针的氢谱Fig.2 Diagram of hydrogen spectrum of probe
2.2 探针BPD 的理论计算
通过Gaussian 09 研究了BPD 在水中的理论计算[基组为B3LYP/6-31G(d,p)]。 如图3 所示,最高占据分子轨道 (highest occupied molecular orbital,HOMO)和最低占据分子轨道(lowest unoccupied molecular orbital,LOMO)状态下的能量为负值(分别为- 2.34 eV、-5.46 eV),表明探针是稳定的。 计算得到的理论偶极矩为10.49 D。 此外,能隙为3.12 eV,这意味着探针具有高的稳定性和高的化学硬度。探针在水中的荧光很弱,可能归因于水分子进攻分子的受体部分;此外,芘基团与1,8-二萘酸酐基团之间存在较大的二面角,这二者导致了分子在水中的荧光很弱。
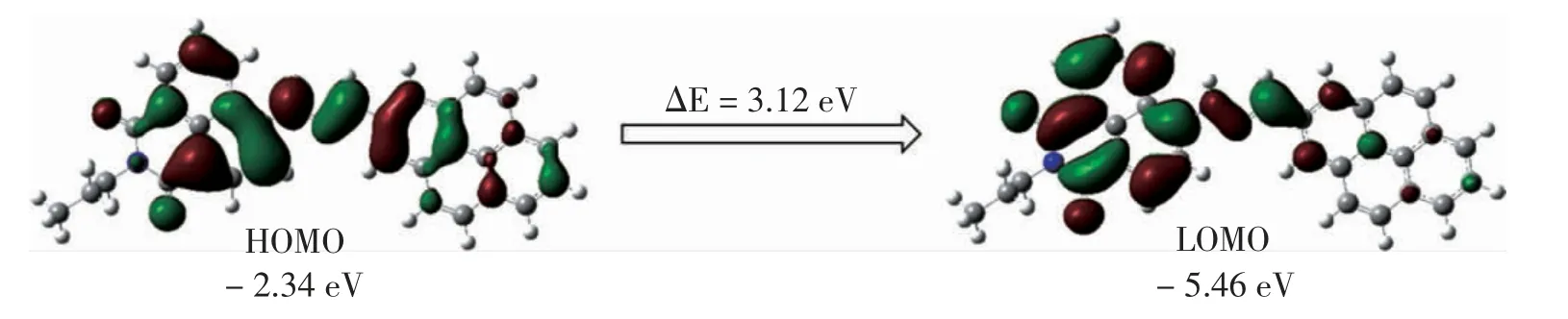
图3 BPD 的理论计算Fig.3 Diagrams of theoretical calculation of BPD
2.3 探针BPD 的光物理性质
探针在不同有机溶剂中的紫外吸收光谱和荧光光谱表明,随着溶剂极性的增加,探针BPD 显示出明显的荧光峰红移(表1)。探针BPD 在从520 nm(非极性溶剂正己烷)到590 nm(极性溶剂水)上表现出较大的荧光发射红移(约70 nm)(图4a)并且伴随着明显的颜色变化(绿色到橙色)。此外,探针BPD 在纯水中荧光发射微弱, 而荧光强度随着1,4-二氧六环比例的增加而逐渐增高,并伴随着明显的蓝移最大发射从590 nm(水)到530 nm(1,4-二氧六环),这是由于分子内的电荷转移作用(图4b)。 探针在1,4-二氧六环中表现出强荧光,并且荧光强度与在水中相比提高了约418 倍,测试得到的荧光量子产率为0.34。 探针的这种在低极性溶剂中的高亲脂性性质和高荧光发射性质为其在LD 成像中的应用提供了可能性。

表1 探针在不同溶剂中的光物理性质Tab.1 Photophysical properties of probes in different solvents
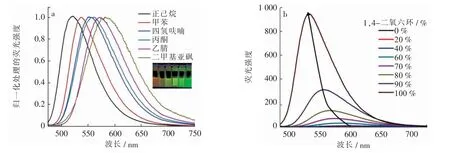
图4 在不同极性的有机溶剂中探针(10 μmol/L)的归一化后的荧光光谱(a)和不同比例的1,4-二氧六环(λex=380 nm)与水的混合物中探针的荧光光谱(b)Fig.4 Normalized fluorescence spectra of probes(10 μmol/L) in organic solvents with different polarity(a) and 1, 4-dioxane in different proportions(λex=380 nm)and fluorescence spectrum of probe in mixture with water(b)
2.4 探针BPD-纳米颗粒大小
水溶性的BPD-NP DLS 测试, 其粒径大致为80.28 nm。 TEM 观察,其形貌为圆型颗粒。 见图5。

图5 探针BPD-NP 的DLS 测试图(A)和TEM 观察结果(B)Fig.5 Images of DLS test of probe BPD-NP(A)and TEM observation result(B)
2.5 探针BPD 的pH 依赖性测试
探针于1,4-二氧六环中在宽的pH 5.0 ~9.0 内都是稳定的。这表明BPD 在检测LD 于细胞中的生物学应用方面具有很大的潜力。 见图6。
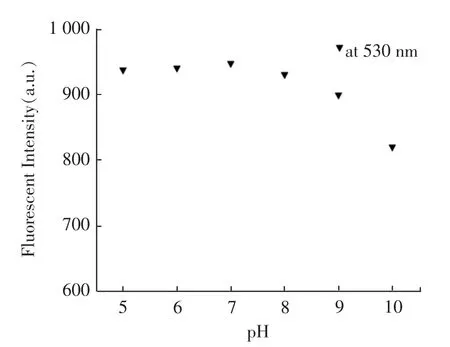
图6 探针的酸碱度(pH)稳定性Fig.6 Diagram of pH stability of probe
2.6 探针BPD 的选择性测试
荧光探针在复杂的生物系统中应具有良好的选择性,因此检测了各种分析物对BPD 荧光特性的影响。 在380 nm 激发后,其他物质对BPD 在530 nm处的荧光几乎没有干扰(图7)。 表明该探针对这些分析物呈惰性 (分析底物分别为F-、Cl-、Br-、I-、CN-、CO32-、NO2-、PO32-、SCN-、SO32-、ClO-、H2O2、SO42-、Al3+、Ca2+、Co2+、Cr2+、Cu2+、Fe3+、Hg2+、Mg2+、Ni+、Zn2+、ctDNA、Cys、GSH、Hcy、BSA、TC、glucose)。这种结构的探针通常会对F-有特异性的识别,即使在荧光下,BPD 对F-也有任何荧光信号的变化,表现为惰性。
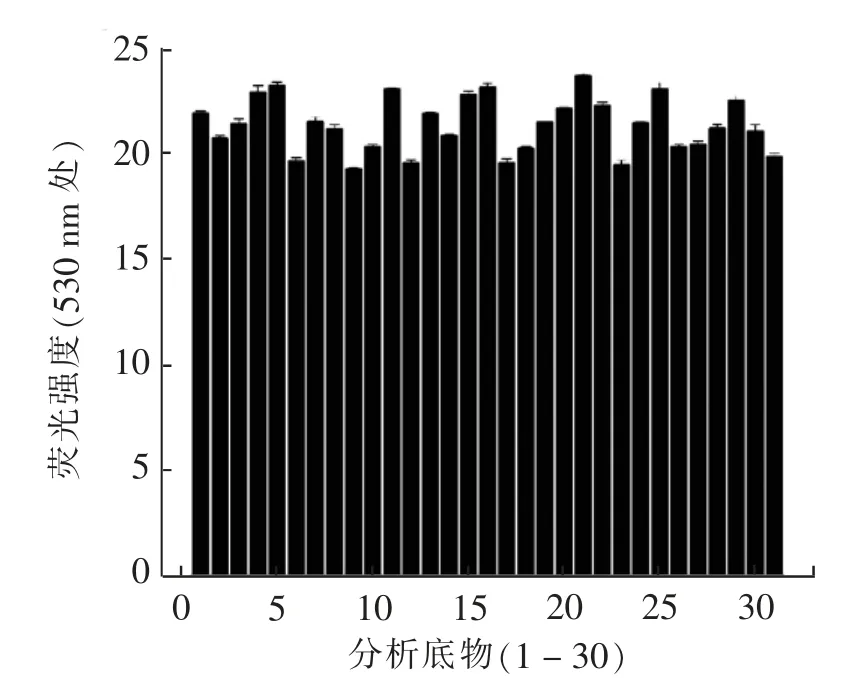
图7 探针分子对底物的选择性柱状图Fig.7 Histogram of substrate selectivity of probe molecules
2.7 探针BPD 的细胞毒性结果及在Hela 细胞中的成像
探针BPD 对细胞的毒性测试十分重要, 是判断探针能否正常发挥功能的标准之一, 通过MTT 分析探针BPD 在HeLa 细胞中对细胞的毒性。与探针(0~30 μmol/L)孵育24 h 后,细胞的存活率高于90%。 证明探针具有良好的膜渗透性及良好的生物相容性。见图8。
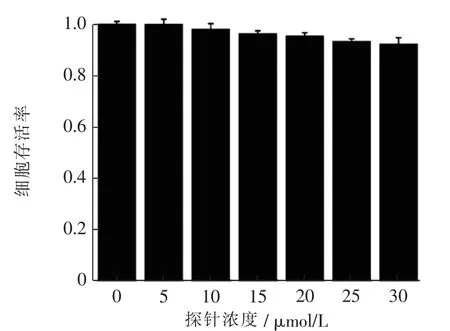
图8 用不同浓度的探针处理Hela 细胞24 h 后细胞的存活率柱状图Fig. 8 Survival rate histogram of Hela cells treated with different concentrations of probes for 24-hour
由图9 可以看出, 探针对细胞进行了良好的染色。根据文献报道,脂滴是于内质网中产生的,之后进入细胞质内进行生理活动。由图可知,部分细胞中LD聚集在了一起上并成功可视化(放大图),推断LD 可能正处于内质网中。此外,值得注意的是,探针分子在细胞中呈点状分布, 并且主要积累在LD 上 (放大图)。 这表明BPD 有能力追踪LD 的细胞内积累及可视化活细胞中的LD 的动态运动。

图9 在Hela 细胞中孵育30 min 探针(10 μmol/L)后的图像(λex =488 nm)Fig.9 Images(λex=488 nm)of probe(10 μmol/L)after incubation in Hela cells for 30-minute
3 讨论
荧光探针由于易于制备,高选择性和灵敏度及实时成像的潜力而被认为是一种出色的检测技术[13~15]。因为其结构通常会存在较大的二面角,使其不利于电荷转移,因此大多数的希夫碱类荧光探针发光很差甚至没有荧光发射,因为其结构通常会存在较大的二面角,使其不利于电荷转移[16]。由于这个特点,目前存在的大多数希夫碱类荧光探针的识别机制是基于与分析物反应后发生结构上的改变,导致整体结构更加刚性从而有利于电荷转移,因而其荧光团部分发出强烈的荧光信号,到目前为止,很少存在可视化脂滴的希夫碱类荧光探针。
笔者合成的一种基于芘的希夫碱类荧光探针BPD, 该探针在1,4-二氧六环中存在强烈的荧光发射,而在水中荧光很弱,可能是归因于水分子的进攻而淬灭荧光, 这个特点使其更加适合用于脂滴成像,因为脂滴的结构导致其有十分疏水的特性。希夫碱类荧光探针通常是作为反应型探针的,其本身发光性质并不好,因此在希夫碱类荧光探针的设计中通常加入可以淬灭荧光的识别基团或导致其具有大二面角的大空间位阻基团[17,18]。 而笔者合成的基于芘的希夫碱类荧光探针BPD 与大多数染料的荧光性质恰恰相反,探针具有极强的亲脂性,可以靶向到LD 中,且具有很高的荧光强度。 通过理论计算,发现与其他脂滴成像探针不同, 希夫碱类荧光探针BPD 在疏水的环境中,结构并不会变得太扭曲,而是保持几乎在一个平面上,这也说明了分子内仍旧存在电荷转移,且ΔE=3.12 eV。 此外,探针具有十分良好的选择性、抗干扰能力、良好的膜渗透性及生物相容性,并在宽泛的pH值中依旧存在强荧光信号。此外,探针可以在Hela 细胞中形成可视化细胞内脂滴。
(利益冲突:所有作者均声明不存在利益冲突)

