基于2D-SWE 技术评估脾脏硬度及其联合肝脏硬度在肝硬化诊断中的价值
闫冰姿,罗 燕,阮晓苗,马 琳
慢性肝脏疾病和肝硬化是目前全球严重的公共卫生难题之一[1]。肝硬化患者代偿期往往预后较好,失代偿期常因严重并发症或发展为肝癌而死亡。 目前,穿刺活检仍为肝硬化的诊断金标准, 此检查有创、操作相对复杂,临床广泛开展有一定限制。 超声二维剪切波弹性成像(two-dimensional shear wave elastography,2D-SWE)技术可以通过无创测量肝脏硬度(liver stiffness,LS)来间接反映肝脏组织病变程度[2~7],目前已广泛用于肝硬化及相关并发症的诊断,并对多种病因肝硬化都表现出较高的诊断准确性[8,9],但有研究表明LS 诊断肝硬化的稳定性较差[10,11]。 肝硬化门静脉高压会引起脾脏血液供应特点与解剖的变化,脾脏硬度(spleen stiffness,SS)变化与肝硬化的发展程度密切相关[12,13]。 笔者研究拟采用2D-SWE 技术测量并比较代偿期和失代偿期肝硬化患者SS 的差异和变化,并评估SS 及其联合LS 对不同程度肝硬化的诊断效能。
1 资料与方法
1.1 临床资料
选择2021年11月至2022年2月在四川大学华西医院就诊的肝硬化患者80 例, 其中男性48 例,女性32 例;年龄32 ~78 岁,平均年龄54.3 岁(标准差10.2 岁);身高145 ~180 cm,平均身高163.4 cm(标准差7.3 cm);体质量41 ~90 kg,平均体质量61.3 kg(标准差9.5 kg); 身体质量指数 (body mass index,BMI)15.6 ~33.1 kg/m2,平均BMI 22.9 kg/m2(标准差2.7 kg/m2);肝硬化病因,慢性乙型病毒性肝炎肝硬化49 例,胆汁性肝硬化22 例,自身免疫性肝炎肝硬化4例,酒精性肝硬化5 例。根据肝硬化分期不同,将肝硬化患者分为代偿组和失代偿组,各40 例。代偿组男性21 例,女性19 例;年龄32 ~77 岁,平均年龄54.7 岁(标准差11.0 岁);身高145~180 cm,平均身高162.5 cm(标准差8.1 cm);体质量41 ~90 kg,平均体质量62.2 kg(标准差11.2 kg);BMI 15.6 ~30.4 kg/m2, 平均BMI 23.4 kg/m2(标准差2.8 kg/m2)。 失代偿组男性27 例,女性13 例;年龄35 ~78 岁,平均年龄58.8 岁(标准差9.5 岁);身高150 ~176 cm,平均身高163.4 cm(标准差7.3 cm);体质量45 ~77 kg,平均体质量60.4 kg(标准差7.3 kg);BMI 17.5 ~28.6 kg/m2, 平均BMI 22.4 kg/m2(标准差2.4 kg/m2)。
随机选择30 例健康人群作为对照(正常组),其中男性16 例,女性14 例;年龄25 ~63 岁,平均年龄45.1 岁(标准差10.3 岁);身高155 ~185 cm,平均身高166.1 cm(标准差8.6 cm);体质量46 ~90 kg,平均体质量67.9 kg (标准差13.6 kg);BMI 18.0 ~33.1 kg/m2,平均BMI 24.5 kg/m2(标准差3.9 kg/m2)。
选择标准:①年龄18 岁以上;②肝硬化患者符合中华医学会肝病学分会2020年版《肝硬化诊治指南》[14]中关于代偿期及失代偿期肝硬化的诊断标准:当患者肝脏组织学检验、内镜检查、影像学检查等显示有肝硬化或门静脉高压的相关特征,或肝功能、血常规等检验指标提示相关异常时, 则已进入肝硬化代偿期;若出现肝功能减退和(或)严重的门静脉高压并发症(腹水、肝肾综合征、食管胃底静脉曲张破裂出血、肝性脑病等),则其已进入失代偿期。所有患者及其家属均知情同意并签署知情同意书。
排除标准:①脾脏肋间厚度<3.5 cm;②因肥胖或其他原因导致SWE 多次测量SS 值失败者;③非肝硬化引起的脾脏长大或脾功能亢进等; ④伴糖尿病、心血管系统疾病等基础疾病;⑤近期左上腹有创口未愈合者;⑥脾脏有各种占位性病变者或脾周有大量腹水(深度>3 cm)者;⑦既往有肝病史、长期饮酒史者;⑧伴肝功能衰竭或原发性肝癌者;⑨实验室检查相关指标不全者。
3 组性别、年龄、身高、体质量、BMI 指标比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 超声检查
采用Supersonic Aixplorer 超声诊断仪,SC6-1 腹部凸阵探头,探头频率1 ~6 MHz,进行常规灰阶超声及SWE 检查。
检查前患者需禁食8 h 以上[10]、休息10 min 以上[15,16]。 患者仰卧位平躺,双上肢外展平放于身侧,使肋间隙充分暴露。 常规超声检查记录肝脏形态及包膜、实质回声、腹腔积液情况、肝外门静脉内径(portal vein diameter,PVD) 及门静脉血流速度 (portal vein velocity,PVV) 等, 随后进行脾脏大小及肝脾硬度测量。①脾脏大小及SS 测量:将探头置于患者左侧腋后线的9 ~11 肋间隙,适当加压,灰阶超声同时显示脾门及脾脏最大切面,于该切面测量脾脏肋间厚度及脾脏长径。启动SWE 模式,于脾脏下份、距包膜约1 ~2 cm处选取感兴趣区域,大小约为2 cm×2 cm,分析区域直径设定为10 mm,SWE 标尺量程取0 ~70 kPa。 嘱患者平静呼吸后屏气, 待感兴趣区内基本充满颜色(填充面积≥90%) 且无颜色突变区时冻结并存储图像,于颜色均匀处测量[12]。SWE 图中,蓝色表示硬度偏软,红色表示硬度偏硬。每次检查至少重复5 次,结果取中位数。 若多次测量结果相差过大,则视为检查失败。 ②LS 测量:探头置于右侧腋前线至腋中线7 ~9 肋间隙,SWE 感兴趣区置于肝脏S5 或S6 段距包膜约2 ~3 cm 处,分析区域直径设定为15 mm,后续步骤同SS 测量[10]。SWE 弹性模量单位为kPa。所有检查及图像质量评估均由同一经验丰富的超声医师完成。
1.2.2 实验室检查
患者于超声检查同一天清晨, 空腹抽取静脉血,送实验室行生物化学、血常规检查,记录丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、总胆红素(serum total bilirubin,STB)、白蛋白(albumin,ALB)、血小板(platelet,Plt)等指标。
1.2.3 观察指标
观察并比较各组的临床资料、脾脏大小参数及肝脾硬度测量结果的差异和变化, 分析SS 与脾脏肋间厚度和脾脏长径之间的相关性, 并分析脾脏大小参数、SS、LS 及二者联合对代偿期和失代偿期肝硬化的诊断效能。
1.3 统计学方法
采用SPSS(version 22.0;IBM)和Graphpad Prism(version 8.2.1)软件进行统计学分析。 计量资料以均数± 标准差表示。 采用方差分析对各组脾脏肋间厚度、 脾脏长径及SS 进行比较, 方差齐时采用单因素ANOVA 检验, 方差不齐时采用Welch 矫正检验;组间存在差异者,进行两两比较。采用Spearman 秩相关分析法对脾脏肋间厚度和脾脏长径与SS 测值之间的相关性进行分析。 最后,采用多因素Logistic 回归建立LS 及SS 联合的回归方程, 绘制各指标受试者工作特性(receiver operator characteristic curve,ROC)曲线并获得曲线下面积 (area under curve,AUC),取Youdon 指数最大时作为最佳截断值, 计算相应的灵敏度、特异度、阳性预测值(positive predictive value,PPV)及阴性预测值(negative predictive value,NPV)。P<0.05 为差异有统计学意义,P<0.01 为差异有显著统计学意义。
2 结果
2.1 3 组肝脏相关指标
收集患者肝脏实验室检查及超声检查相关数据,作为对肝硬化患者严重程度分期的参考。3 组患者肝脏相关指标见表1。

表1 3 组肝脏相关指标Tab.1 Liver related indexes in 3 groups
2.2 代偿期及失代偿期肝硬化患者脾脏大小及硬度变化
2.2.1 3组脾脏肋间厚度、长径及脾脏硬度比较
正常组、代偿组、失代偿组脾脏肋间厚度分别为(3.8±0.5)cm、(4.9±0.9)cm、(5.5±0.9)cm,脾脏长径分别为 (10.0 ± 1.5) cm、(12.6 ± 1.9) cm、(13.2 ±1.8) cm,3 组间差异均有显著统计学意义 (P<0.001); 正常组、 代偿组、 失代偿组SS 测值分别为(16.3±2.2)kPa、(34.9±7.9)kPa、(47.2±11.5)kPa,3 组间差异有显著统计学意义 (P<0.001)。 两两比较,上述三类数据其任意两组间差异均有统计学意义(P<0.05)。 见表2。
2.2.2 脾脏硬度与脾脏肋间厚度及长径的相关性分析
相关分析结果示,SS 随脾脏长大而增大。SS 与脾脏肋间厚度、脾脏长径均呈正相关,相关系数分别约为0.743 和0.624(P<0.001)。 见图1。
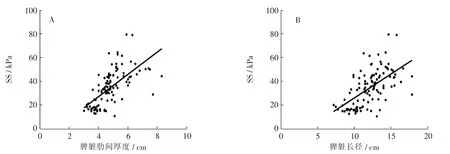
图1 SS 与脾脏肋间厚度(A)和脾脏长径(B)的相关性分析Fig.1 Correlation analysis between SS and spleen intercostal thickness(A)and spleen length(B)
2.3 3组脾脏SWE成像表现
应用2D-SWE 成功获取了正常组、代偿组及失代偿组患者的SS 测值。 正常组患者脾脏SWE 图多表现为浅蓝色(图2A),代偿组患者多表现为青绿色-浅黄色,取样框充盈较好,颜色较均匀(图2B),以青绿色为主; 失代偿组脾脏SWE 表现为黄-橙-红色, 多为红黄相间的混杂色, 以橙黄色为主(图2C)。
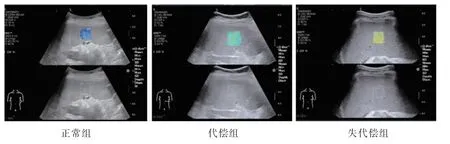
图2 3 组脾脏SWE 影像对比Fig.2 Comparison of spleen SWE images in 3 groups
2.4 各指标对代偿期及失代偿期肝硬化的诊断效能分析
绘制脾脏肋间厚度、脾脏长径诊断代偿期及失代偿期肝硬化的ROC 曲线。 脾脏肋间厚度诊断失代偿期肝硬化的AUC 为0.733[95%可信区间(confidence interval,CI)0.623 ~0.843。P<0.001],以5.0 cm 作为截断值,灵敏度、特异度、PPV 及NPV 分别为67.5%、70.0%、77.4%、57.1%;脾脏长径诊断失代偿期肝硬化的AUC 为0.581,差异无统计学意义(P>0.05)。
分别绘制LS、SS 及二者联合诊断代偿期和失代偿期肝硬化的ROC 曲线。LS 鉴别代偿期及失代偿期肝硬化的AUC 为0.757,以15.5 kPa 为截断值,灵敏度、特异度、PPV 及NPV 分别为75.0%、72.5%、73.2%及74.4%。SS 诊断失代偿期肝硬化的AUC 为0.818,以37.3 kPa 作为截断值, 灵敏度、 特异度、PPV 及NPV 分别为82.5%、67.5%、71.7%及79.4%。 运用Logistic 回归所得肝脾硬度联合的回归方程为Z =0.138×SS+0.144×LS-7.916(P<0.05),由Z 值绘制肝脾硬度联合的ROC 曲线,其AUC 为0.854,灵敏度、特异度、PPV 及NPV 分别为87.5%、72.5%、76.1%及85.3%,均高于单独运用肝脏或脾脏硬度。 见表3及图3、4。
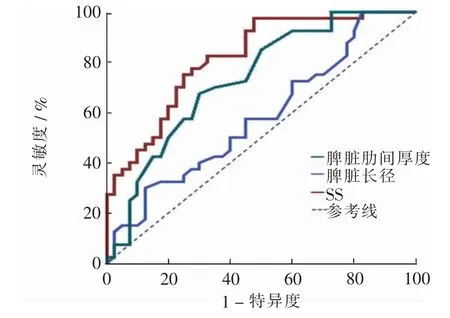
图3 脾脏肋间厚度、脾脏长径及SS 的ROC 曲线Fig. 3 ROC curves of spleen intercostal thickness, spleen length and SS
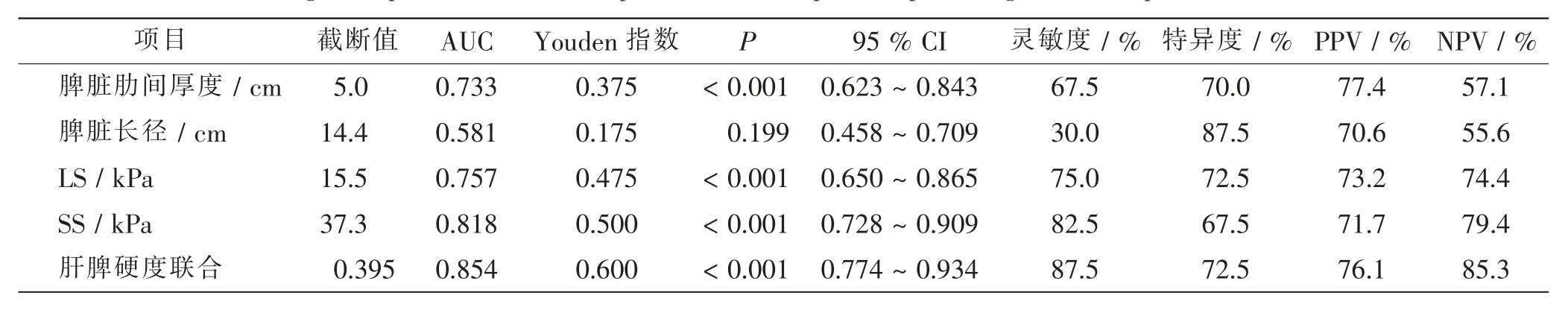
表3 SS、脾脏肋间厚度、脾脏长径对失代偿期肝硬化的诊断效能Tab.3 Diagnostic performances of SS,spleen thickness,splenic bipolar length in decompensated liver cirrhosis
3 讨论
中国是目前全球肝病发病较多的国家之一[17]。2016年,中国慢性肝病及肝硬化患病人数已升高至1 200 万人,且患病人群不断年轻化[18]。 肝硬化时,肝小叶内纤维组织增生,肝窦受压变窄甚至闭塞,肝内血管阻力增加导致门静脉回流受阻而压力增高,引起门静脉高压及一系列相关并发症[19,20],严重影响患者的生存。 然而,目前对肝硬化严重程度的诊断金标准为穿刺活检,为侵入性检查,患者依从性差。因此寻找一种无创便捷且能够早期评估肝硬化程度的方法尤为重要。超声SWE 是近年来发展起来的新超声技术,其通过检测特定动态应力激励组织产生的剪切波在组织内部传播的速度来反映组织的硬度,从而实现组织硬度的定性或定量表示[21~23]。 相较于其他弹性成像技术,2D-SWE 有实时、准确性高、受腹水、肥胖等的影响小等优点[4,24]。

图4 LS、SS 及二者联合的ROC 曲线Fig.4 ROC curves of LS,SS and their combination
目前SWE 测量LS 已广泛应用于对肝纤维化程度的评估[9]。 Luo QT 等[25]Meta 分析表明,2D-SWE 所测量的LS 对肝纤维化各分期的鉴别都有较好的准确性(P < 0.05);笔者研究ROC 曲线分析结果表明LS 诊断失代偿期肝硬化的AUC 为0.757,具有一定的诊断价值。 然而,随着肝硬化程度发展,LS 测量值将具有较大的变异性。 首先,LS 只能反映肝脏本身的变化, 而肝硬化晚期的门静脉压力主要由肝外因素决定[10,11];其次,LS 测值受到多种患者相关因素的干扰,Bazerbachi F 等[26]纳入16 082 例患者的Meta分析中,发现糖尿病、血脂异常、腰围、肝炎活动性和检查时收缩压对LS 测量结果的改变有统计学意义。 研究表明,LS 测值受肝炎活动性影响较大,在不同ALT 水平的患者中,其诊断肝硬化的效能不如SS稳定[27~29]。
欧洲超声医学与生物学联合会(European Federation for Ultrasound in Medicine and Biology,EFSUMB)于最新的超声弹性成像应用于肝外组织的指南和建议中, 提出了SS 替代LS 用于肝纤维化分期指标的可行性[16]。 脾脏变大是肝硬化较早出现的体征,由肝硬化患者门静脉高压所致脾脏血液回流受阻引起。此外,由于特定信号通路的过度激活,脾脏发生淋巴细胞增殖、白髓增生、新生血管形成及组织纤维化等改变[30],上述改变共同导致SS 的增加。 并且脾脏位置表浅,便于获得高质量的SWE 图像[31]。 目前,对于SS 预测临床显著性门静脉高压及高危食管静脉曲张已有较多证据, 但是在代偿期和失代偿期肝硬化患者的SS 变化及其与正常人的差异方面尚无统一的结论。笔者研究中,随着肝硬化程度的发展,脾脏大小及SS均逐渐升高, 且SS 与脾脏肋间厚度和脾脏长径间均具有较强的相关性,与Zhu YL 等[32]相关研究结果相近, 证实SS 对肝纤维化及肝硬化的鉴别具有良好的性能。 Samir AE 等[33]研究表明,SS 检测临床显著肝纤维化和肝硬化的AUC 为0.88, 灵敏度和特异度分别为0.70 和0.87。Colecchia A 等[34]研究表明,SS 的升高是临床失代偿期的危险因素。 笔者研究发现SS 对失代偿期肝硬化的诊断具有良好的价值。以37.3 kPa 为截断值,SS 诊断临床失代偿期的AUC 为0.818,灵敏度及特异度分别为82.5%及67.5%, 且其诊断效能优于LS、脾脏肋间厚度及脾脏长径。
然而,SS 在临床的大范围推广仍存在一定的限制, 因为其对脾脏较小或脾脏已切除的患者并不适用,且较易受肺、肠气、中心型肥胖等的干扰而影响其可重现性[16]。 一项2020年的共识声明表明,目前关于SS 诊断肝硬化的证据水平仍然较低, 尚无法推荐SS作为诊断肝硬化的指标[35]。 王超君等[36]曾将LS、SS 与AST 与Plt 比值指数联合以对肝硬化食管静脉曲张程度进行探究,结果显示三者联合的诊断效能均高于三者单独运用。笔者研究肝脾硬度联合对鉴别失代偿期与代偿期肝硬化的AUC 为0.854,高于SS 或LS 单独运用,表明在SS 基础上联合LS 应用能够进一步提高其诊断效果。 因此可将SS 测量纳入对肝硬化患者的常规评估中,以帮助对肝硬化患者病情的早期评估及并发症的预测。
此外,笔者研究存在一定的局限性。首先,研究样本量较少,是一项单中心的研究,可能会对结果支撑作用小;其次,由于对腹水的分度具有主观性,研究中部分患者未获取到完整的Child-Pugh 分级资料,因而无法对SS 与Child-Pugh 评分之间进行相关性分析;最后,研究所纳入肝硬化患者的病因多样,由于不同疾病组织的病理生理学改变及病程发展有一定差异, 其SWE 检查结果与肝硬化发展程度之间的关系可能有所不同。 关于SS 在不同程度肝硬化诊断中的应用价值,尚有待进一步扩大样本量,针对肝硬化不同病因及Child-Pugh 分级进行综合评估。
4 结论
应用2D-SWE 技术成功获取了SS 测值。 随着肝硬化程度的加重,SS 逐渐升高。SS 在鉴别代偿期与失代偿期肝硬化中具有较好价值, 在此基础上联合LS可进一步提升其诊断效能。

