胃间质瘤并发肝内胆管细胞癌、胰腺导管内黏液性乳头状瘤的多原发肿瘤1例
张秀美 徐伟伟
1青岛大学附属威海市中心医院医学影像科,威海 264400;2青岛大学附属威海市中心医院胃肠外科,威海 264400
多原发肿瘤(multiple primary tumors,MPT)的诊断标准首次由Warren和Gates提出,依据原发肿瘤发生间隔时间不同分为同时性和异时性,<6 个月为同时性,≥6 个月为异时性[1]。MPT 的发生率为0.7%~14.5%,多为双重癌,三重癌患者约占0.5%[2-3]。对于MPT,临床容易误诊为转移瘤或原发肿瘤复发,随着影像技术的不断发展,影像学检查为疾病的诊断提供了有力的诊断价值。既往研究报道,能谱CT 根据不同物质在不同能量X 线下衰减系数的不同(能谱曲线特点),可提高术前疾病种类及病理类型判断的准确性[4]。本文通过术前能谱增强分析能谱曲线特点,证实各脏器病灶并非同源,避免术前穿刺活检诊断的有创检查,进而为患者赢得手术机会。
临床资料
男,70 岁,因“查体发现肝脏占位7 d,胰腺占位3 d”于2019年1月2日来青岛大学附属威海市中心医院就诊,曾于当地医院行上腹部CT 平扫提示肝内低密度灶,胰腺前方软组织肿块,胰头囊性灶伴胰管、胆总管扩张,建议增强检查。患者无腹痛、腹胀,无发热、黄疸,二便正常,体质量无变化;查体无异常;既往有高血压病史。入院后行上腹部能谱CT增强:肝右叶不规则环状强化灶,平衡期渐进性强化(图1A、1B);胃体小弯侧囊实性占位,局部与胃浆膜关系密切,呈不均匀强化(图1C);胰腺头部囊性灶与主胰管相通伴胰管扩张,增强未见明显强化(图1D、1E)。诊断:肝血管瘤?胃间质瘤?胰腺导管内乳头状黏液性肿瘤。能谱曲线示三者走行不一致(图1F)。化验检查:血常规、生化正常;肝功:丙氨酸转氨酶148 IU/L、谷氨酰转肽酶156 U/L(略升高);消化道肿标:癌胚抗原5.99 μg/L,糖类抗原(CA)-242 16.5 IU/ml,血清CA199 33.75 U/ml,升高;甲胎蛋白正常;淀粉酶显著升高(3 200 IU/L)。于2019 年1 月4 日行胰十二指肠切除+肝右叶肿瘤切除+胃小弯肿瘤切除术,术后病理示:高分化胆管细胞癌(肝右叶肿瘤)(图2A),手术切线未见肿瘤。胃肠道间质肿瘤(胃肿瘤)(图2B),肿物大小:6.0 cm×5.0 cm×4.5 cm,切面大部分呈囊性,囊内积血,梭形,核分裂象<5/50 HPF,危险度分级:中等。胰腺导管内乳头状黏液性肿瘤,细胞生长活跃,管壁可疑浸润(胰、十二指肠)(图2C);胰腺周围淋巴结2枚未见转移癌(0/2)。术后随访3年未见肿瘤复发。
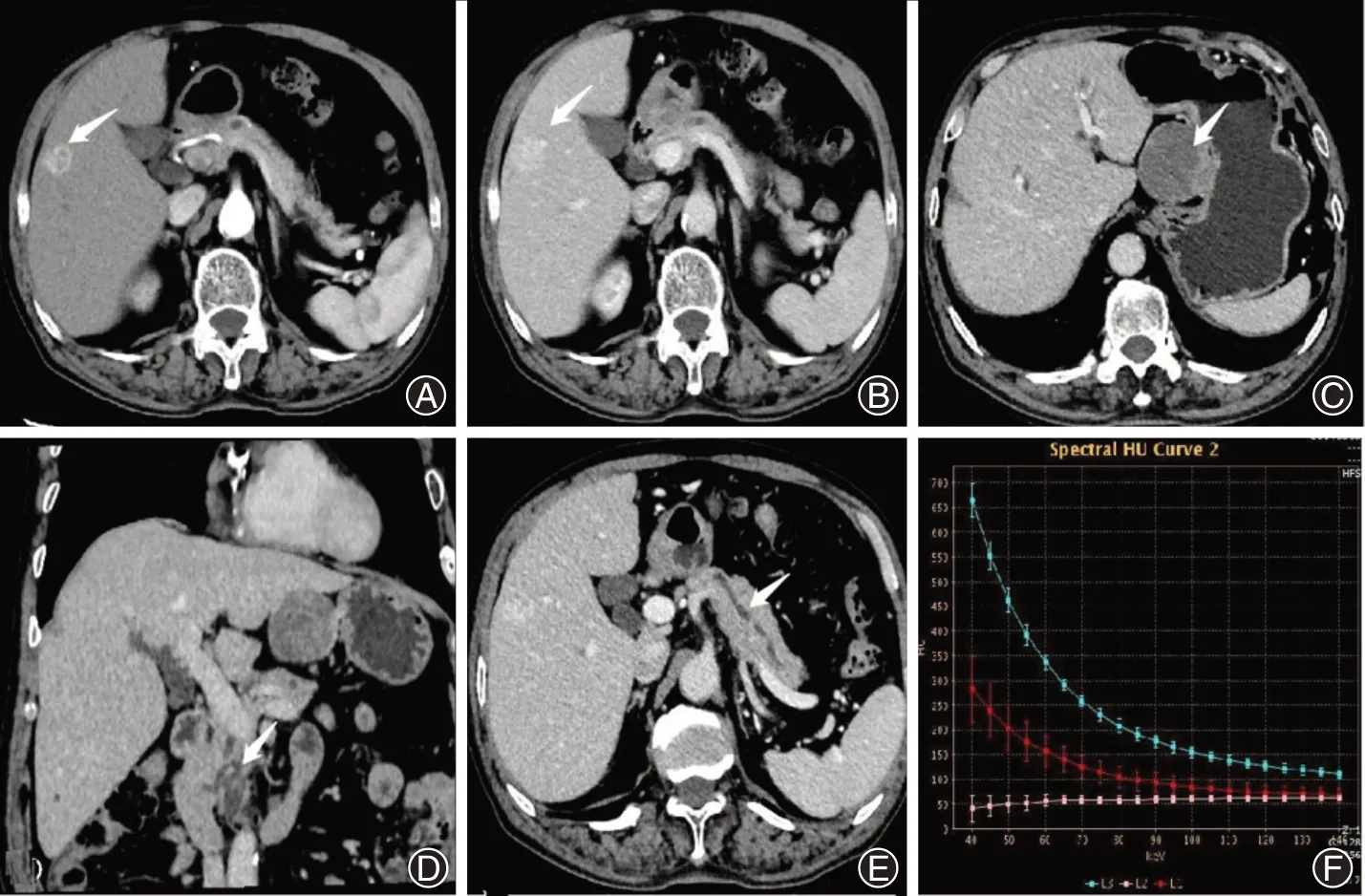
图1 上腹部能谱CT 增强及能谱曲线。A、B:肝右叶不规则环状强化灶(白箭头),平衡期渐进性强化;C:胃体小弯侧囊实性占位(白箭头),呈不均匀强化;D、E:胰腺头部囊性灶与主胰管相通伴胰管扩张(白箭头),增强未见明显强化;F:能谱曲线(L1胃L2胰腺L3肝脏),显示3个病灶能谱曲线走行不一致,提示三者并非同源

图2 病理情况(HE ×200)。A:符合高分化胆管细胞癌(肝右叶肿物),免疫组化:CK7(+),CK20(-),CDX2(弱+),CEA(+),Ki-67(+,20%),CK19(+),Glypican-3(-),Hep-1(-);B:胃肠道间质瘤(胃体小弯侧),细胞呈梭形,核分裂象<5/50 HPF,危险度分级:中等。免疫组化:CD117(+),DOG1(+)Ki-67(+,2%),SMA(-),desmin(-),S-100(-)。C:胰腺导管内乳头状黏液性肿瘤(胰、十二指肠),细胞生长活跃,管壁可疑浸润;胰腺周围淋巴结2枚未见转移癌(0/2)
讨论
本例患者查体时同时发现3 个不同脏器的病灶,对于临床的诊断和治疗是一个巨大的挑战,术前准确诊断对手术方案的制定具有重要意义。在本文中,CT 表现为胃小弯侧占位位于胃壁浆膜下,向外生长,胃黏膜光整,胃周没有发现肿大淋巴结,可排除胃癌,影像表现符合胃间质来源肿瘤,其中最常见的为胃间质瘤,对于孤立性胃间质瘤,手术切除是唯一根治治疗的方法,对于复发或转移性胃间质瘤,需要联合靶向药物治疗,如酪氨酸激酶抑制剂(伊马替尼、舒尼替尼、瑞格拉非尼等)[5]。本文患者行能谱增强CT 检查,发现胃及肝内病灶强化及能谱曲线均不一致,考虑为孤立性胃占位,行手术切除,病理证实胃间质瘤,术后未行化疗及靶向治疗。
对于胰腺病灶,主要位于胰腺头部多发囊性灶,且与主胰管相通,影像诊断胰腺导管内乳头状黏液性肿瘤较明确,且与胃内病灶能谱曲线走行不一致,排除胃间质瘤转移的诊断。根据指南[6],本文患者为胰腺头部主胰管型胰腺导管内乳头状黏液性肿瘤,且肿瘤标志物CA199 高以及淀粉酶高等条件,不能排除胰腺导管内乳头状黏液性肿瘤相关浸润性癌的可能,符合手术指征,给予胰头-十二指肠切除手术,病理示胰腺导管内乳头状黏液性肿瘤,管壁可疑浸润。术后随访3年未出现复发。
对于肝内病灶,术前影像误诊为肝血管瘤,肝血管瘤根据大小不同,其强化方式不同,最经典的表现为动脉期边缘强化,平衡期渐进性强化[7],影像学不易鉴别。本文中患者CA199 升高,不能排除胆管细胞癌可能,病灶较小,且与胃内病灶强化及能谱曲线走势不一致,临床决定手术切除病灶,最后病理证实为高分化胆管细胞癌。肝脏是胃间质瘤最常见的转移部位,因此,胃间质瘤同时出现肝内占位,临床较易误诊为转移瘤,从而延误治疗。有文献报道,胃间质瘤伴肝内占位,临床怀疑肝转移,单纯给予靶向药物舒尼替尼治疗胃间质瘤,发现肝内占位扩大,经肝穿刺活检病理证实为胆管细胞癌,最终失去手术治疗机会[8]。本文中临床没有盲目诊断肝内转移瘤而进行化疗或靶向药物治疗,亦没对患者进行穿刺活检的有创检查,本文影像检查为临床的治疗方案选择提供了有力的价值。
MPT发病机制尚未明确,大部分观点认为可能与机体的易感性、免疫状态、家族遗传、环境、放化疗导致的基因突变等因素密切相关[9]。随着对MPT 发病机制的研究,在分子生物学方面提供了值得思考的线索,如抑癌基因p53 在多原发肿瘤的发生、发展中可能起重要作用[10];肿瘤抑制基因PTEN蛋白异常表达在老年人消化道原发癌的发生中可能起重要作用[11]。大多数胃间质瘤是由涉及受体酪氨酸激酶原癌基因c-kit 和血小板源性生长因子受体(PDGFRA)基因的突变引起的[12]。高达90%的胰腺导管内乳头状黏液性肿瘤中存在致癌基因鼠类肉瘤病毒癌基因(KRAS)和G 蛋白α 亚基(GNAS)的各种体细胞突变,其他突变基因如下:CDKN2A/p16、TP53、SMAD4,以及较少见的丝氨酸/苏氨酸蛋白激酶(STK11)、鼠类肉瘤滤过性毒菌致癌同源体B(BRAF)、磷脂酰肌醇激酶-3 催化亚单位α(PIK3CA)、张力蛋白同源物基因(PTEN)[13]。胃间质瘤通常是一种散发性疾病,和其他肿瘤共存可能有共同的发病机制[14]。遗憾的是,本文患者未行基因检测,未能在遗传学及分子生物学上明确3种肿瘤之间的关系。
本例MPT 患者,随访3 年未见肿瘤复发,多原发肿瘤并不一定表明预后差。因此,在患者诊断及随访期间,发现多器官或同一器官多发病灶时,不要盲目诊断转移瘤,要警惕MPT 的可能[15]。本文通过术前能谱CT 增强检查,充分评估各肿瘤的影像特点,为患者提供最佳治疗方案,避免了误诊,为以后临床遇到类似病例提供参考价值。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明张秀美:起草文章,对文章的知识性内容作批评性审阅;徐伟伟:对文章的知识性内容作批评性审阅,指导,支持性贡献

