白藜芦醇影响金黄色葡萄球菌生物被膜形成的分子机制
唐晓华 彭琦 袁文常
1广州医科大学金域检验学院,广州 510180;2广州医科大学附属第三医院检验科,广州 510145
金黄色葡萄球菌(Staphylococcus aureus)除了可引起轻微的浅表皮肤感染外,还可引起危及生命的全身感染,如肺炎、败血症、心内膜炎和中毒性休克综合征,由于其对多种药物的耐药性,已成为一个重大的全球健康问题[1-2]。金黄色葡萄球菌生物被膜是由菌落和胞外聚合物(exopolysaccharide,EPS)粘附形成的微生物群落[3]。多糖细胞内粘附素(polysaccharide intercellular adhesin,PIA)是金黄色葡萄球菌生物被膜中的主要EPS[4]。PIA 介导细胞间粘附并形成紧密连接的生物被膜,由细胞内粘附(icaADBC)操纵子产生[5]。除了PIA,细胞外DNA(eDNA)和一些表面蛋白也有助于生物被膜的稳定性[6]。此外,eDNA 可能在生物被膜的早期粘附和成熟阶段充当静电聚合物[7],并通过将PIA 与生物被膜相关蛋白和生物被膜的其他成分连接来稳定生物被膜的结构[8]。由于生物被膜的形成,可导致金黄色葡萄球菌感染持续存在,同时,生物被膜保护的细菌细胞比浮游细胞对大多数抗生素和宿主防御系统更有抵抗力[9]。据报道,生物被膜可使抗微生物耐药性增加100~1 000倍[10]。因为受生物被膜保护的细菌比浮游细菌需要更多的抗生素去根除,所以很难在体内达到最低的抗生素浓度来根除生物被膜下的细菌。此外,一旦建立了生物被膜,就很难根除[11]。
白藜芦醇是葡萄属植物产生的一种结构类似于雌激素乙菧酚的植物抗毒素[12]。研究显示,白藜芦醇具有良好的抗炎、抗病毒、抗氧化、抗肿瘤等多种生物学活性[13]。同时,白藜芦醇也有较好的抗菌活性[14]。白藜芦醇可以抑制金黄色葡萄球菌生长,并且通过下调SaeRS 来减少金黄色葡萄球菌分泌α-溶血素[13]。然而,白藜芦醇在金黄色葡萄球菌生物被膜形成中的作用机制尚不清楚,也没有系统的研究。因此,2023 年1 月至4 月,本研究旨在探讨白藜芦醇对金黄色葡萄球菌生物被膜形成的影响及其分子机制。
材料与方法
1.菌株及主要仪器试剂
黏液型金黄色葡萄球菌SYN菌株分离自广州市某三甲医院1 例肾结石患者的肾脏脓液,是一株强生物被膜生成金黄色葡萄球菌。酶标仪(美国Biotek 公司)、实时荧光定量PCR 仪(美国BIO-RAD 公司)、TE 缓冲溶液、TEN 缓冲液(中国酷莱博公司);RNAiso Plus、TB Green Premix Ex Taq、PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit(中国TaKaRa公司);白藜芦醇(美国SIGMA 公司);胰酶大豆肉汤(tryptic soy broth,TSB)培养基、MH 培养基(中国环凯公司),荧光定量聚合酶链式反应(PCR)引物合成(中国深圳华大基因),引物序列见表1。

表1 荧光定量聚合酶链式反应引物及其序列
2.方法
2.1.白藜芦醇最小抑菌浓度(MIC)的测定 采用肉汤微量稀释法测定MIC。将细菌SYN 接种至血平板,37 ℃培养24 h。挑取血平板上单克隆菌落在生理盐水中调成0.5 麦氏浊度菌液,用MH 液体培养基按1∶100 比例稀释菌液。DMSO 溶解白藜芦醇,稀释至4 096 mg/L 母液浓度,后续实验再进行倍比稀释。在96 孔板每孔中先加入稀释后的菌液100 μl,再分别加入100 μl 药物,采用二倍稀释法使白藜芦醇的终浓度分别为2 048、1 024、512、256、128、64、32、16、8 mg/L。设置阳性对照孔(200 μl 菌液)和阴性对照孔(200 μl MH 培养基)。37 ℃培养24 h,观察结果,以抑制细菌生长的最低浓度为MIC。
2.2.不同浓度白藜芦醇下细菌生长曲线的测定 在6孔板中按照1∶100比例加入菌液及含512、256、128、64 mg/L白藜芦醇的TSB培养基,放置于37 ℃恒温摇床,200 r/min继续培养。设置3 个重复孔,以不加任何药物的孔作为阳性对照。每隔1 h测量OD600吸光度值,绘制金黄色葡萄球菌SYN的生长曲线。
2.3.结晶紫法不同浓度白藜芦醇对生物被膜形成的影响 取96 孔板,加入含不同亚抑菌浓度白藜芦醇的TSB 培养基200 μl。将过夜培养的SYN 菌液以1∶100 比例加入到含有不同浓度白藜芦醇的96 孔板中,37 ℃培养24 h 后,弃去菌液,用无菌PBS 轻柔洗涤3 次去除浮游菌,自然晾干。每孔加入200 μl 99%甲醇溶液,固定10 min,自然晾干。每孔加入200 μl 0.5%结晶紫溶液,染色15 min,用去离子水轻柔洗涤每孔直至流水无色,放入37 ℃培养箱烘干。每孔加入200 μl 33%冰乙酸,放入水平旋转仪上缓慢震荡,使孔中的结晶紫染液充分溶解,放入酶标仪测定OD590吸光度值。
2.4.苯酚浓硫酸法检测亚抑菌浓度白藜芦醇对生物被膜胞外多糖产生的影响 标准曲线的绘制:分别吸取0.4、0.6、0.8、1.0、1.2、1.4、1.8 ml 葡萄糖溶液(40 mg/L),各以ddH2O 补充至2.0 ml。加入1.0 ml 6%苯酚及5.0 ml浓硫酸,摇匀静置30 min,于490 nm测量光密度,根据葡萄糖浓度与光密度值计算绘制标准曲线。于6 孔板中按1∶100 比例将SYN 接种于终浓度为128 mg/L 白藜芦醇的TSB 培养基中,37 ℃培养24 h。舍弃浮游菌,无菌PBS 轻柔洗涤2 次,去除浮游态细菌。用3.0 ml PBS重悬生物被膜,70 ℃水浴加热1 h后,11 500 r/min 离心(离心半径10.37 cm)12 min,收集沉淀。沉淀中加入3.0 ml 3% EDTA 溶液,混匀,11 500 r/min 离心(离心半径10.37 cm)12 min。上清液用孔径为0.22 μm的微孔滤膜过滤,滤液为待测多糖样品。取样品1.0 ml,加入1.0 ml ddH2O,加入1.0 ml 6%苯酚,加入浓硫酸5 ml,充分混匀后静置30 min,测量A490吸光度值。
2.5.苯酚氯仿抽提法检测亚抑菌浓度白藜芦醇对eDNA释放的影响 于6 孔板中加入终浓度为128 mg/L 白藜芦醇的TSB 中,按1∶100 比例加入过夜培养的菌液,以不加白藜芦醇的孔作为对照组,37 ℃静置培养24 h。弃去培养液,无菌PBS 轻柔洗涤,每孔加入1.0 ml TEN 缓冲液,重悬黏附于孔板底的生物被膜,转入EP 管中,12 000 r/min 离心(离心半径10.37 cm)5 min。取上清500 μl 于预冷EP 管,加入300 μl TE 缓冲液,加入300 μl 苯酚∶氯仿∶异戊醇(25∶24∶1)进行萃取,4 ℃,12 000 r/min 离心(离心半径10.37 cm)10 min。取500 μl 上清液于预冷EP 管,加入500 μl 氯仿∶异戊醇(24∶1)再次萃取,4 ℃,12 000 r/min离心(离心半径10.37 cm)10 min。取上层水相于预冷EP管,加入3倍体积的预冷无水乙醇,1/10体积的预冷乙酸钠,混匀,20 ℃放置过夜。取出过夜后EP 管,4 ℃,15 000 r/min离心(离心半径10.37 cm)30 min后弃上清,70%预冷乙醇洗涤沉淀,在空气中晾干残余乙醇。加入20 μl TE 缓冲液充分溶解管底沉淀。Nanodrop 2000 分光光度计检测测量eDNA浓度,eDNA含量以ng/μL表示。
2.6.实时荧光定量PCR 检测生物被膜形成相关基因细菌总RNA 的提取根据Takara RNA 提取试剂盒说明书并稍加改进进行,cDNA 合成使用PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit(TaKaRa),主要操作步骤:取1.0 ml 对数期培养物于离心管,8 000 r/min 离心(离心半径10.37 cm)2 min,弃上清。加入100 μl TE Buffer,100 μl溶菌酶(20 g/L),10 μl 溶葡萄球菌素(1 mg/L),重悬菌体,37 ℃处理30 min。余下总RNA 提取根据试剂盒说明书提供的步骤进行。cDNA 的合成及实时荧光定量PCR 定量分析参考试剂盒说明书提供的步骤进行。
3.统计分析
实验结果采用GraphPad Prism 8.0 软件作图及进行统计分析,符合正态分布的实验数据均以均数±标准差(±s)表示;两组间数据比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA);P<0.05 表示差异有统计学意义。
结果
1.白藜芦醇MIC及最低杀菌浓度的测定
采用96 孔板法检测白藜芦醇对金黄色葡萄球菌SYN的抑菌活性,结果显示,1 024 mg/L 白藜芦醇浓度下的孔板溶液为澄清状态,浓度梯度8 mg/L 到512 mg/L 的孔板溶液为浑浊状态,结果表明白藜芦醇对SYN 的MIC 为1 024 mg/L。
2.白藜芦醇的动态抑菌曲线
为测定不同浓度白藜芦醇对金黄色葡萄球菌生长的影响,因此评估了1/2MIC(512 mg/L)、1/4MIC(256 mg/L)、1/8MIC(128 mg/L)浓度的白藜芦醇对SYN 生长和生存能力的影响,结果如图1 所示,DMSO 对细菌的生长几乎没有影响,128 mg/L 白藜芦醇作用下的菌株的生长曲线基本与未加入药物的对照组一致,随着白藜芦醇药物浓度的增加,对金黄色葡萄球菌的抑制作用也在增强。后续研究亚抑菌浓度白藜芦醇对金黄色葡萄球菌SYN生物被膜形成的影响选择128 mg/L的白藜芦醇处理细菌。
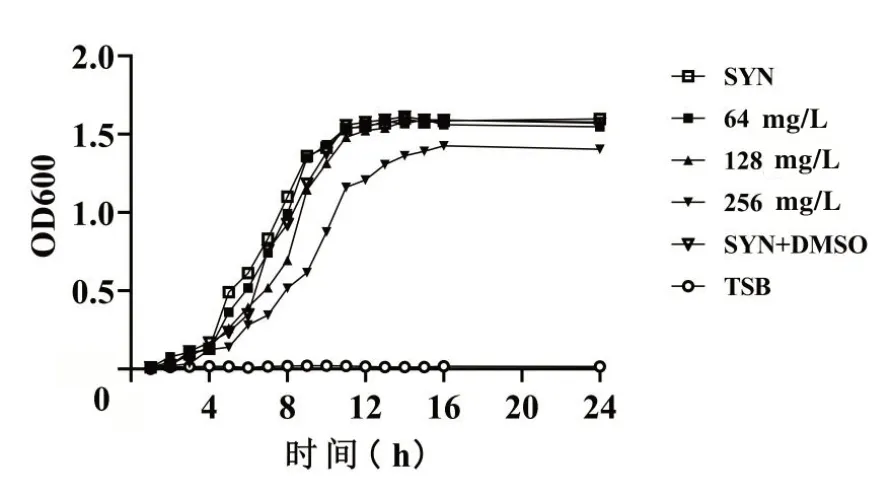
图1 不同亚抑菌浓度白藜芦醇下金黄色葡萄球菌SYN的生长曲线
3.不同浓度白藜芦醇对生物被膜形成的影响
通过微量稀释法和结晶紫染色法检测2~512 mg/L 白藜芦醇对SYN 生物被膜形成的影响。实验结果如图2 所示,白藜芦醇可以显著增强SYN生物被膜的形成,且呈浓度依赖性,浓度越高,生物被膜形成量越多。
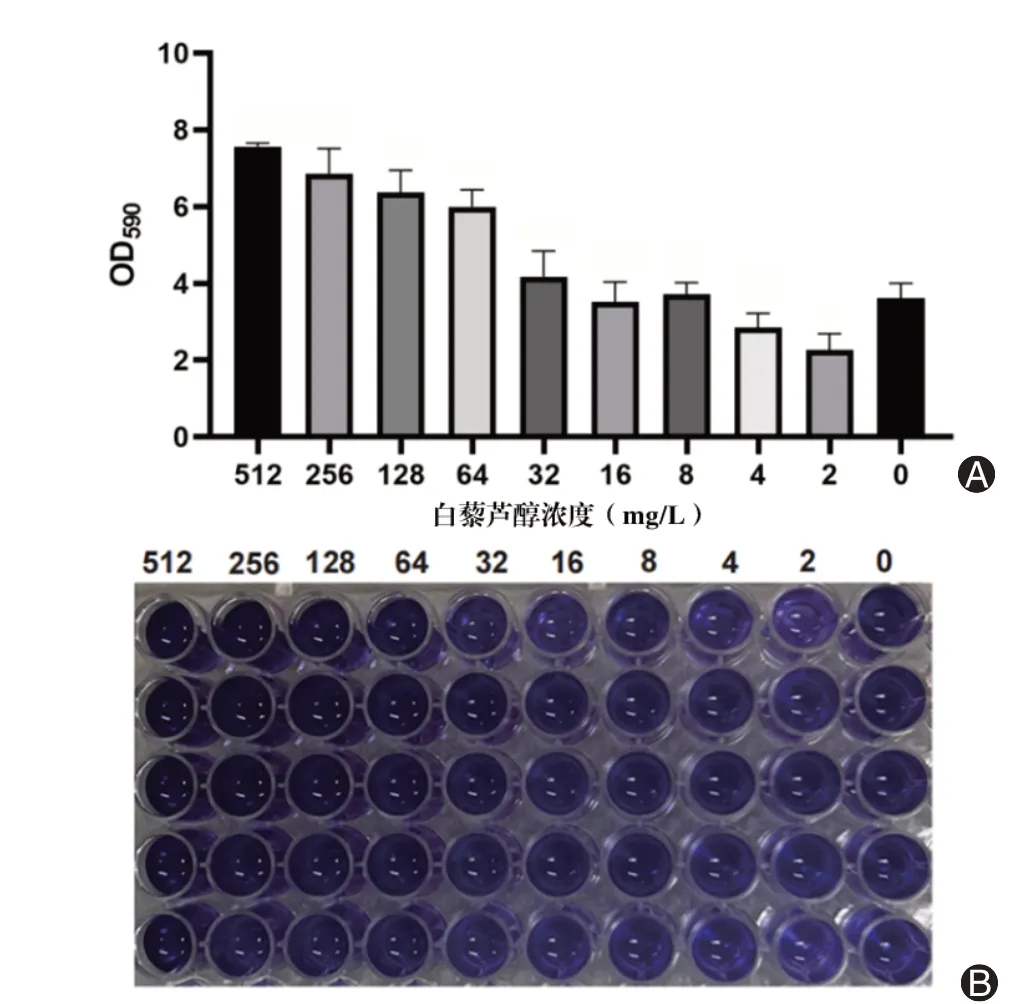
图2 白藜芦醇对SYN 菌株生物被膜的增强作用。A:不同浓度白藜芦醇对SYN 菌株生物被膜影响的吸光度值;B:不同浓度白藜芦醇对SYN菌株生物被膜的结晶紫染色
4.亚抑菌浓度白藜芦醇对胞外多糖生成及eDNA 释放的影响
胞外多糖是生物被膜EPS 中最主要的成分,通过苯酚浓硫酸法测定亚抑菌浓度白藜芦醇对SYN 胞外多糖的影响。亚抑菌浓度白藜芦醇可促进SYN 中的胞外多糖生成。生物被膜形成过程中,膜内死亡的细菌会释放eDNA,eDNA对细菌附着于载体表面及细菌之间的黏附起重要作用。结果如图3 所示,与对照组相比,亚抑菌浓度白藜芦醇可以增强eDNA释放。

图3 亚抑菌浓度白藜芦醇对SYN菌株生物被膜的影响。A:亚抑菌浓度白藜芦醇对胞外多糖生成的影响;B:亚抑菌浓度白藜芦醇对eDNA释放的影响
5.qRT-PCR 检测亚抑菌浓度白藜芦醇对生物被膜相关基因表达量的影响
我们测定了亚抑菌浓度白藜芦醇作用下生物被膜相关基因的差异表达,结果如图4 所示。亚抑菌浓度白藜芦醇作用下icaA、fnbA、clfA表达水平无明显差异,但是saeR、saeS、nuc、lrgA表达水平显著降低。

图4 亚抑菌浓度白藜芦醇对SYN菌株生物被膜形成和调节相关基因表达的影响
讨论
细菌生物被膜是细菌在生长过程中为适应生存环境的变化而附着于生物或非生物表面而形成的一种由自身产生的胞外聚合物及基质网包裹的有三维结构的菌细胞群体[6]。金黄色葡萄球菌形成生物被膜的能力是其引起复合型感染的重要特征,尤其是导管和移植物相关的体外材料[6]。生物被膜的生长使得细菌在医院环境中和宿主感染时更好地存活,是导致金黄色葡萄球菌反复感染,难以治疗的重要原因之一[6]。金黄色葡萄球菌生物被膜由复杂的细胞外基质(extracellular matrix,ECM)组成,包括PIA、eDNA和蛋白质[17]。
白藜芦醇具有多种生物活性,包括抗癌活性、免疫调节、预防心血管疾病、抗氧化、抗病毒作用及抗菌活性[13]。白藜芦醇对革兰氏阳性菌的抗菌活性大于对革兰氏阴性菌的抗菌活性[14]。本研究中,我们发现白藜芦醇可显著增强金黄色葡萄球菌生物被膜的形成,并且随着药物浓度的增加,生物被膜形成能力增强。进一步研究发现,白藜芦醇通过增加eDNA 释放来诱导生物被膜的形成。Whitchurch等[17]首次在铜绿假单胞菌中研究了eDNA 在生物被膜形成中的作用。eDNA 在细菌生物被膜的形成、粘附和稳定性中起着关键作用[18]。金黄色葡萄球菌eDNA 形成过程中涉及的调控网络十分复杂,金黄色葡萄球菌穿孔素CidA、抗穿孔素LrgAB、自溶酶Yycl 等参与eDNA 的释放,双组分系统(Agr、SaeRS、WalKR、SrrAB)和全局调节因子(SigB、SarA、MgrA)也直接和/或间接调节eDNA 的释放[16]。金黄色葡萄球菌SaePQRS 调控系统由组氨酸激酶SaeS、应答调节因子SaeR、膜蛋白SaeP 和脂蛋白SaeQ 组成[19]。SaeRS 调控溶血素、白细胞杀伤素、蛋白酶、核酸酶和纤连蛋白结合蛋白等多种毒力因子的表达。金黄色葡萄球菌eDNA 可由耐热核酸酶降解,编码耐热核酸酶的基因nuc突变后,金黄色葡萄球菌生物被膜形成能力增强[20]。nuc基因的表达受SaePQRS 调控系统的调控,在SaeRS 敲除菌株中,nuc基因的表达水平明显下降。EMSA 实验证明。SaeR 能直接与nuc启动子区域结合,从而正调控nuc的表达[21]。研究显示,亚抑菌浓度白藜芦醇作用下,金黄色葡萄球菌lrgA、saeR表达显著下调,且saeR基因在不同亚抑菌浓度白藜芦醇作用下受到抑制,并且随着药物浓度的增加,抑制能力增强[13]。细胞裂解和DNA 释放在生物被膜发育的初始阶段对生物被膜附着至关重要,并且eDNA在生物被膜成熟过程中仍然是重要的基质成分。金黄色葡萄球菌抗穿孔素lrgAB操纵子由2个共转录的基因lrgA和lrgB组成。LrgA可以抑制细菌水解酶,减少eDNA 的释放,从而抑制生物被膜的形成。LrgAB基因突变可增加的生物被膜粘附性和基质相关的eDNA[22]。本研究显示,在亚抑菌浓度白藜芦醇作用下,saeR、saeS以及lrgA基因表达显著下调,与文献研究一致。同时,受SaeRS 调控的nuc基因表达也显著性下调,而这些结果提示,白藜芦醇可能通过下调SaeRS 进而导致nuc的低表达,同时lrgA的低表达导致细胞裂解和eDNA释放加速,进一步增强生物被膜的形成。
总之,本研究表明,白藜芦醇可能通过抑制二元调控系统SaeRS 降低耐热核酸酶的表达以及降低LrgA 的水平,从而增加eDNA的释放,强烈促进金黄色葡萄球菌生物被膜的产生。这提示白藜芦醇应用于临床,可能会促进金黄色葡萄球菌慢性持续性感染的风险。
利益冲突所有作者均声明不存在利益冲突

