重组人血管内皮抑制素联合放化疗对Ⅱb~IV期宫颈癌患者免疫功能及血清S100A4、KLK5水平的影响
吴燕
(南阳市第二人民医院妇科,河南 南阳 473000)
宫颈癌(Cervical carcinoma,CC)为临床常见疾病,发病率高,仅次于卵巢癌、宫内膜癌,其病死率常年居妇科恶性肿瘤首位,早期症状不明显,确诊时多已处于中晚期,错失手术最佳治疗时机[1-3]。临床针对CC患者主要采用紫杉醇(Paclitaxel,PTX)联合顺铂(Cisplatin,DDP)的TP方案及调强放疗(Intensity-modulated radiation therapy,IMRT)进行治疗,可有效缓解病情,但对部分患者效果欠佳,且毒副反应较多[4]。重组人血管内皮抑制素(Endostatin,ES)注射液可阻断内皮细胞迁移、增值,同时能发挥抗血管生成、抑制肿瘤细胞生长作用[5,6]。但在TP方案化疗及IMRT治疗Ⅱb~IV期CC患者基础上,联合应用ES注射液能否进一步提升疗效,临床报道甚少。基于此,本研究探讨了TP方案化疗及IMRT联合ES注射液治疗CC的应用价值。
1 临床资料与方法
1.1 一般资料
本研究经医院伦理委员会批准,患者自愿参与本研究并签署知情同意书。选取2020年4月至2021年4月我院收治的98例Ⅱb~IV期CC患者作为研究对象,根据不同治疗方案分为观察组和对照组,各49例。其中对照组年龄36~76岁,平均年龄55.23±6.88岁;体质量指数18.6~27.3 kg·m-2,平均体质量指数23.01±1.41 kg·m-2;肿瘤直径4~9 cm,平均6.22±0.71 cm;国际妇产科医师联合会(Federation International of Gynecology and Obstetrics,FIGO)分期:Ⅱb期9例,Ⅲa期15例,Ⅲb期17例,IV期8例;病理类别:鳞癌40例,腺癌9例。观察组年龄34~78岁,平均年龄57.15±6.84岁;体质量指数18.2~27.7 kg·m-2,平均体质量指数22.75±1.36 kg·m-2;肿瘤直径4~8 cm,平均6.09±0.69 cm;FIGO分期:Ⅱb期7例,Ⅲa期18例,Ⅲb期16例,IV期8例;病理类别:鳞癌35例,腺癌14例。两组患者基线资料差异无统计学意义(P>0.05),具有可比性。纳入标准:符合CC诊断标准[7];FIGO分期Ⅱb~IV期;临床资料完整。排除标准:伴精神疾病者;合并其他恶性肿瘤者;凝血功能异常者;严重器质性病症者;伴自身免疫性病症者;过敏体质者。
1.2 方法
对照组采取TP方案化疗及IMRT治疗。化疗方案:第1 d静滴PTX注射液(规格:5 mL:30 mg,海南全星制药有限公司,国药准字:H20084032)135~175 mg·m-2,第1~3 d静滴DDP注射液(规格:50 mL:50 mg,齐鲁制药有限公司,国药准字:H20213819)40 mg·m-2;化疗开始之日即进行放疗,3w为1个化疗周期。放疗方案:仰卧位,IMRT治疗仪(美国,X-RAD 225 Cx,Precision X-ray)扫描厚度设置为5 mm,范围自坐骨结节下缘5 cm至第10胸椎位置;明确临床靶区,上界:L4~L5间;下界:闭孔下方;计划靶区:外扩临床靶区5~10 mm;处方剂量:临床靶区(CTV)50 Gy,2 Gy·次-1,共25次,每周5次。
观察组在对照组基础上,在第1~14 d增加静滴ES注射液(规格:3 mL: 15 mg(2.4×105U),山东先声生物制药有限公司,国药准字:S20050088)15 mg·次-1,Qd。
两组持续治疗3疗程。
1.3 观察指标
1.3.1 总有效率
完全缓解:病灶消失,持续时间>4 w:部分缓解:肿瘤最大直径缩小≥50%,持续时间>4 w;疾病稳定:介于部分缓解与进展之间;疾病进展:肿瘤最大直径增加≥25%,或出现新病灶;将完全缓解、部分缓解、疾病进展计入总有效率。
1.3.2 功能状态
功能状态以卡氏(Karnofsky,KPS)评分评估[8],KPS评分增加(较治疗前)≥10分为改善;KPS评分减少(较治疗前)<10分为降低;稳定:分值介于降低与改善之间。
1.3.3 血清指标
取患者静脉血4 mL,室温凝固,3000 rpm离心10 min后分离血清,以酶联免疫吸附法测定血清血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、基质金属蛋白酶-9(Matrix MetalloProteinase-9,MMP-9)、钙离子结合蛋白A4(Recombinant S100 Calcium Binding ProteinA4,S100A4)、激肽释放酶相关肽酶5(Recombinant Kallikrein 5,KLK5)水平。
1.3.4 免疫功能水平
取患者静脉血4 mL,采用枸橼酸钠抗凝,以流式细胞仪(贝克曼库尔特,CytoFLEX)测定CD3+、CD4+、CD8+百分数,并计算CD4+/CD8+。
1.3.5 毒副反应发生率
观察并记录患者治疗期间发生的毒副反应,包括:骨髓抑制、胃肠反应、放射性食管炎、放射性膀胱炎,并计算毒副反应发生率。
1.4 统计学分析
所有数据使用SPSS22.0软件进行统计学分析。计量资料以均数±标准差(±SD)表示,采用t检验;计数资料以例数(%)表示,采用χ2检验,等级资料采用秩和检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 两组近期疗效比较
观察组治疗总有效率明显较对照组高(P<0.05)。见表1。

表1 两组近期疗效比较(例(%),n=49)
2.2 两组功能状态变化情况
治疗3个疗程后,观察组功能状态改善人数多于对照组,功能状态降低人数少于对照组(P<0.05)。见表2。

表2 两组功能状态变化情况(例(%),n=49)
2.3 治疗前后两组血清VEGF、MMP-9、S100A4、KLK5水平比较
治疗前,两组血清VEGF、MMP-9、S100A4、KLK5水平无明显差异(P>0.05);治疗3个疗程后,两组血清VEGF、MMP-9、S100A4、KLK5水平明显低于治疗前,且观察组明显低于对照组(P<0.05)。见表3。
表3 治疗前后两组血清VEGF、MMP-9、S100A4、KLK5水平比较(±SD,n=49)
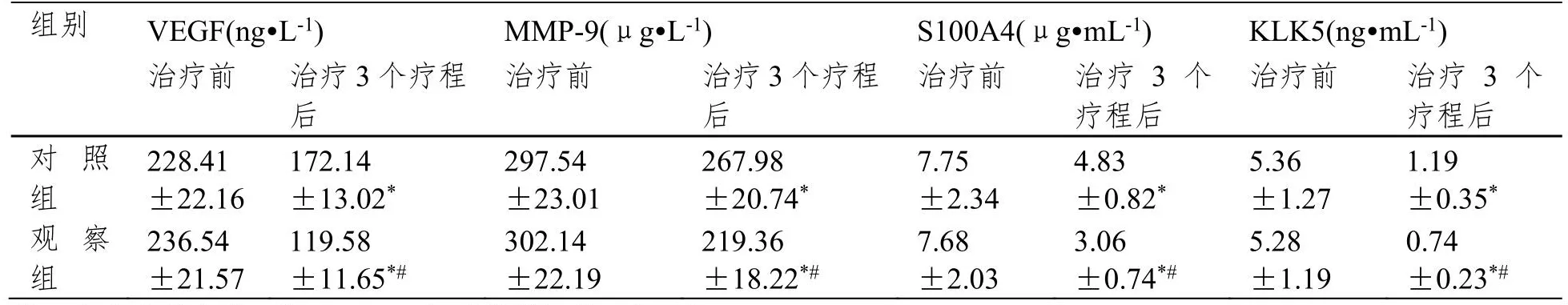
表3 治疗前后两组血清VEGF、MMP-9、S100A4、KLK5水平比较(±SD,n=49)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
组别 VEGF(ng·L-1) MMP-9(μg·L-1) S100A4(μg·mL-1) KLK5(ng·mL-1)治疗前 治疗3个疗程后治疗前 治疗3个疗程后治疗前 治疗3个疗程后治疗前 治疗3个疗程后对照组228.41±22.16 172.14±13.02*297.54±23.01 267.98±20.74*7.75±2.34 4.83±0.82*5.36±1.27 1.19±0.35*观察组236.54±21.57 119.58±11.65*#302.14±22.19 219.36±18.22*#7.68±2.03 3.06±0.74*#5.28±1.19 0.74±0.23*#
2.4 治疗前后两组免疫功能比较
治疗前两组CD3+、CD4+、CD8+、CD4+/CD8+无明显差异(P>0.05);治疗3疗程,两组CD3+、CD4+、CD4+/CD8+较治疗前明显降低,CD8+较治疗前显著升高,且观察组CD3+、CD4+、CD4+/CD8+明显低于对照组低(P<0.05),观察组CD8+明显高于对照组(P<0.05)。见表4。
表4 治疗前后两组免疫功能比较(±SD,n=49)
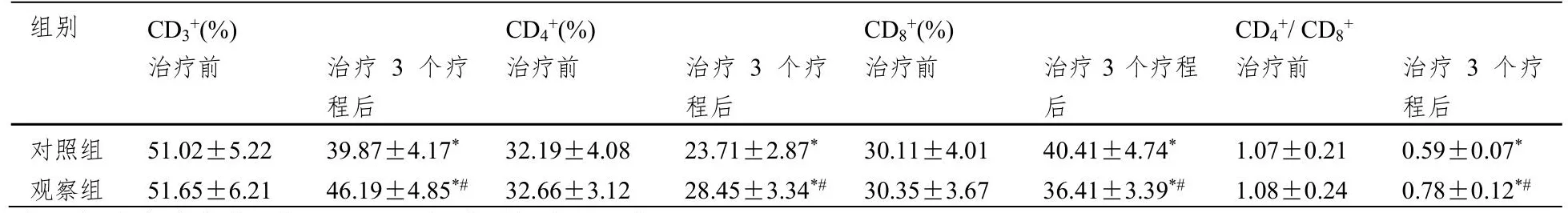
表4 治疗前后两组免疫功能比较(±SD,n=49)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05。
组别 CD3+(%) CD4+(%) CD8+(%) CD4+/ CD8+治疗前 治疗3个疗程后治疗前 治疗3个疗程后治疗前 治疗3个疗程后治疗前 治疗3个疗程后对照组 51.02±5.22 39.87±4.17* 32.19±4.08 23.71±2.87* 30.11±4.01 40.41±4.74* 1.07±0.21 0.59±0.07*观察组 51.65±6.21 46.19±4.85*# 32.66±3.12 28.45±3.34*# 30.35±3.67 36.41±3.39*# 1.08±0.24 0.78±0.12*#
2.5 两组毒副反应发比较
观察组骨髓抑制发生率24.49%(12/49)、胃肠反应发生率28.57%(14/49)、放射性食管炎发生率18.37%(9/49)、放射性膀胱炎发生率6.12%(3/49)。对照组骨髓抑制发生率44.90%(22/49)、胃肠反应发生率48.98%(24/49)、放射性食管炎发生率38.78%(19/49)、放射性膀胱炎发生率22.45%(11/49)。观察组各毒副反应发生率均明显低于对照组(P<0.05)。
3 讨论
相关研究指出,CC发病率在我国呈逐年递增趋势,且趋于年轻化,对患者生命安全造成极大负面影响[9,10]。TP方案化疗及IMRT是临床治疗Ⅱb~IV期CC患者的常用治疗方案,TP方案对常规细胞具有保护、识别作用,能有效抑制肿瘤细胞生长,破坏细胞膜结构,从而促使肿瘤细胞凋亡,但易引发骨髓抑制、胃肠反应等毒副反应,影响预后[11];而IMRT为治疗CC患者新技术,可通过照射并控制靶区剂量,降低正常组织接受剂量,保证患者接受精确治疗[12]。ES注射液属抗血管生成药物,可通过调整血管因子抑制内皮细胞转移,防止肿瘤新血管再生[13,14]。
本研究数据显示,治疗3个疗程后观察组治疗总有效率高于对照组,功能状态优于对照组,各项毒副反应发生率均较对照组低,可见,ES注射液辅助治疗Ⅱb~IV期CC患者可进一步提升疗效,提高功能状态,减少毒副反应发生。原因分析在于,ES注射液具有作用广泛、靶向明确等特点,可抑制新生血管生成,同时可对肿瘤细胞生长产生抑制效果,阻断肿瘤细胞生长所需养分,从而缩小肿瘤体积达到治疗目的,此外,对机体正常细胞无损害,从而可有效减少抗药性事件发生。研究指出,机体免疫功能抑制可对肿瘤复发、转移产生一定程度影响,而化疗时亦会损害机体免疫功能,CD3+、CD4+、CD8+于抗肿瘤免疫反应中起着主导作用,检测其水平可反映机体免疫功能状态[15]。本研究结果显示,观察组CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组,可见,ES注射液辅助治疗Ⅱb~IV期CC患者可有效降低对机体免疫功能的影响。
另外,血管生成贯穿恶性肿瘤发生、发展全过程。肿瘤血管生成是由肿瘤细胞或基质细胞分泌的血管生成因子所诱导,其中VEGF属血管生成刺激因子,可在肿瘤局部作用于内皮细胞,对新生血管结构形成产生促进效果[16];血清S100A4为钙离子结合蛋白,可参与肿瘤细胞迁移、分化,可通过结合非骨骼肌肌球蛋白重链的蛋白激酶C磷酸化,增强肿瘤细胞活性;血清KLK5为激肽释放酶中的一种,具有糜蛋白酶样、胰蛋白酶的底物特异性,可通过细胞分泌后水解细胞外分子,从而降解、激活相关蛋白,其水平可参与肿瘤细胞发生、发展;本研究数据中,应用ES注射液治疗的CC患者上述血清因子水平下降幅度更高,表现出其在改善患者病情方面也具有一定优势。笔者认为这可能在于,ES注射液可调控结构异常肿瘤血管,使之正常化,使免疫抑制性肿瘤微环境转化为免疫支持性,还可通过抑制血管的内皮细胞形成破坏血管,从而发挥抗肿瘤效果,进而改善机体免疫功能,提高免疫细胞对肿瘤的杀灭作用。
综上,ES注射液辅助治疗Ⅱb~IV期CC患者可进一步提升疗效,提高功能状态,减少毒副反应,降低对机体免疫功能的影响。

