一种经济的乳兔骨髓来源的肥大细胞诱导培养及鉴定
王禹雪,张华莉,陈理军,陆永萍
(云南大学附属医院超声科,云南 昆明 650021)
九十年代初期的研究表明,在动脉粥样硬化(atherosclerosis,AS)形成过程中,动脉内膜和外膜层聚集着肥大细胞(mast cells,MCs),首次提出MCs 参与AS 进程[1]。
血管的微环境一旦发生变化,炎性细胞便会从血管外膜的滋养血管中渗出,参与疾病的变化[2-3]。MCs 激活时释放出来的趋化因子、细胞因子、组胺、白三烯等炎症因子[4]使血管的通透性增加,导致单核巨噬细胞和淋巴细胞聚集到斑块处[5],释放出大量的中性蛋白酶,可以加速低密度脂蛋白(low-density lipoprotein,LDL)进入到血管内膜局部并聚集[6],促进AS 斑块形成。
在骨髓细胞向MCs 分化及活化过程中白细胞介素3(interleukin-3,IL-3)和干细胞因子(stem cell factor,SCF)起到重要作用[7-8]。本研究旨在通过提取乳兔骨髓细胞,利用IL-3、SCF、β-巯基乙醇联合作用诱导培养骨髓来源肥大细胞并鉴定其纯度与活性,为进一步研究肥大细胞与AS 的关系提供依据。
1 材料与方法
1.1 材料
IL-3、SCF(美 国Peprotech 公 司);FBS、DMEM、DMEM/F12、RPMI-1640(美 国Gibco 公司);实验动物:2 周龄乳兔,昆明医科大学实验动物学部,环境条件符合国家实验动物环境及设施标准要求,室内保持安静、清洁、干燥和通风。自由饮水。实验动物使用许可证号:SCXK(滇)2015-0002。
1.2 方法
1.2.1 兔骨髓细胞的获取麻醉:(经2 周龄乳兔耳缘静脉注射3%戊巴比妥钠,1 mL/kg)→浸泡(75%C2H5OH,10 min)→剥离(后肢皮肤切开,逐层分离,剥离肌肉)→暴露股骨→取出→浸泡(75% C2H5OH 的无菌培养皿中浸泡3~5 min)→股骨两端剪去→吹打骨髓(吸取DMEM 高糖培养基后吹打骨髓,股骨变白)→获取细胞(1 000 r/min,5 min。如果在获取的细胞中有较多红细胞,则应用红细胞裂解液进行处理)→培养体系(含84 mL DMEM 高糖培养基、15 mL FBS、1 mL 双抗)。
1.2.2 细胞的培养接种到T25 瓶中(含DMEM高糖培养基)→隔天换液→细胞铺满→消化细胞→新培养瓶→贴壁→改用F12 诱导培养基(含84 mL DMEM/F12、15 mL FBS、1 mL 双抗、10 ng/mL SCF、10 ng/mL IL-3 及0、10×10-5mol/L 的β-巯基乙醇)→放置37 ℃、5% CO2饱和湿度环境→隔天换液→镜下观察细胞有变圆→更换为1640 促成熟培养基(含84 mL RPMI 1640、15 mFBS、1 mL双抗、10 ng/mL SCF、10 ng/mL IL-3 及0、10×10-5mol/L 的β-巯基乙醇)→7 d 换液→直至细胞诱导成熟。
1.2.3 肥大细胞功能学鉴定诱导成熟的重悬细胞液→载玻片→干燥→甲苯胺蓝染色→95%C2H5OH 脱色→清洗→镜下观察。
1.2.4 肥大细胞形态学鉴定通过光镜下观察不同培养时间的细胞形态,直至诱导成熟。
消化细胞→洗2 次(PBS)→细胞密度1×107个/mL→每管100 µL→单染管各加入5.0 µL 的 CD117-PE 抗体及FcεR1α-FITC 抗体→双染管加两种抗体→空白对照管(无抗体)→避光孵育30 min→每管加1 mL PBS→离心10 min(400 g)→去上清→上法洗涤1 次→去上清→每管加100 µL PBS→检测。
2 结果
2.1 光镜下观察肥大细胞生长形态
2 d 后开始出现以形态为长梭形的贴壁细胞;7 d 时:细胞基本将培养瓶铺满;2 周时:细胞逐渐变形;4 周时:细胞基本变为圆形,悬浮细胞变多;6 周时:细胞基本变为类圆形,且形态均匀具有折光性(图1)。

图1 肥大细胞变形过程(100×)Fig.1 Changes in mast cells(100×)
2.2 肥大细胞的甲苯胺蓝染色
培养6 周细胞成熟后利用甲苯胺蓝染色:可以观察到细胞质为紫红色,细胞核为蓝色。异染颗粒的细胞加入β-巯基乙醇比不加入β-巯基乙醇的能得到更多(图2)。
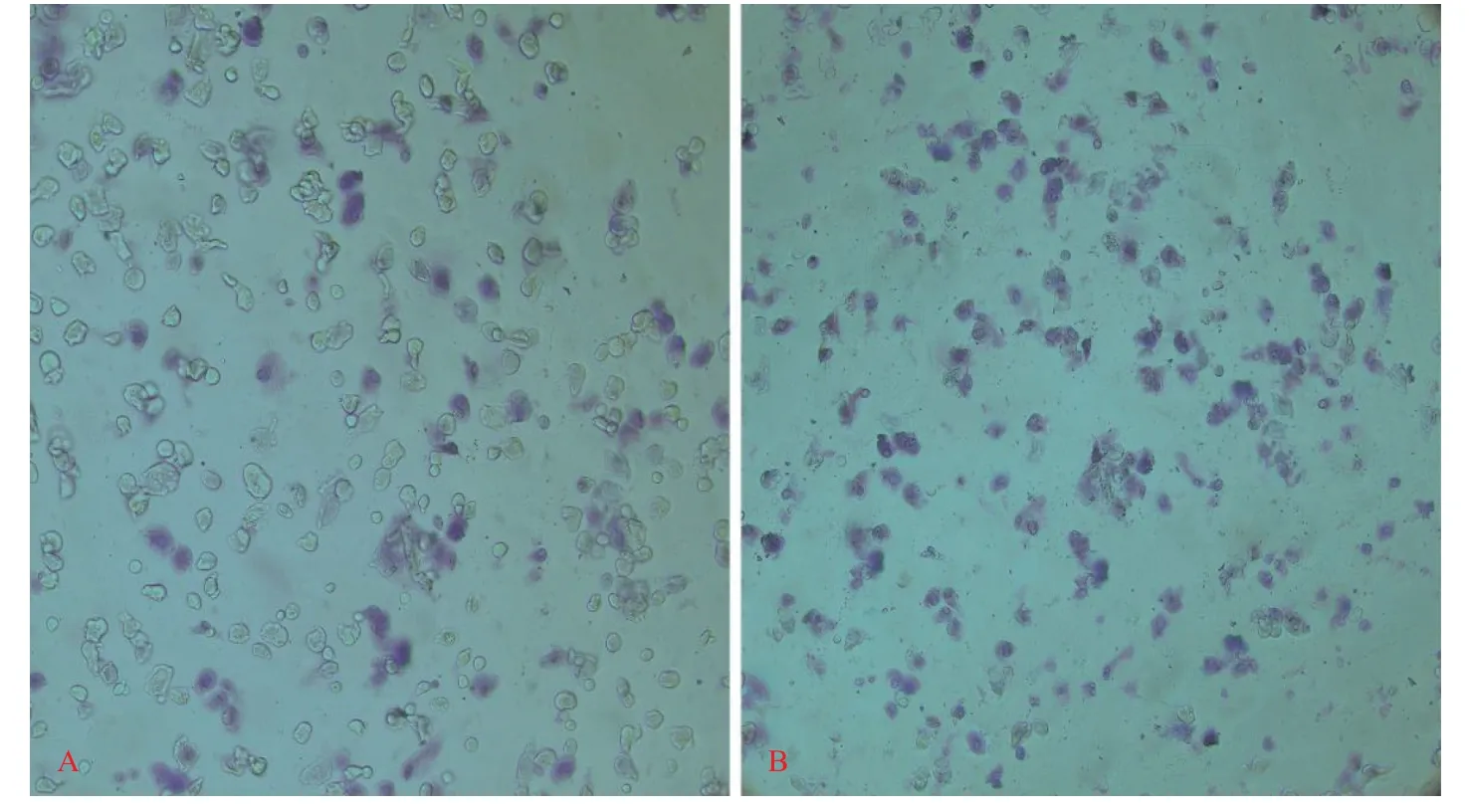
图2 甲苯胺蓝染色(100×)Fig.2 Toluene blue staining(100×)
2.3 流式细胞术检测肥大细胞
培养6 周收集细胞,利用流式细胞术检测细胞表面CD117 及FcεR1α 的表达情况,加入β-巯基乙醇双阳性细胞的比例达96.2%,大于不加入β-巯基乙醇的(图3),且与不加β-巯基乙醇相比有统计学意义(P< 0.05),见表1。

表1 不同浓度β-巯基乙醇诱导后CD117+FcεRIα+肥大细胞的比例Tab.1 The proportion of CD117+FcεRIα+mast cells induced by different concentrations of βmercaptoethanol
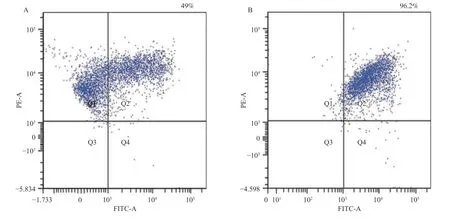
图3 流式细胞仪检测细胞的双阳性率Fig.3 Double positive rate of cells detected by flow cytometry
3 讨论
在正常人的心脏、主动脉及脂肪组织中有少量的MCs 存在,当人类发生疾病时MCs 的数量就会增多,比如AS。近年来,研究表明MCs 在AS的发生、发展及斑块稳定性中有着重要作用[9]。
当下有研究认为MCs 是利用其表面的趋化因子受体-3 与AS 斑块中表达的嗜酸细胞活化CC趋化因子亚族中趋化因子配体-11 结合而向病变部位聚集[10]。MCs 起源于骨髓造血干细胞[11],促进MCs 成熟的分子主要有SCF 和神经生长因子(nerve growthfactor,NGF)[17],SCF 可能在MCs 向受累区域聚集发挥作用,而MCs 侵入受累区域可能会进一步导致更多的炎性细胞浸润,促进AS斑块形成。
IL-3 又被叫做肥大细胞生长因子,在MCs 的生长、分化、迁移和效应中具有重要作用。活化T 细胞、天然杀伤(NK)细胞和MCs 都可产生IL-3,且对于SCF 在MCs 前体的发生、发展、扩增具有促进意义[12-13]。SCF 的配体CD117(c-kit)除在其表面外,各种造血祖细胞中均可存在。MCs发挥重要表面标志的是FcεRIα,但FcεRIα还表达于嗜酸性粒细胞等细胞表面,只有MCs 同时表达CD117 和FcεRIα[14]。甲苯胺蓝染色是一种常用于识别及判断MCs 功能状态的方法,同时也是MCs 的特异性染色,可染细胞核为蓝色,胞质内为异染性紫红色颗粒,说明其具有吞噬功能[15]。通过甲苯胺蓝染色和流式细胞仪检测结果对诱导获得的MCs 的纯度进行鉴定,就目前来说,利用兔的骨髓间质干细胞来诱导培养MCs 的报道是极少的。
本研究选用2 周龄的乳兔来获取骨髓间质干细胞,因为当兔龄大于或者小于2 周龄时,笔者发现细胞生长速度变得缓慢,可能是2 周龄的骨髓间质干细胞的活性更好,更有利于细胞的培养。当IL-3 浓度10 ng/mL、SCF 浓度为10 ng/mL,加入β-巯基乙醇时:甲苯胺蓝染色及流式检测均较不加入β-巯基乙醇时可以获取更多、双阳性率更高的MSc,原因可能为β-巯基乙醇作为一种还原剂,在降低氧对细胞产生氧化损伤的同时促进干细胞生长。所以该培养体系是一种良好的体外诱导培养体系,其操作简单,且能获得更加成熟、更具有典型特征的MCs,为下一步对兔行进炎性损伤研究提供了优势。综上所述,本研究利用形态学、功能学2 个方面对诱导的兔骨髓来源MCs 进行鉴定,培养出的细胞不仅具有成熟MCs 的生物学特性,还具有其功能,这便为后续的基础研究及临床研究奠定基础。

