微小RNA-105-5p靶向白细胞介素6受体调控卵巢癌细胞增殖和转移临床研究
刘丽霞,王 钊
(大连市中医医院妇科, 辽宁 大连 116001)
卵巢癌是女性常见的致死性恶性肿瘤,由于疾病早期诊断困难,大多数患者被诊断为晚期,甚至发生腹膜或远端器官转移,给疾病治疗带来巨大困难[1-3]。近年来分子靶向治疗和基因治疗已成为肿瘤治疗的新趋势,研究卵巢癌发生、转移的分子机制有助于开发新的卵巢癌治疗靶点。微小RNA(microRNA,miRNA)是重要的非编码RNA,其通过在转录后或翻译水平负调控基因表达参与许多细胞过程的调控。miRNA表达失调与肿瘤细胞的异常增殖以及恶性侵袭等生物学行为有关,是癌症进展的促进或抑制因子[4-5]。微小RNA-105-5p(microRNA-105-5p,miR-105-5p)在肝癌干细胞中表达降低,可促进肝癌干细胞生长[6]。早期研究指出卵巢癌中miR-105-5p表达下调[7],但miR-105-5p是否参与卵巢癌细胞增殖和转移仍然未知。白细胞介素6(Interleukin 6,IL-6)是卵巢癌免疫微环境中存在的免疫调节细胞因子[8]。IL-6R在卵巢癌组织、细胞中表达增加,下调IL-6R表达显著降低卵巢癌细胞体外增殖、侵袭能力以及体内致瘤性[9]。本研究通过生物信息学发现IL-6R是miR-105-5p潜在靶点,于是推测miR-105-5p可能靶向调控IL-6R参与卵巢癌进展。本研究重点分析了miR-105-5p和IL-6R在卵巢癌组织中表达水平,揭示了miR-105-5p和IL-6R表达对卵巢癌细胞增殖、迁移和侵袭的影响,阐明了miR-105-5p对IL-6R的靶向调控作用,现报告如下。
1 材料与方法
1.1 组织来源 选取2017—2018年在我院确诊进行手术治疗的30例卵巢癌组织和对应的癌旁组织标本。癌旁组织为距离肿瘤边缘大于2 cm处正常卵巢组织。所有组织样本切除后立即置于液氮中,后保存于-80 ℃冰箱中。病例纳入标准:术后病理诊断确诊为卵巢癌。排除标准:术前接受抗肿瘤治疗。研究开展之前已获得我院伦理委员会批准,且所有患者或其家属均知情同意。
1.2 细胞和试剂 SKOV-3购于中科院上海细胞库;miRNA逆转录试剂盒、miRNA分析试剂盒购于美国ABI公司;逆转录酶、SYBR Green Master mix购于日本takara公司;荧光素酶报告载体、miR-576-3p模拟物(mimics)及其阴性对照(miR-NC mimics)、IL-6R小干扰RNA(si-IL-6R)及其阴性对照(si-NC)、IL-6R过表达载体(pcDNA-IL-6R)及其阴性对照(pcDNA-NC)购于广州复能基因公司;细胞计数试剂盒(CCK-8)购于北京索莱宝公司;Transwell和Transwell小室购于北京优尼康公司;羊抗兔IgG二抗以及兔抗人、IL-6R、磷酸甘油醛脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、增殖标记蛋白细胞增殖核抗原-67(Antigen identified by monoclonal antibody,Ki-67)、基质金属蛋白酶-2(Matrix metalloproteinases-2,MMP-2)、基质金属蛋白酶-9(Matrix metalloproteinases-9,MMP-9)单克隆抗体购于上海艾博抗公司。
1.3 实时定量PCR(RT-qPCR)检测miR-105-5p和IL-6R表达 TRIzol试剂提取卵巢癌组织中总RNA,纯化后利用miRNA逆转录试剂盒、miRNA分析试剂盒检测miR-105-5p表达。利用逆转录酶、SYBR Green Master Mix检测IL-6R mRNA表达水平。miR-105-5p上游引物5’-UCAAAUGCUCAGACUCCUGUGGU-3’,下游引物5’-CATCCTCGATGGTCTCCTGC-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’;IL-6R上游引物5’-TCACTGTGTCATCCACGAC G-3’,下游引物5’-AGCCAGCTATCTGGGGAAGA-3’;GAPDH上游引物5’-GACCTGACCTG CCGTCTA-3’,下游引物5’-GGAGTGGGTGTCGCTGT-3’。
1.4 细胞培养、实验分组和细胞活力检测 用含1%青霉素/链霉素、10%胎牛血清的RPMI-1640培养基培养SKOV-3细胞。将对数期SKOV-3细胞接种6孔板,利用Lipofectamine 2000将miR-NC mimics、miR-105-5p mimics、si-NC、si-IL-6R、miR-576-3p mimics与pcDNA-NC、miR-576-3p mimics与pcDNA-IL-6R分别转染融合率为50%的SKOV-3细胞,分别标记为miR-NC mimics组、miR-105-5p mimics组、si-NC组、si-IL-6R组、miR-576-3p mimics+pcDNA-NC组、miR-576-3p mimics+pcDNA-IL-6R组,转染48 h采用RT-qPCR和蛋白质印迹法(WB)检测转染效果,合格后进行后续实验。将转染细胞按照3×104个/ml、0.1 ml/孔转移至96孔板,培养箱孵育48 h时添加按10 μl/孔添加CCK-8溶液。再孵育2 h后,酶标仪测量450 nm的各孔光密度(OD)值。
1.5 Transwell实验检测细胞迁移和侵袭 使用无血清细胞培养基将各组细胞制成3×104个/ml的细胞悬液。取200 μl细胞悬浮液加至预先涂有(侵袭)或未涂(迁移)基质胶Transwell上腔室中,同时将下腔室中加入500 μl含10%血清的细胞培养基。培养箱孵育24 h后,除去膜上未穿膜细胞,甲醇固定膜下表面细胞后进行结晶紫染色。显微镜下计数5个随机视野细胞数,采用其均值表示细胞迁移或侵袭细胞数。
1.6 蛋白质印迹法(WB)分析IL-6R、Ki-67以及MMP-2和MMP-9蛋白表达 冰上裂解各组细胞并收集上清液,二辛可宁酸法测定蛋白质浓度。聚丙烯酰胺凝胶电泳分离细胞蛋白后转移到硝酸纤维素膜,并在室温下用脱脂牛奶封闭膜2 h,再与1∶1500稀释的抗IL-6R、Ki-67、MMP-2、MMP-9抗体在4 ℃下过夜,最后与二抗孵育2 h。增强型化学发光试剂检测蛋白条带,Image J软件测定各条带灰度值,以目的蛋白和内参灰度值比值表示对应蛋白相对表达量。
1.7 双荧光素酶报告基因实验 生物信息学软件在线分析显示miR-105-5p和IL-6R-3’-UTR存在互补序列。将含有miR-105-5p结合位点的IL-6R-3’UTR序列插入pGL3载体下游构建野生型荧光素酶报告载体WT-IL-6R-3’UTR。通过突变miR-105-5p的预测结合位点,构建野生型荧光素酶报告载体MUT-IL-6R-3’UTR。脂质体转染法将WT-IL-6R-3’UTR或MUT-IL-6R-3’UTR分别与miR-105-5p mimics或miR-NC共转染SKOV-3细胞,双荧光素酶报告基因检测系统检测转染48 h后荧光素酶活性。
2 结 果
2.1 卵巢癌组织中miR-105-5p和IL-6R表达情况 卵巢癌组织中miR-105-5p表达量较癌旁组织显著降低(P<0.05),而IL-6R表达量较癌旁组织显著升高(P<0.05)。见表1。
表1 卵巢癌组织中miR-105-5p和IL-6R表达情况
2.2 miR-105-5p过表达对细胞增殖、迁移和侵袭的影响 miR-105-5p mimics组SKOV-3细胞miR-105-5p表达量较miR-NC mimics组显著升高(P<0.05),而细胞活力、迁移和侵袭细胞数、IL-6R、Ki-67以及MMP-2和MMP-9表达量显著降低,差异有统计学意义(均P<0.05)。见表2。
表2 miR-105-5p过表达对细胞增殖、迁移和侵袭的影响
2.3 miR-105-5p靶向调控IL-6R的表达 生物信息学软件预测miR-105-5p的靶基因发现miR-105-5p与IL-6R-3’UTR之间存在特异性互补序列,见图1。WT-IL-6R-3’UTR和miR-105-5p mimics共转染后SKOV-3细胞相对荧光素酶活性较WT-IL-6R-3’UTR和miR-NC共转染显著降低;而MUT-IL-6R-3’UTR和miR-105-5p mimics共转染后SKOV-3细胞相对荧光素酶活性较MUT-IL-6R-3’UTR和miR-NC共转染无显著变化,见表3。
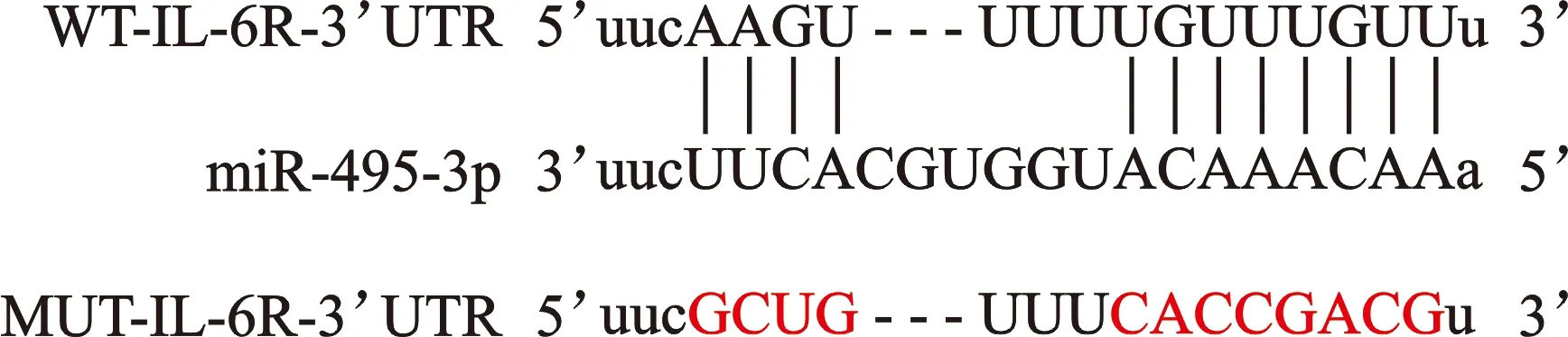
图1 IL-6R的序列中含有与miR-105-5p互补的核苷酸序列
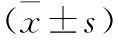
表3 双荧光素酶报告实验
2.4 抑制IL-6R表达对细胞增殖、迁移和侵袭的影响 si-IL-6R组SKOV-3细胞IL-6R表达量、细胞活力、迁移和侵袭细胞数、Ki-67以及MMP-2和MMP-9表达量较si-NC组显著降低,差异有统计学意义(均P<0.05)。见表4。
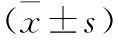
表4 抑制IL-6R表达对细胞增殖、迁移和侵袭的影响
2.5 过表达IL-6R可逆转miR-105-5p过表达对细胞增殖、迁移和侵袭的影响 miR-576-3p mimics+pcDNA-IL-6R组SKOV-3细胞IL-6R表达量、细胞活力、迁移和侵袭细胞数、Ki-67以及MMP-2和MMP-9表达量较miR-576-3p mimics +pcDNA-NC组显著升高,差异有统计学意义(均P<0.05)。见表5。
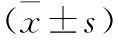
表5 过表达IL-6R可逆转miR-105-5p过表达对细胞增殖、迁移和侵袭的影响
3 讨 论
几十年来,已经鉴定出多种miRNA在卵巢癌发生和进展中起关键作用。例如miR-126-3p低表达参与卵巢癌细胞增殖和侵袭[10]。miR-148a-3p低表达卵巢癌异种移植瘤小鼠体内肿瘤形成[11]。上调控miR-378a-3p表达可提高卵巢癌细胞的顺铂敏感性[12]。本研究检测到卵巢癌组织中miR-105-5p表达量显著降低,这提示miR-105-5p异常低表达可能参与卵巢癌进展。功能分析发现,过表达miR-105-5p可抑制SKOV-3细胞增殖、迁移和侵袭,表明miR-105-5p在卵巢癌中起着抑癌作用。与本研究发现类似,在胶质瘤中过表达miR-105-5p抑制胶质瘤细胞生长、集落形成和迁移,抑制胶质瘤进展,进一步证实miR-105-5p的抑癌作用[13]。为探讨miR-105-5p的抗癌机制,本研究检测细胞增殖相关蛋白以及迁移侵袭相关蛋白表达水平。Ki-67与细胞有丝分裂密切相关,Ki-67水平越高,细胞增殖越活跃,组织分化越差[14]。在肿瘤细胞侵袭转移中MMP家族蛋白具有重要功能,尤其是MMP-2、MMP-9,其可降解细胞外基质中各种组分,其表达增加可增强癌细胞迁移和侵袭能力[15-16]。本研究发现过表达miR-105-5p导致Ki-67、MMP-2、MMP-9蛋白表达增加,这提示过表达miR-105-5p可通过影响增殖、迁移侵袭相关蛋白表达进而降低卵巢癌细胞增殖、迁移和侵袭能力。
IL-6R在人类癌症中表达上调并发挥致癌作用,且IL-6R表达受miRNA调控。研究报道miR-218靶向IL-6R抑制肺癌细胞的增殖、侵袭和肿瘤形成[17]。在费城染色体阳性急性淋巴细胞白血病中miR-451a表达降低,其重新表达通过IL-6R抑制白血病细胞增殖、诱导细胞凋亡[18]。miR-451通过靶向IL-6R-STAT3途径还可抑制肝癌血管生成[19]。此外,有研究指出在卵巢癌中miR-204的顺铂增敏作用亦与靶向负调控IL-6R有关[20]。本研究中发现卵巢癌组织中IL-6R表达显著增加。进一步研究证实IL-6R是miR-105-5p的直接靶点,过表达miR-105-5p显著降低卵巢癌细胞中IL-6R表达水平,提示miR-105-5p可能靶向IL-6R参与卵巢癌进展。通过功能缺失实验分析IL-6R对卵巢癌细胞生物学行为影响显示,干扰IL-6R表达显著降低SKOV-3细胞活力以及迁移侵袭能力,并降低Ki-67以及MMP-2、MMP-9蛋白表达水平,这表明IL-6R在卵巢癌中具有致癌功能。过表达miR-105-5p和干扰IL-6R表达的抗癌作用一致,且过表达IL-6R显著减弱miR-105-5p过表达对SKOV-3细胞增殖、迁移以及相关蛋白表达的影响,恢复SKOV-3细胞的增殖、迁移和侵袭能力,这进一步证实靶向负调控IL-6R是miR-105-5p抑制卵巢癌进展的重要途径。
综上所述,卵巢癌中miR-105-5p表达下调,过表达miR-105-5p通过靶向下调IL-6R可抑制卵巢癌细胞增殖和转移,这丰富了卵巢癌进展的分子机制,为卵巢癌治疗提供了潜在靶点。

