FAR、CAR、LSR、甲胎蛋白水平及微血管侵犯与原发性肝癌患者TACE术后生存时间的关系
马庆霞,顾 澄,严铃铃,张 弛
1.南通市肿瘤医院检验科,江苏南通 226361;2.南通瑞慈医院心胸外科,江苏南通 226010
目前对于肝癌的主要治疗方式是根治术治疗,但大部分肝癌患者的预后并不理想,常会出现复发以及微血管侵犯等情况,严重影响患者预后[1]。甲胎蛋白(AFP)是肝癌诊断和预后的评估指标[2]。纤维蛋白原(Fib)是凝血因子的一种,由肝脏合成,与肿瘤的进展存在密切相关性[3]。清蛋白与多种肿瘤的转移存在关系。有研究发现,纤维蛋白原/清蛋白比值(FAR)是肝癌预后不良的独立危险因素[4]。已有研究证明,C反应蛋白/清蛋白比值(CAR)与多种恶性肿瘤的预后有关[5]。丙氨酸氨基转移酶/天冬氨酸氨基转移酶比值(LSR)主要用于肝功能评估,在肝癌的预后评估中也发挥着重要的作用[6]。因此,本研究对南通市肿瘤医院(以下简称本院)2016年1月至2017年1月收治的93例原发性肝癌患者的临床资料进行分析并对入选患者进行了5年随访,旨在探讨FAR、CAR、LSR、AFP及微血管侵犯与原发性肝癌患者经导管动脉栓塞化疗(TACE)术后生存时间的关系。
1 资料与方法
1.1一般资料 将本院2016年1月至2017年1月收治的93例原发性肝癌患者纳入研究。纳入标准:(1)符合原发性肝癌的临床诊断标准[7];(2)均经术后病理学检查确诊为原发性肝癌;(3)均接受了TACE术治疗;(4)入院前1个月未接受治疗。排除标准:(1)存在感染;(2)术前合并活动性肝炎;(3)临床资料不完整;(4)合并其他恶性肿瘤;(5)已存在远处转移;(6)预期生存时间<6个月;(7)合并严重肝硬化、黄疸以及大量腹水。对患者开展为期5年的随访,包括门诊复查以及电话随访2种形式,生存时间为首次治疗日到最后一次随访或死亡的时间。根据患者的中位生存时间(45.98个月)将患者分为生存时间≤45.98个月组和生存时间>45.98个月组。生存时间≤45.98个月组:男31例、女32例,年龄41~68岁、平均(54.31±5.68)岁;生存时间>45.98个月组:男16例、女14例,年龄41~68岁、平均(53.98±5.25)岁。两组患者一般资料比较差异无统计学意义(P>0.05)。本研究经过本院伦理委员会审核并通过。
1.2方法
1.2.1分组及比较 比较不同生存时间患者(生存时间≤45.98个月组vs.生存时间>45.98个月组)FAR、CAR、LSR、AFP水平、微血管侵犯情况及其他临床病理特征(包括性别、年龄、是否存在肝硬化、是否存在包膜破裂、是否存在肝外转移、肿瘤最大径、分化程度)。
1.2.2FAR、CAR、LSR的获取 纳入研究者均于入院后抽取空腹静脉血5 mL,以3 000 r/min离心10 min,获取上清液用于各项指标的检测。检测试剂盒由南京基蛋生物科技有限公司提供。采用贝克曼库尔特全自动生化分析仪对Fib、AFP、清蛋白、CRP、丙氨酸氨基转移酶、天冬氨酸氨基转移酶进行检测,并计算FAR、CAR、LSR。
1.2.3微血管侵犯情况的判断[7]可在显微镜下发现癌旁肝组织周围静脉小分支,以及在肿瘤包膜中的血管中发现癌细胞巢团。

2 结 果
2.1两组患者FAR、CAR、LSR、AFP、微血管侵犯情况及其他临床病理特征比较 两组患者在性别、年龄、是否存在肝硬化、肿瘤最大径、是否存在包膜破裂等方面比较,差异均无统计学意义(P>0.05)。生存时间≤45.98个月组存在肝外转移、存在微血管侵犯、肿瘤低分化者的比例以及FAR、CAR、LSR、AFP水平均高于生存时间>45.98个月组(P<0.05)。见表1。

表1 两组FAR、CAR、LSR、AFP水平、微血管侵犯情况及其他临床病理特征比较或n(%)]
2.2原发性肝癌患者TACE术后生存时间较短的独立危险因素分析 原发性肝癌患者存在肝外转移、存在微血管侵犯、肿瘤低分化及高FAR、CAR、LSR、AFP水平均是患者TACE术后生存时间较短的独立危险因素(P<0.05),见表2。
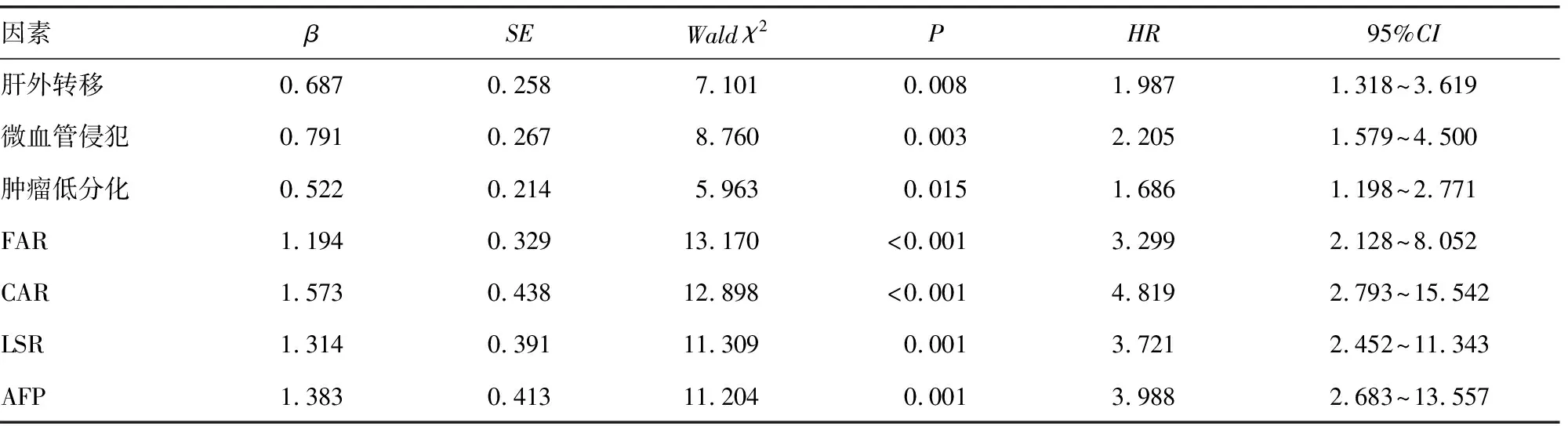
表2 COX比例风险分析影响原发性肝癌患者TACE术后预后生存时间的因素分析
2.3不同FAR、CAR、LSR、AFP水平患者的生存率分析 5年随访期内,93例患者共存活58例,死亡35例。根据患者基线资料计算FAR、CAR、LSR、AFP水平的中位数,并以此作为判断各指标高、低的临界值。高FAR患者(n=33)和低FAR患者(n=60)5年生存率分别为39.39%(13/33)和75.00%(45/60),低FAR患者明显高于高FAR患者(P<0.05),见图1。高CAR患者(n=38)和低CAR患者(n=55)5年生存率分别为36.84%(14/38)和88.00%(44/50),低CAR患者明显高于高CAR患者(P<0.05),见图2。高LSR患者(n=35)和低LSR患者(n=58)5年生存率分别为34.29%(12/35)和79.31%(46/58),低LSR患者明显高于高LSR患者(P<0.05),见图3。高AFP患者(n=36)患者和低AFP患者(n=57)5年生存率分别为36.11%(13/36)和77.95%(45/57),低AFP患者明显高于高AFP患者(P<0.05),见图4。

图1 高、低FAR组患者的生存曲线

图2 高、低CAR组患者的生存曲线
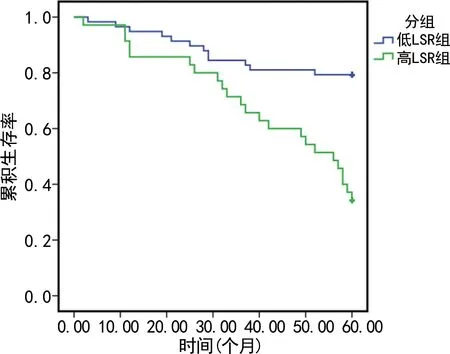
图3 高、低LSR组患者的生存曲线

图4 高、低AFP组患者的生存曲线
3 讨 论肝癌作为全球5大恶性肿瘤之一,目前我国人群中的肝癌发病率较高[8-9]。临床上对于原发性肝癌大多采用根治性切除术治疗,但患者的预后生存情况不一,后续的治疗也存在诸多困难[10-11]。寻找肝癌预后标志物以便更早、更准确地评估患者预后并提前实施针对性的干预对于患者意义重大。因此,本研究探讨了FAR、CAR、LSR、AFP及微血管侵犯与原发性肝癌患者TACE术后生存时间的相关性,旨在为TACE术后肝癌患者的后续治疗提供参考。
Fib作为急性时相反应蛋白,与血液黏滞性、外周阻力以及血栓的形成有关,而肿瘤细胞对凝血的多个环节均会造成影响,并能直接或间接地影响Fib水平。清蛋白是反映机体营养状态的指标,而恶性肿瘤患者机体多处于营养不良状态[12]。因此,FAR可用于原发性肝癌患者预后的评估。本研究结果显示,生存时间较短的患者FAR高于生存时间较长的患者。这提示FAR水平与肝癌患者生存预后有一定关系。徐小尚等[13]研究发现,肝细胞癌预后不良患者FAR明显高于预后良好的患者。本研究还发现,高CAR是肝癌患者TACE术后生存时间较短的独立危险因素,而且低CAR患者生存率明显高于高CAR患者。因此,CAR可用于肝癌患者预后的评估。其原因可能是Fib水平的升高,会促进内皮细胞、血小板以及肿瘤细胞的黏附,从而增强肿瘤细胞的扩散和转移,并且降低自然杀伤细胞对于肿瘤细胞的杀伤作用[14]。
癌症往往伴随着持续的炎症状态,CAR能够反映肿瘤患者的炎症和营养状态[15]。本研究发现,生存时间较短的患者CAR高于预后良好组患者。这提示肝癌TACE术后生存时间较短的患者可能更多地处于炎症和营养不良的状态中。此外,本研究发现,高FAR是导致肝癌患者TACE术后生存时间较短的独立危险因素,而且低FAR患者5年生存率高于高FAR患者。这是因为生存时间较短的患者更多地处于炎症状态中,肿瘤更容易发生侵袭和转移,并且营养状态较差,对肿瘤的抵抗力较弱。
LSR是肝功能的重要评估指标[16]。本研究结果显示,生存时间较短的患者LSR水平高于生存时间较长的患者,而且高LSR是导致肝癌患者TACE术后生存时间较短的独立危险因素。此外,低LSR患者5年生存率高于高LSR患者。可能是因为LSR的改变会对致癌促炎介质造成影响,进而加速肿瘤细胞的增殖,从而影响患者预后。
AFP是在人胎血清中发现的一种糖蛋白,AFP目前是诊断肝癌的最佳指标之一,相关研究发现血清AFP水平越高,肝癌患者生存时间越短,说明其与肝癌患者的预后存在一定的关系[17]。生存时间较短的患者AFP水平高于生存时间较长的患者,而且高AFP是导致肝癌患者TACE术后生存时间的独立危险因素。此外,低AFP患者5年生存率高于高AFP患者,这与张笑时等[18]的研究结果基本一致。
大血管侵犯和微血管新生均是影响肿瘤患者预后的重要因素[19]。本研究发现,微血管侵犯是导致肝癌患者TACE术后生存时间较短的独立危险因素,这与既往研究结果一致[20]。此外,原发性肝癌患者存在肝外转移、肿瘤低分化也是导致患者TACE术后生存时间较短的独立危险因素。这是可能是因为高水平AFP会帮助癌细胞逃避免疫系统,加速肿瘤的发生、血管生成,最终导致患者的预后较差。
综上所述,FAR、CAR、LSR、AFP均是原发性肝癌患者TACE术后生存时间较短的独立危险因素。针对生存预后较差的患者,应尽早制订相应的治疗计划。本次研究纳入标准较为苛刻,失访者也较多,导致样本量较低,将来还会扩大样本量进行深入的研究,以弥补此次研究的不足。

