血清miR-92a-3p、miR-147水平与脓毒症患者病情严重程度、炎症反应的关系及对预后的评估价值*
张艳敏,王倩倩,杨 珍,刘海丽,王晓艳
邯郸市中心医院:1.急诊科;2.神经内科,河北邯郸 056000;3.邯郸市邯山区疾病预防控制中心,河北邯郸 056005
脓毒症是宿主对感染反应失调引起的全身多器官功能障碍性疾病,尽管近年来抗感染治疗的医疗技术取得了长足进步,但脓毒症发病率仍持续上升,病死率一直居高不下[1]。微小核糖核酸(miRNAs)作为一类小型单链非编码调控核糖核酸(RNA),广泛参与细胞增殖、分化、发育、代谢和凋亡等生物过程,越来越多的证据表明,miRNAs具有免疫和炎症反应调控作用,其在脓毒症患者中存在差异性表达,是脓毒症诊断、治疗、预后评估的潜在标志物[2-3]。研究显示,miR-92a-3p可通过激活核因子-κB(NF-κB)及其下游炎症通路促进炎症反应,参与糖尿病患者心血管疾病进展过程[4]。miR-147被证实可通过Toll样受体-4(TLR4)调节巨噬细胞功能和炎症,与冠状动脉粥样硬化和炎症性肠病发病有关[5]。然而,miR-92a-3p、miR-147在脓毒症的报道十分少见,是否与脓毒症炎症反应和预后有关尚不清楚,鉴于此,本研究尝试检测脓毒症患者血清miR-92a-3p、miR-147水平,评估其与脓毒症患者炎症细胞因子水平及住院期间临床结局的关系,以期为脓毒症的临床诊治和预后分析提供参考。
1 资料与方法
1.1一般资料 将2018年3月至2022年6月邯郸市中心医院急诊科收治的157例脓毒症患者纳入研究作为患者组,男97例、女60例,年龄41~63岁、平均(52.77±6.03)岁,体重指数19~26 kg/m2、平均(23.41±2.11)kg/m2,脓毒症病因:感染(97例)、烧伤(23例)、创伤(34例)、其他(3例)。纳入标准:(1)存在微生物学证实的感染,序贯器官衰竭(SOFA)评分较基线上升≥2分,而且符合《第三次国际共识:脓毒症和脓毒性休克新定义》中脓毒症的诊断标准[6];(2)住院时间>24 h。排除标准:(1)血液肿瘤或实体肿瘤;(2)人类免疫缺陷病毒感染或自身免疫性疾病;(3)妊娠期患者。脓毒症休克的诊断标准:出现持续性低血压,充分容量复苏后仍需血管活性药来维持平均动脉压(≥65 mm Hg),血乳酸水平>2 mmol/L[6]。根据是否合并脓毒症休克将患者分为脓毒症休克组(66例)和脓毒症组(91例)。另选择107例同期邯郸市中心医院体检健康且自愿加入本研究者作为对照组,男59例、女48例,年龄40~65岁、平均(52.95±6.71)岁,体重指数20~26 kg/m2、平均(23.15±2.03)kg/m2。患者组和对照组性别、年龄、体重指数比较差异无统计学意义(P>0.05)。纳入研究者或家属对本研究知情同意并签署知情同意书。本研究获得邯郸市中心医院伦理委员会批准。
1.2方法
1.2.1miR-92a-3p、miR-147的检测 受试者入组后当日采集静脉血3 mL,取血液凝固后上层液体离心5 min(2 000 r/min,离心半径10 cm)分离得到待测血清标本,于-80 ℃保存。标本检测时,室温复融,采用Trizol试剂(美国Ambion公司)提取总RNA,取50 ng总RNA,采用High-Capacity cDNA RT试剂盒(赛默飞世尔科技公司)逆转录为cDNA。StepOnePlusTM实时荧光定量PCR系统(赛默飞世尔科技公司)上进行三次重复实时荧光定量PCR(qPCR)检测。反应体系:DNA模板2 μL,上下游引物各1 μL,SYBR Green Real-time PCR Master Mix(日本Toyobo公司)2 μL,RNase-Free dd H2O 21 μL。反应条件:95 ℃ 10 min;95 ℃ 2 s,60 ℃ 30 s,40个循环;最后72 ℃延伸10 min。miR-92a-3p、miR-147和U6的引物均由广州瑞博生物有限公司合成,引物序列如下。miR-92a-3p:正向5′-CGCGTATTGCACTTGTCCC-3′,反向5′-AGTGCAGGGTCCGAGGTATT-3′;miR-147:正向5′-GTGTGCGGAAATGCTT-3′,反向5′-TCAACTGGTGTCGTGG-3′;U6:正向5′-AGAGAAGATTAGCATGGCCCCTG-3′,反向5′-AGTGCAGGGTCCGAGGTATT-3′。使用2-ΔΔCt法计算相对表达水平。
1.2.2血清炎症因子检测 采用ML-dr3518型酶标分析仪(上海酶联生物有限公司)检测受试者入组时的血清白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)水平,采用免疫比浊法检测C反应蛋白(CRP)水平,检测试剂盒购自美国Kamiya Biomedical公司。采用罗氏公司Cobas e411型全自动电化学发光分析仪检测降钙素原(PCT)水平,试剂盒购自上海纪宁生物科技公司。
1.2.3临床结局和资料收集 记录脓毒症患者院内存活情况,并据此将纳入研究的患者分为存活组和死亡组。收集年龄、性别、体重指数、脓毒症病因、是否合并脓毒症休克、机械通气、血管活性药物应用、并发症(急性呼吸窘迫综合征、急性肾损伤、电解质紊乱)、入组时急性生理和慢性健康状态Ⅱ(APACHE Ⅱ)评分、SOFA评分及清蛋白、尿素氮、血肌酐、乳酸、白细胞计数等资料。APACHE Ⅱ评分的计算参考文献[7],总分0~71分。SOFA评分根据患者呼吸系统指标、血液系统指标、胆红素、循环系统指标、神经系统指标、肌酐、尿量最差值计算,总分0~43分[8]。

2 结 果
2.1患者组和对照组血清miR-92a-3p、miR-147水平比较 患者组血清miR-92a-3p水平高于对照组(P<0.05),miR-147水平低于对照组(P<0.05),见表1。

表1 患者组和对照组血清miR-92a-3p、miR-147水平比较
2.2脓毒症组、脓毒性休克组血清miR-92a-3p、miR-147水平、炎症因子水平以及SOFA评分、APACHE Ⅱ评分比较 脓毒症休克组血清miR-92a-3p水平、IL-6、TNF-α、PCT、CRP水平及SOFA评分、APACHE Ⅱ评分均高于脓毒症组(P<0.05),miR-147水平低于脓毒症组(P<0.05),见表2。

表2 脓毒症组、脓毒性休克组血清miR-92a-3p、miR-147、炎症因子水平以及SOFA评分、APACHE Ⅱ评分比较
2.3脓毒症患者血清miR-92a-3p、miR-147水平与炎症因子水平、SOFA评分、APACHE Ⅱ评分的相关性 脓毒症患者血清miR-92a-3p水平与IL-6、TNF-α、PCT、CRP水平及SOFA评分、APACHE Ⅱ评分均呈正相关(P<0.05),miR-147水平与IL-6、TNF-α、PCT、CRP水平及SOFA评分、APACHE Ⅱ评分均呈负相关(P<0.05),见表3。
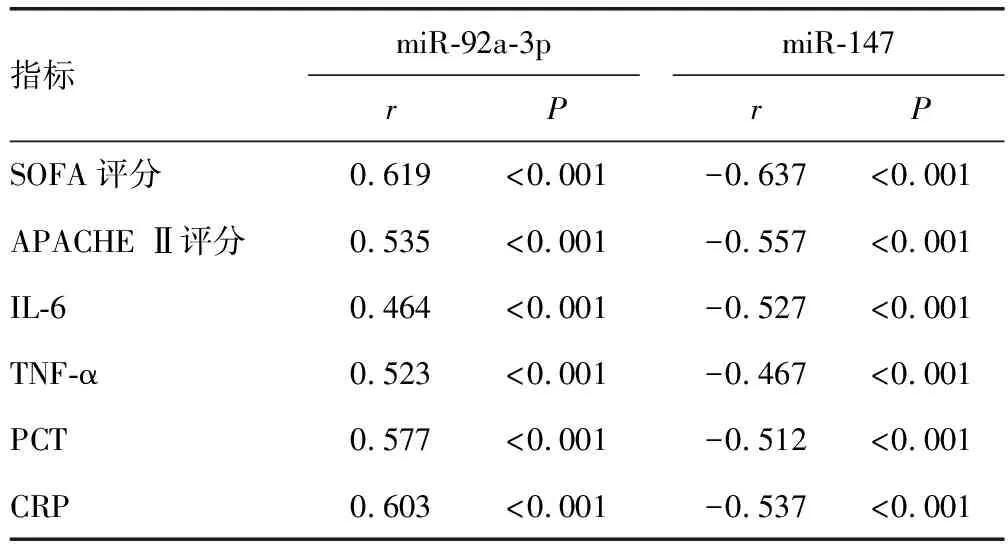
表3 脓毒症患者血清miR-92a-3p、miR-147水平与炎症因子水平、SOFA评分、APACHE Ⅱ评分的相关性分析
2.4影响脓毒症患者预后的单因素分析 脓毒症患者死亡54例,103例存活。死亡组脓毒症休克、血管活性药物应用、电解质紊乱、急性肾损伤比例,APACHE Ⅱ评分、SOFA评分,尿素氮、血肌酐、乳酸、血清miR-92a-3p水平及IL-6、TNF-α、PCT、CRP水平均高于存货组(P<0.05),miR-147水平低于存活组(P<0.05),其他指标比较差异无统计学意义(P>0.05),见表4。
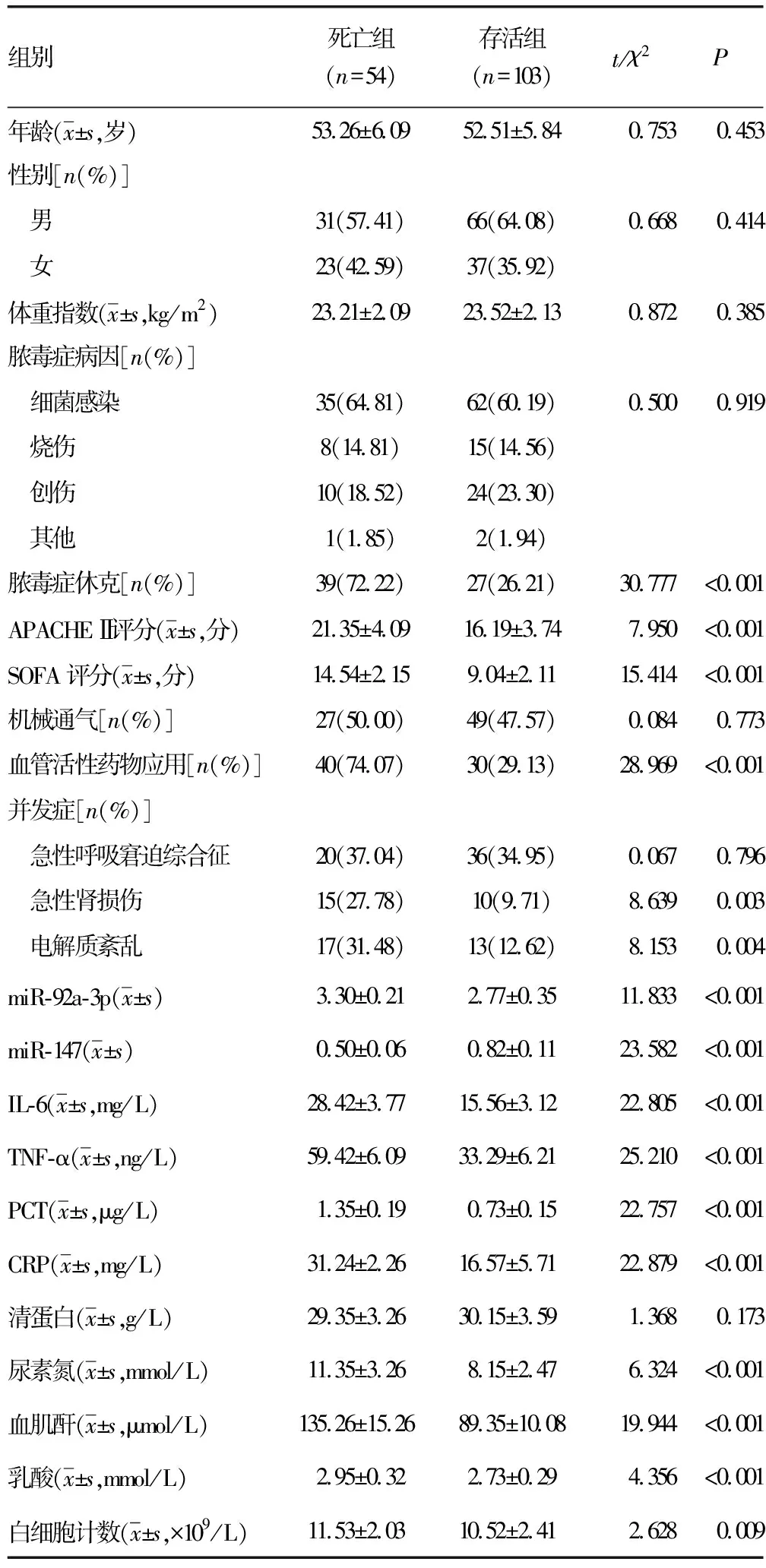
表4 影响脓毒症患者预后的单因素分析
2.5影响脓毒症患者预后的多因素分析 以脓毒症预后(赋值:0=存活,1=死亡)为因变量,以单因素分析中P<0.05的指标为自变量,其中血管活性药物应用是针对患者病情所采取的措施,尿素氮、血肌酐、乳酸、白细胞计数等指标是临床公认的因病情所致发生改变的一些指标,经讨论决定不作为影响因素进行考察。最终纳入脓毒症休克(赋值:0=否,1=是)、电解质紊乱(赋值:0=否,1=是)、急性肾损伤(赋值:0=否,1=是)和APACHE Ⅱ评分、SOFA评分、miR-92a-3p、miR-147、IL-6、TNF-α、PCT、CRP等多个指标作为变量进行分析。回归采用向后逐步法(α入=0.05,α出=0.10)排除无关变量,最终结果显示,脓毒症休克、miR-92a-3p水平升高是脓毒症患者预后不良的危险因素(P<0.05,OR>1),miR-147水平升高是保护因素(P<0.05,OR<1),见表5。

表5 影响脓毒症患者预后的Logistic回归分析结果
2.6血清miR-92a-3p、miR-147水平预测脓毒症患者预后的价值分析 miR-92a-3p、miR-147预测脓毒症患者预后不良的曲线下面积(AUC)为0.711、0.723,结合Logistic回归分析联合miR-92a-3p、miR-147预测脓毒症患者预后不良的AUC为0.855,高于单项指标预测,见表6、图1。

图1 血清miR-92a-3p、miR-147预测脓毒症患者预后的ROC曲线
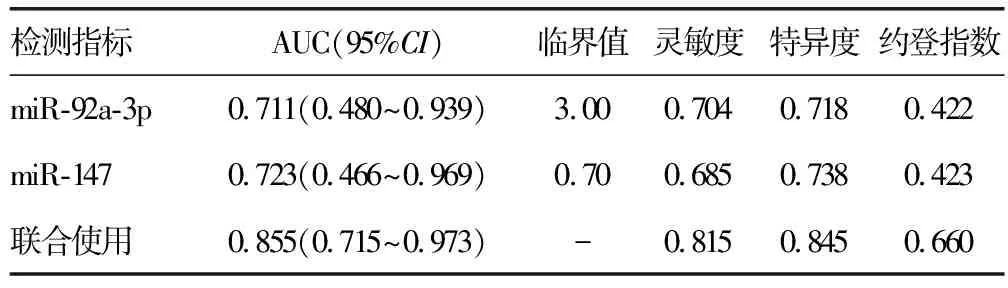
表6 血清miR-92a-3p、miR-147预测脓毒症患者预后的效能
3 讨 论
脓毒症发病机制复杂,已知炎症反应失衡、免疫功能障碍、线粒体损伤、凝血障碍、神经内分泌免疫网络异常、内质网应激、自噬等参与脓毒症发病以及器官功能障碍过程,其中炎症反应失衡是脓毒症发病的关键,贯穿脓毒症发病的全过程,细菌、真菌、寄生虫、病毒等病原体侵入机体后引起初始的急性反应,导致巨噬细胞激活吞噬病原体并释放一系列促炎因子,继而引发细胞因子风暴并激活先天免疫系统,免疫细胞激活后进一步上调炎症相关基因的表达,加剧炎症反应,导致多脏器功能障碍[9-10]。miRNAs主要通过促进信使RNA(mRNA)降解或抑制mRNA翻译来调节基因表达,涉及发育、分化和信号传导的多种细胞过程,已有证据证明部分miRNAs在免疫细胞活化、炎症反应调节中发挥重要作用,是炎症相关介质的重要转录调节因子[11-12]。
miR-92a-3p是miR-17-92簇的成员之一,位于C13orf25/MIR17HG基因的第三个内含子内的chr13q31.3上,其在宫颈癌[13]、乳腺癌[14]、胃癌[15]等多种恶性肿瘤中过表达,并对癌细胞增殖、侵袭和对化疗敏感性具有调节作用。miR-92a-3p与炎性疾病也存在密切关系,有研究显示miR-92a-3p可通过早期生长反应蛋白1促使胰腺细胞中胰蛋白酶原的激活,导致急性胰腺炎发病[16],miR-92a-3p还可抑制磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)信号传导,增加IL-6和TNF-α的产生,促使肺微血管内皮功能障碍,加重急性肺损伤[17]。本研究发现,与对照组比较,脓毒症患者血清miR-92a-3p表达上调,且在脓毒症休克患者中表达更高,进一步分析miR-92a-3p表达与脓毒症患者APACHE Ⅱ评分、SOFA评分呈正相关,miR-92a-3p表达增高是脓毒症患者预后不良的危险因素,表明miR-92a-3p与脓毒症病情以及预后有关,miR-92a-3p可能参与脓毒症发病和进展过程。分析机制为抑癌基因(PTEN)是PI3K/AKT通路的抑制剂,与NF-κB活化有关,NF-κB活化可激活下游炎症信号通路参与脓毒症发病机制,miR-92a-3p通过与PTEN的3′UTR结合激活巨噬细胞中NF-κB信号传导,上调促炎因子IL-1β和TNF-α的表达,启动炎症反应[18],参与脓毒症发病过程。本研究相关性分析结果显示,miR-92a-3p与IL-6、TNF-α、PCT、CRP水平呈正相关,表明miR-92a-3p可能参与脓毒症炎症反应调节,miR-92a-3p过表达可能促使炎症因子合成,加剧全身炎症反应和器官功能衰竭,进而导致不良预后的发生。
miR-147来源于NMES1基因的转录本,位于NMES1基因的第4个外显子,可通过与靶mRNA结合并抑制其靶蛋白的产生,调节细胞增殖、凋亡、迁移、炎症反应以及病毒复制等各种生物过程,在TLR2、TLR3和TLR4刺激下,miR-147在巨噬细胞中激活,负向调节促炎反应,发挥显著抗炎特性,以防止过度炎症反应[5]。研究显示在分枝杆菌感染过程中,miR-147受ESX-1的负调控,其上调可抑制TLR4/NF-κB通路,继而抑制IL-6和 IL-10的产生[19],miR-147在急性心肌梗死大鼠模型心肌细胞中表达下调,上调miR-147的表达可通过靶向同源结构域相互作用蛋白激酶2抑制心肌炎症和细胞凋亡,改善大鼠心功能[20]。本研究结果显示,脓毒症患者血清miR-147表达明显下调,脓毒症休克患者miR-147表达更低,miR-147低表达与脓毒症患者预后不良有关,提示miR-147表达下调可能是脓毒症发病和进展的原因之一。推测可能的原因:脓毒症炎症反应急性期,巨噬细胞在病原体相关分子模式和危险相关分子模式下激活,并促使早期炎症细胞因子的产生[21],miR-147由巨噬细胞中TLRs诱导[5],miR-147表达上调可抑制细胞因子产生从而抑制炎症反应,当敲除miR-147后炎症基因表达上调,导致IL-6合成增加,加剧炎症性器官损伤[22],增加患者预后不良的风险。相关性结果显示,miR-147与IL-6、TNF-α、PCT、CRP呈负相关,也表明miR-147可能通过负性调控炎症反应参与脓毒症发生和进展。
ROC分析结果显示,miR-92a-3p、miR-147预测脓毒症患者预后不良的AUC分别为0.711、0.723,miR-92a-3p、miR-147联合预测脓毒症患者预后不良的AUC为0.855,较单项预测效能明显提高,提示联合检测miR-92a-3p和miR-147可为脓毒症患者预后评估提供更可靠信息。回归分析结果显示,脓毒症休克与脓毒症预后也存在密切关系,这与脓毒症休克引起和加重全身多脏器功能障碍有关。
综上所述,脓毒症患者血清miR-92a-3p表达增高、miR-147表达降低,miR-92a-3p高表达、miR-147低表达与脓毒症休克、炎症反应加剧以及预后不良均有关,可作为脓毒症预后的标志物。miR-92a-3p、miR-147可能通过调控炎症反应参与脓毒症发生和进展过程。

