血清SLPI、SPOCK2与卵巢癌临床病理特征关系及其在预后评估中的价值
丁玲玲,沈苏琴,汪晓曼
南京医科大学附属妇产医院/南京市妇幼保健院检验科,江苏南京 210009
卵巢癌是常见的女性生殖系统的恶性肿瘤,死亡率位居妇科恶性肿瘤首位,全球年龄标准化的5年净生存率在30%~50%之间[1]。卵巢癌发病隐匿,早期缺乏特异性的临床症状,80%的患者初诊时已处于晚期。晚期卵巢癌患者复发率高,临床转归差,5年生存率低于30%[2-3],因此根据卵巢癌的临床病理特征对其转归进行早期预测并实施个体化干预,对优化治疗方案,改善预后,提高治疗效果具有十分重要的意义。分泌型白细胞蛋白酶抑制因子(SLPI)是一种黏膜上皮细胞分泌的非糖基化单链多肽蛋白,通过促进肿瘤细胞的迁移和侵袭功能,诱发肿瘤的发生发展,已被证实是某些恶性肿瘤不良预后评估的重要标志物[4]。睾素2(SPOCK2)是一类富含半胱氨酸的酸性分泌蛋白/骨连接素蛋白,该基因在恶性肿瘤细胞的侵袭和转移中发挥重要功能,作为潜在的致癌基因是某些恶性肿瘤不良预后的指标及治疗靶点[5]。本研究通过检测卵巢癌患者血清中SLPI、SPOCK2水平,分析SLPI、SPOCK2表达与卵巢癌患者临床病理特征及预后的关系,旨在明确其在卵巢癌患者不良预后评估中的临床价值,现报道如下。
1 资料与方法
1.1一般资料 将2018年1月至2019年11月于本院治疗的67例卵巢癌患者和同期于本院体检的48例健康者为纳入研究,分别作为卵巢癌组和对照组。纳入标准:(1)经病理学确诊为卵巢癌;(2)术前未接受卵巢癌相关治疗;(3)术后严格按照卵巢癌诊疗规范进行相应治疗;(4)具备完整临床资料和随访资料。排出标准:(1)合并其他恶性肿瘤者;(2)合并心、脑、肾、肝等器官功能障碍者;(3)术前行放疗、化疗和激素治疗者;(4)临床资料、随访资料不完整者。卵巢癌组年龄41~73岁,平均(55.16±9.88)岁;正常对照组年龄39~72岁,平均(54.32±10.12)岁。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准通过,且均获得患者知情同意。
1.2方法
1.2.1标本收集 留取患者静脉血5 mL,室温静置20 min,3 000 r/min离心10 min,取上清-80 ℃保存待测。
1.2.2指标检测 采用酶联免疫吸附法(ELISA)检测血清中SLPI、SPOCK2水平(试剂盒购于上海沪震实业有限公司),严格按照试剂盒说明书进行操作。SLPI检测范围为62.5~4 000.0 pg/mL,SPOCK2检测范围为0.312~20.000 ng/mL。
1.2.3生物信息学分析 通过基因表达谱数据动态分析(GEPIA)在线网站(http://gepia.cancer-pku.cn/)分析426例卵巢癌组织和88例正常卵巢组织中SLPI、SPOCK2表达。利用Kaplan-Meier法(http://www.kmplot.com)分析SLPI、SPOCK2表达水平与卵巢癌患者预后生存情况的关系。
1.2.4随访 对卵巢癌患者进行术后随访,以首次手术日期为随访开始时间,每隔3个月,采用电话形式或门诊复查形式,以2021年11月为随访截止时间,随访结局变量为复发或无复发。

2 结 果
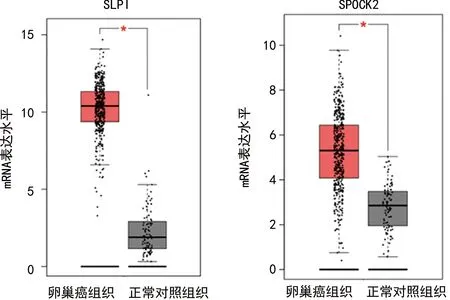
2.1卵巢癌患者与健康者组织及血清中SLPI、SPOCK2水平的比较 在线GEPIA数据库对426例卵巢癌组织和88例正常对照组织中SLPI和SPOCK2表达水平进行比较,卵巢癌组织中SLPI和SPOCK2蛋白水平均高于正常对照组织,差异有统计学意义(P<0.05),见图1。卵巢癌组血清SLPI、SPOCK2水平高于对照组,差异有统计学意义(t=2.038、2.203,均P<0.05),见表1。

表1 2组间血清SLPI、SPOCK2水平比较
注:*P<0.05。
2.2SLPI、SPOCK2表达与临床病理特征的关系 SLPI、SPOCK2的阳性表达率在不同FIGO分期、肿瘤分化程度、有/无淋巴结转移以及有/无腹水的卵巢癌患者间进行比较,差异均有统计学意义(P<0.05)。而SLPI、SPOCK2的阳性表达率在不同年龄、绝经状态、肿瘤大小(以肿瘤最大径表示)以及病理类型的患者间比较,差异均无统计学意义(P>0.05)。见表2。

表2 SLPI、SPOCK2表达与卵巢癌患者临床病理参数分析
2.3SLPI、SPOCK2表达与卵巢癌患者生存关系分析 Kaplan-Meier法对数据库中的424例卵巢癌患者的生存分析显示,随着SLPI和SPOCK2水平的增加,患者的生存率降低,差异有统计学意义(P<0.05)。SLPI和SPOCK2的危险率(HR)分别为1.4和1.5(HR大于1为疾病的危险因素),提示SLPI和SPOCK2高表达是卵巢癌患者不良预后的危险因素。见图2。
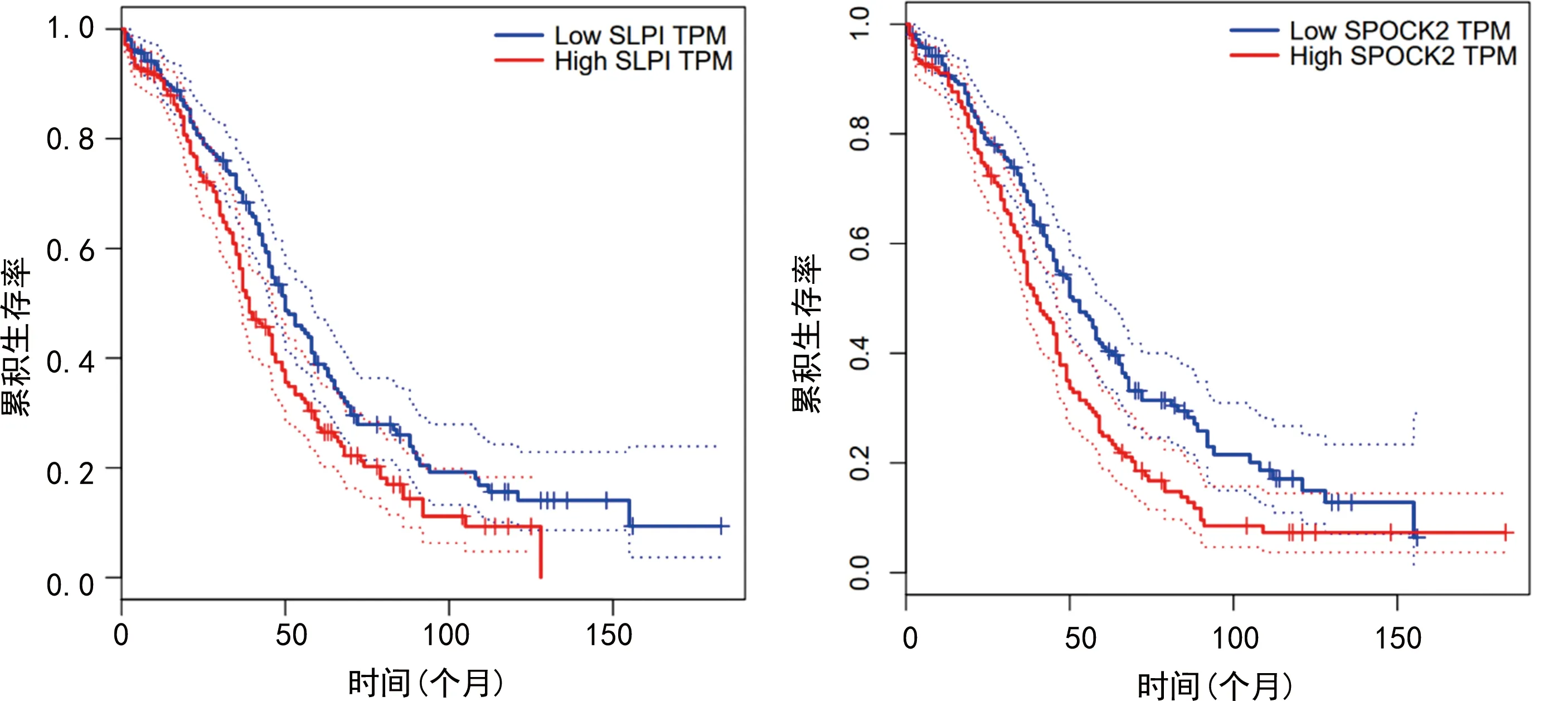
注:Low SLPI TPM表示SLPI低表达,High SLPI TPM表示SLPI高表达; Low SPOCK2 TPM表示SPOCK2低表达,High SPOCK2 TPM表示SPOCK2高表达。
2.4多因素Logistic回归模型分析影响卵巢癌患者不良预后的危险因素 以卵巢癌患者的治疗结局为因变量(1=复发,0=无复发),进行多因素Logistic回归分析,结果显示:FIGO分期Ⅲ+Ⅳ期、肿瘤低分化、淋巴结转移、腹水、SLPI阳性表达、SPOCK2阳性表达是卵巢癌患者不良预后的危险因素(均P<0.05),见表3。根据Logistic回归模型分析结果,构建卵巢癌不良预后风险预测模型:Z=-2.926+1.549X1+1.928X2+1.066X3+1.353X4+1.674X5+2.015X6,其中,X1为FIGO分期,X2为分化程度,X3为淋巴结转移,X4为腹水,X5为SLPI阳性,X6为SPOCK2阳性。变量赋值情况见表4。
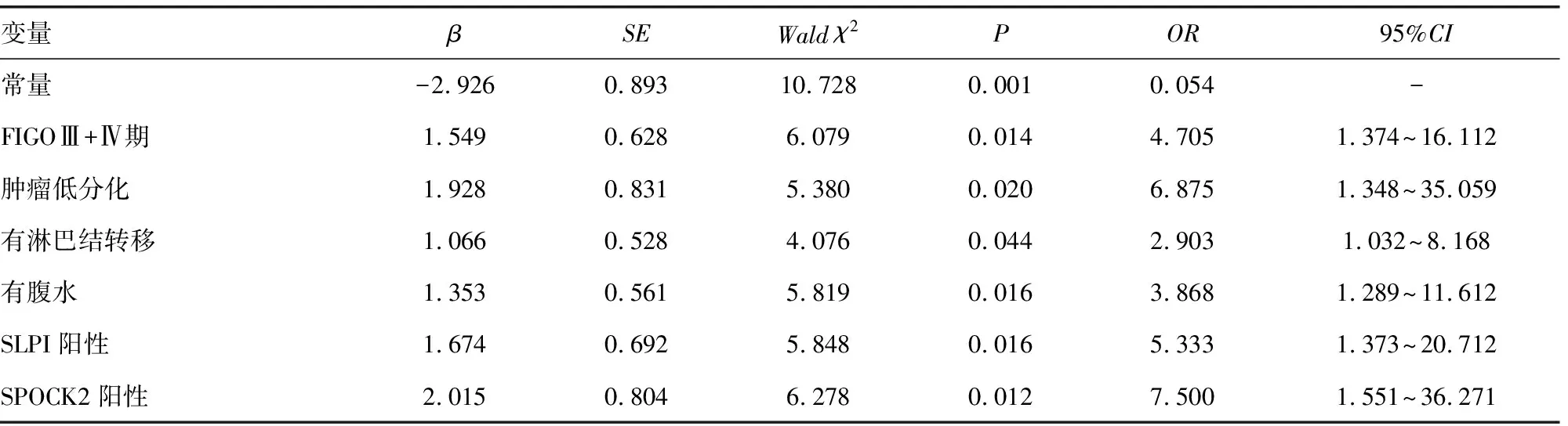
表3 多因素Logistic回归模型分析影响卵巢癌不良预后的危险因素

表4 变量赋值情况
2.5卵巢癌不良预后风险预测模型诊断效能 使用ROC曲线对卵巢癌不良预后的预测效能进行评估,曲线下面积(AUC)为0.817(95%CI:0.703~0.901,P<0.001),以Youden指数最大值(0.727)为最佳临界点,模型灵敏度为0.852,特异度为0.875,提示该模型对卵巢癌不良预后预测效果较好。见图3。

图3 卵巢癌不良预后风险预测模型的ROC曲线
3 讨 论
卵巢癌是一种细胞形态、临床表现和遗传背景均有不同特征的异质性疾病,临床多采用手术、化疗和放疗等治疗方案,但因卵巢癌具有高复发率和多药耐药性,患者5年生存率较低[6]。基于此,寻找相关的生物标记物用于卵巢癌患者复发和转移的预测,可为卵巢癌的个体化治疗方案提供有价值的科学依据。SLPI在乳腺癌、肺癌、前列腺癌等多种恶性肿瘤中呈现高表达,且与肿瘤患者的不良预后关系密切[7-9]。SLPI作为促癌因子,通过Elk-1信号通路调控MMP-2/9的表达,进而促进肿瘤细胞迁移和侵袭,诱导了胃癌的发生、发展[10]。最新研究表明,耐药性卵巢癌细胞株中SLPI表达上调,过表达SLPI基因抑制肿瘤细胞凋亡并促进肿瘤细胞的生长[11]。细胞实验证实,SLPI基因过表达促进SKOV3细胞中增殖相关蛋白PCNA和Cyclin D1的表达,或者抑制胰岛素样生长因子结合蛋白3(IGFBP-3)、凋亡正相关蛋白BAX、Cleaved Caspase-9的表达,进而促进卵巢癌细胞的增殖[12]。
通过在线GEPIA数据库对426例卵巢癌组织和88例正常对照组织中SLPI表达进行分析比较,除个别SLPI表达过高或过低离散点(由卵巢癌患者个体差异因素造成)外,卵巢癌组织和正常对照组织标本中的表达水平明显聚集于两个不同平均值附近,而且卵巢癌组织中SLPI平均表达水平显著高于正常对照组织。但GEPIA在线网站并未提供426例卵巢癌组织中SLPI水平与卵巢癌患者临床病理特征的关系,然而在实际诊疗过程中,存在卵巢癌患者临床病理特征不一致、临床治疗方式也不一致的情况,为了明确SLPI表达水平与卵巢癌临床特征性的相关性,弥补GEPIA在线网站的不足之处,笔者对本研究入组的67例卵巢癌患者血清中SLPI表达与卵巢癌患者临床病理特征(包含年龄、绝经状态、肿瘤大小、FIGO分期、病理类型、分化程度、淋巴结转移以及腹水等特征)细分后,进行统计学分析。研究发现,卵巢癌患者血清中SLPI水平明显高于正常对照组,且FIGO分期Ⅲ+Ⅳ期的卵巢癌患者,肿瘤低分化及有淋巴结转移和腹水的卵巢癌患者,血清中SLPI水平显著高于FIGO分期Ⅰ+Ⅱ期、肿瘤中高分化及没有淋巴结转移和没有腹水的卵巢癌患者。Kaplan-Meier生存曲线分析结果显示,随着SLPI表达水平的增加,患者的生存率显著降低,且SLPI的危险率(HR)为1.4,提示SLPI水平升高是卵巢癌患者不良预后的重要风险因素。SLPI参与了卵巢癌的发生发展,可能与SLPI通过保护颗粒蛋白前体免受降解,促进Cyclin D等的表达及抑制抗细胞增殖因子IGFBP-3的表达,激活NF-κB促进血管发生密切相关,以上数据充分表明,SLPI是一种潜在卵巢癌患者术后复发与总生存率评估的重要生物学指标。已有研究证实,脑胶质瘤中SPOCK2基因上调表达可通过与其家族成员SPOCK1及SPOCK3结合,解除SPOCK1及SPOCK3对MMP2的抑制作用,由此消除其他SPOCK家族成员对MT-MMPs的失活作用,导致ECM重塑,进而促进胶质瘤细胞的迁移和侵袭,该研究提示SPOCK2对细胞侵袭性的影响是通过与其家族其他成员相互作用实现的[13-14]。另一研究证实,乳腺癌细胞中SPOCK2的mRNA高表达与脑转移具有很强的相关性[15]。本研究中,通过在线GEPIA数据库分析,除个别SPOCK2表达过高或过低离散点(由卵巢癌患者个体差异因素造成)外,卵巢癌组和正常对照组内标本明显聚集于两个不同平均值附近,且卵巢癌组织中SPOCK2平均表达水平显著高于正常对照组织。进一步,为了明确SPOCK2表达水平与卵巢癌临床特征性的相关性,弥补GEPIA数据库的不足之处,我们对本研究入组的67例卵巢癌患者血清中SPOCK2表达与卵巢癌患者临床病理特征(包含年龄、绝经状态、肿瘤大小、FIGO分期、病理类型、分化程度、淋巴结转移以及腹水等特征)细分后,进行统计学分析。研究发现,血清中SPOCK2水平在不同患者的FIGO分期、肿瘤分化程度、淋巴结转移及腹水中具有显著差异性,提示SPOCK2基因与卵巢癌细胞的转移和扩散密切相关。生存曲线分析表明,随着SPOCK2表达水平的增加,卵巢癌患者的生存率降低,SPOCK2的危险率(HR)为1.5,提示SPOCK2水平升高是卵巢癌患者不良预后的重要风险因素。分析原因可能是SPOCK2具有调控卵巢癌细胞迁移及侵袭相关基因的功能,SPOCK2基因导致肿瘤细胞迁移微环境的改变,进而造成病情的进展。以上数据表明,SPOCK2是另外一种卵巢癌患者潜在的病情监测及判断预后的评价指标。多因素Logistic回归模型对卵巢癌预后的危险因素进行分析,结果显示血清SLPI、SPOCK2高表达是卵巢癌复发与不良预后的独立危险因素,与FIGO Ⅲ+Ⅳ期、肿瘤低分化、淋巴结转移及腹水等因素一起构成卵巢癌不良预后风险预测模型。使用ROC曲线对模型的预测能力进行评估,AUC为0.817(95%CI:0.703~0.901,P<0.05),以Youden指数最大值(0.727)为最佳临界点,该模型灵敏度为0.852,特异度为0.875,提示该模型对卵巢癌不良预后预测效果较好。综上所述,卵巢癌患者血清中SLPI和SPOCK2阳性表达,能够成为FIGO分期,肿瘤分化程度、淋巴结转移、腹水等临床病理特征的有力补充,由此构建卵巢癌风险预测模型具有良好的评估效果,进而对卵巢癌的治疗方案进行个体化指导,提高预后质量,因此具有重要的临床应用价值。

