cMPO、HLA-B27在急性淋巴细胞白血病中的表达及临床意义*
黄婧芫,刘伟平,钟辉秀,章梁君,徐紫龄,宋碧辉
自贡市第一人民医院检验科,四川自贡 643000
急性淋巴细胞白血病(ALL)是急性白血病的一种,主要起源于B系、T系淋巴祖细胞,可导致白血病细胞在骨髓内增生与聚集,抑制机体正常造血功能从而诱发贫血,降低血小板及中性粒细胞水平,并侵入脑膜、淋巴结及骨组织等[1]。ALL好发于儿童,少见于成年人,ALL占急性白血病的30%~40%,严重威胁儿童健康[2]。目前临床对于ALL的诊断主要依据病理活检结果,但该检查方式属于有创检查,不利于患者后续治疗[3]。因此,临床需要积极寻找ALL相关的可用于非侵入性检查的生物学标志物。髓过氧化物酶(MPO)是源于中性粒细胞中的蛋白质,采用流式细胞术检测细胞质髓过氧化物酶(cMPO)属于临床常用的MPO检测方式,MPO与急性白血病关系密切[4]。人类白细胞抗原(HLA)-B27是第6号染色HLA基因B座一个等位基因的表达产物,能够促进CD8+T淋巴细胞介导的病毒清除。有研究报道,HLA基因多态性与白血病发生有关[5]。由此推测cMPO、HLA-B27表达情况可能与ALL发生及治疗效果有关。因此,本研究分析cMPO、HLA-B27表达情况与ALL发生及治疗效果的关系,现报道如下。
1 资料与方法
1.1一般资料 将2020年10月至2022年10月本院收治的45例ALL患者纳入研究作为ALL组,另选取同期于本院治疗的45例非恶性血液疾病患者作为非ALL组。ALL组男26例,女19例;年龄4~12岁,平均(8.27±3.15)岁;免疫细胞分型:B细胞39例,T细胞6例;疾病危险度分级:标危29例,中危10例,高危6例。非ALL组男22例,女23例;年龄4~13岁,平均(8.03±3.09)岁;增生性贫血32例,特发性血小板减少性紫癜13例。纳入标准:(1)ALL组患者符合ALL的相关诊断标准[6],并经病理学检查确诊;(2)初次确诊ALL。排除标准:(1)合并先天性疾病;(2)有化疗禁忌证;(3)合并免疫功能障碍;(4)过敏体质。本研究经自贡市第一人民医院医学伦理委员会批准。患儿家属对本研究知情同意并签署知情同意书。
1.2仪器与试剂 磷酸盐缓冲液为德国西门子医学诊断产品有限公司产品;Navios 8 COLORS型流式细胞仪为贝克曼库尔特公司产品;cMPO检测试剂盒为INOVA Diagnostics公司产品;HLA-B27检测试剂盒为贝克曼库尔特公司产品。破膜剂PBS-Triton购自语纯生物公司。
1.3方法
1.3.1cMPO、HLA-B27的检测 受试者入院时进行这两项指标的检测。cMPO的检测:采集患儿清晨空腹外周肘静脉血5 mL,加入荧光标记抗体,混匀后,避光放置30 min,离心后去上清液,然后加入磷酸盐缓冲液30 μL,破膜剂PBS-Triton 40 μL混匀,避光放置30 min,洗涤、离心后去除上清液,加入细胞质抗体20 μL混匀,避光放置30 min,使用流式细胞仪检测cMPO表达情况,荧光强度显示“negative”为阴性,积分为0分,积分为1~3分为阳性。HLA-B27的检测:按照HLA-B27检测试剂盒要求进行操作,流式细胞仪所用抗体为HLA-B27-FITC/CD3-PE;实际检测标本经FACSCalibur FCM HLA-B27 专用软件分析后报告检测结果,以CD3-PE标记的T淋巴细胞设门并检测细胞HLA-B27的平均荧光强度,与校准误的数值比较,≥校准误的数值为阳性,否则为阴性。
1.3.2基线资料收集及比较 比较两组性别、年龄、体重、骨髓幼稚细胞比例、肝大情况、脾大情况、淋巴结大情况、白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、出血情况。
1.2.3治疗方案及疗效评估 参照《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[6]给予常规治疗,第1、8、15、22天静脉注射长春新碱(深圳万乐药业有限公司,国药准字H44021772)2 mg/m2;第1~3天及第15~17天静脉注射柔红霉素(瀚晖制药有限公司,国药准字H33020925)30 mg/m2;第19~28天静脉滴注左旋门冬酰胺酶(天津生物化学制药有限公司,国药准字H19993445);第1~14天口服泼尼松(国药集团容生制药有限公司,国药准字H41020636)30 mg/m2,第15~28天开始适当减量。于疗程结束后参照文献[7]中的方法评估患者临床疗效。临床症状消失或有所改善、血常规检查恢复正常或改善为有效,无明显改善或病情加重为无效。将有效患者纳入有效组,将无效患者纳入无效组。

2 结 果
2.1两组基线资料比较 ALL组cMPO阳性、HLA-B27阳性比例高于非ALL组(P<0.05),其他项目两组间比较差异无统计学意义(P>0.05),见表1。

表1 两组基线资料比较[n(%)或
2.2ALL发生的影响因素分析 将患者ALL发生情况(0=非ALL,1=ALL)作为因变量,将cMPO抗体、HLA-B27表达情况(0=阴性,1=阳性)作为自变量,经单项Logistics回归分析后,将P值放宽至<0.1,纳入符合条件的因素,行二元Logistics回归分析,结果显示,cMPO、HLA-B27阳性是ALL发生的危险因素(OR>1,P<0.05)。见表2。

表2 ALL发生的影响因素分析
2.3不同疗效患者基线资料比较 45例ALL患者经4次给药后,有效35例,无效10例,无效组骨髓幼稚细胞比例、Hb、PLT低于有效组,WBC高于有效组(P<0.05);两组其他项目比较差异无统计学意义(P>0.05)。见表3。

表3 不同疗效患者基线资料比较[n(%)或
2.4ALL治疗无效的影响因素分析 将ALL患者治疗效果(0=有效,1=无效)作为因变量,将cMPO抗体、HLA-B27表达情况(0=阴性,1=阳性)作为自变量,经单项Logistics回归分析后,将P值放宽至<0.1,纳入符合条件的因素,行二元Logistics回归分析,结果显示,cMPO、HLA-B27阳性是ALL患者治疗无效的危险因素(OR>1,P<0.05)。见表4。
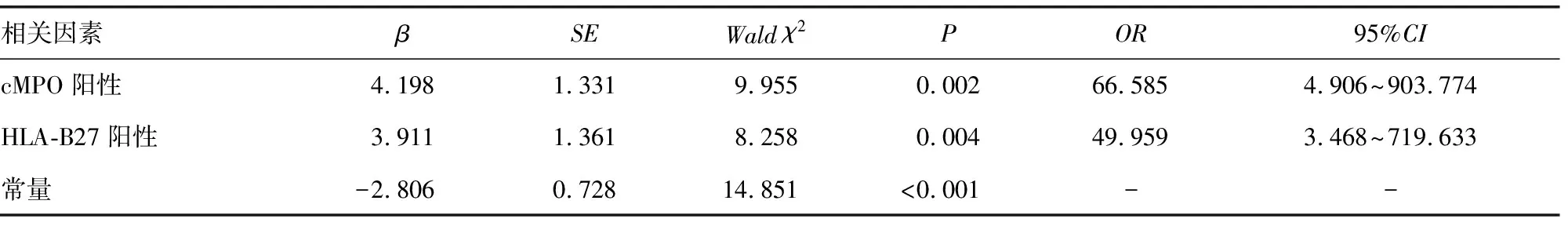
表4 cMPO抗体、HLA-B27与ALL治疗无效的相关性
3 讨 论
ALL是由于造血干细胞在分化为淋巴细胞过程中发生恶性增殖所致,影响机体正常造血,并浸润肝、脾、淋巴结等组织造成器官肿大,引发相应临床症状。ALL发病急骤、进展迅猛,临床患者多表现出贫血、出血等症状。目前临床对于ALL主要采取化疗及免疫治疗,据相关研究结果显示,ALL患儿经治疗后5年无病生存期超过80%,但仍有部分患者疗效一般[8-9]。
目前临床对于ALL的评估主要依靠骨髓细胞形态学及组织化学法,但上述评估方法易受检查者主观因素影响,对检查者临床经验要求较高。同时部分细胞蛋白表达信息存在一定特殊性及易变性,从而影响临床评估,不利于临床治疗方案的制订。因此,临床仍需积极寻找可影响ALL发生及治疗效果的指标。MPO是人类中性粒细胞水平最高的一种蛋白质,据相关研究显示,MPO孤立表达与急性B淋巴细胞白血病患者生存结局相关[10]。HLA-B27抗原为HLA-Ⅰ类基因B座位上的抗原,是一组紧密相关的组织相容性抗原,可控制细胞毒性T淋巴细胞的特异性[11]。有研究报道,HLA基因表达与白血病患病风险关系密切[12]。由此推测cMPO、HLA-B27表达情况可能与ALL的发生及临床疗效相关。
本研究结果显示,ALL组cMPO阳性、HLA-B27阳性患者比例高于非ALL组,二元Logistics回归分析结果显示,cMPO、HLA-B27阳性是ALL发生的危险因素,表明ALL患者cMPO、HLA-B27呈阳性表达,且与ALL的发生关系密切。cMPO检测主要采用组织化学染色或流式细胞术,使用了各类抗血细胞表面分化抗原的单克隆抗体,通过测定荧光染色强度,从而获取各种抗原水平[12-13]。cMPO合成是在早幼粒细胞阶段,再经加工、包装进入嗜天青颗粒。MPO阳性表达是细胞髓系来源的标志,而ALL正是由于白血病细胞在骨髓内异常增殖与聚集造成,并可侵犯髓外组织,因此ALL cMPO呈阳性表达[14]。MPO SpSp基因还可促进髓前体细胞增殖,使其失去分化为成熟血细胞能力,从而增加白血病发生风险[15]。
HLA-B27在一般人群中阳性率仅为5%左右,HLA-B27在多种疾病中呈阳性表达,如强直性脊柱炎及多系统炎症性疾病[16]。ALL是造血细胞的恶性克隆性疾病,造血干细胞是血液及免疫系统的起始细胞,由此可见免疫功能障碍与ALL关系密切。有研究指出,HLA可能是导致白血病重要的遗传因素之一[17]。HLA-B27可将抗原肽提呈给T细胞识别,从而起到特异性免疫应答,并参与免疫应答的遗传学控制及T细胞发育,从而导致患者出现免疫功能异常,增加ALL发生风险[18]。人类T淋巴细胞病毒Ⅰ型是造成T淋巴细胞白血病重要原因[19]。而HLA-B27与病毒感染密切相关,HLA-B27在抗病毒感染过程中起到重要作用,HLA-B27可促进CD8+T淋巴细胞介导的病毒清除,从而清除机体病毒[20]。HLA-B27阳性表达也提示患者病毒感染较为严重,ALL发生风险增加,影响临床治疗效果[21]。
综上所述,cMPO、HLA-27阳性表达与ALL的发生及临床疗效密切相关,临床可通过检测cMPO、HLA-27表达情况,针对性地制订治疗方案,从而提高ALL患者临床疗效。

