卵巢子宫内膜异位症中Vaspin、Visfatin的表达情况及在预后判断中的价值*
邓 凤,易旺军,吴 樱,刘 洋,陈 怡
长沙市第三医院/湖南中医药大学附属长沙医院妇产科,湖南长沙 410015
子宫内膜异位症是指子宫外出现子宫内膜腺体和间质等子宫内膜样组织。卵巢子宫内膜异位症(OEM)是较常见的子宫内膜异位症类型,主要表现为痛经、盆腔疼痛及不孕等,严重影响女性身体健康[1]。OEM的标准诊断方法是腹腔镜检及组织学检查,治疗上以腹腔镜手术切除异位病变组织为主,但术后容易出现复发,术后3年复发率为20%~50%[2]。深入研究OEM的发病机制,寻找新的预后相关血清标志物,有助于临床诊治。内脏脂肪组织来源的丝氨酸蛋白酶抑制剂(Vaspin)是丝氨酸蛋白酶抑制剂家族的成员,主要存在于内脏及皮下脂肪组织中[3]。近年来发现,Vaspin作为一种脂肪因子,通过促进胰岛素抵抗,参与妊娠期糖尿病的发生、发展[4]。内脂酶(Visfatin)也被称为烟酰胺磷酸核糖基转移酶,催化烟酰胺与5-磷酸核糖基-1-焦磷酸缩合产生烟酰胺单核苷酸。Visfatin参与包括新陈代谢、应激反应和衰老等多种重要的生物过程[5]。目前OEM中脂肪细胞因子Vaspin、Visfatin的表达及临床意义尚不清楚。本研究通过检测OEM患者和健康对照人群的血清Vaspin、Visfatin水平,分析这两项指标的临床价值。
1 资料与方法
1.1一般资料 将2017年8月至2019年5月本院收治的86例OEM患者纳入研究作为OEM组。纳入标准:(1)经病理检查确诊为OEM,符合中华医学会妇产科学分会制定的《子宫内膜异位症诊治指南》[6];(2)临床及随访资料完整;(3)患者均为初次诊治,入院前无治疗史。排除标准:(1)合并系统性红斑狼疮,类风湿性关节炎等自身免疫性疾病;(2)伴有卵巢囊肿、既往有盆腔手术史;(3)术前6个月内无内异症相关激素类药物治疗史。年龄23~44岁,平均(30.96±5.61)岁;体重指数为(22.08±3.18)kg/m2;囊肿大小(5.94±2.03)cm;术后妊娠25例;术后用药49例;OEM分期参考美国生殖医学学会(ASRM)的标准[7],Ⅰ~Ⅱ期43例,Ⅲ~Ⅳ期43例。以视觉模拟评分量表(VAS)对痛经程度进行评估,其中轻度疼痛(VAS评分1~3分)41例,中度疼痛(VAS评分4~7分)25例,重度疼痛(VAS评分8~10分)20例。选取同期于本院进行健康体检的64例育龄期健康女性作为对照组,年龄23~43岁,平均(30.78±6.14)岁;体重指数(21.21±3.21)kg/m2。两组年龄、体重指数等比较,差异无统计学意义(P>0.05)。患者及家属对本研究均知情同意并签署知情同意书,本研究经本院伦理委员会审核批准。
1.2方法
1.2.1血清Vaspin、Visfatin的检测 采用酶联免疫吸附法(ELISA)检测受试者血清Vaspin、Visfatin水平。OEM组于入院时采集静脉血标本,对照组于健康体检时采集静脉血标本5 mL,以3 000 r/min离心10 min,分离上层血清。人Vaspin ELISA试剂盒购自上海联祖生物科技公司,检测范围54~1 000 pg/mL,检测下限20 pg/mL。人Visfatin ELISA试剂盒购自上海齐态生物科技公司,检测范围3.75~120 ng/mL,检测下限0.2 pg/mL。检测操作严格按照试剂盒说明书进行。反应结束后用酶标仪测量450 nm 波长下的吸光度值(A450),绘制标准曲线,计算样品浓度,每个样品重复检测3次。
1.2.2术后治疗 30例OEM患者术后接受促性腺激素释放激素激动剂(GnRH-a)治疗,方案:从术后第3天至第5天开始,应用亮丙瑞林3.75 mg或戈舍瑞林3.6 mg,皮下注射,每月注射1次,共用6次。19例OEM患者术后接受口服避孕药治疗,方案:术后月经来潮第1天开始服用达英-35,1片/天,连续服用21 d为一个周期,停药间隔1周再进行下一个周期服药,共6个周期。
1.2.3随访 所有患者自出院后开始随访,每3个月电话或门诊随访1次,随访3年,随访内容为患者OEM术后复发情况,记录无复发生存时间。随访截至2021年2月1日,随访期间失访1例,失访率1.16%(1/86)。OEM复发的判断标准[8]:术后病灶缩小或消失,症状缓解后再次出现临床症状,症状进行性加重,且出现新的内异症病灶。

2 结 果
2.1OEM组和对照组血清Vaspin、Visfatin水平比较 OEM组患者血清Vaspin、Visfatin水平分别为(218.01±31.66)、(34.38±6.75)ng/mL,对照组这两项指标水平分别为(421.50±50.47)、(11.61±4.50)ng/mL。与对照组比较,OEM组患者血清Vaspin水平较低,Visfatin水平较高,差异有统计学意义(t=30.254、23.385,P<0.001)。
2.2血清Vaspin、Visfatin水平与OEM患者ASRM分期及痛经严重程度的关系 不同ASRM分期的OEM患者血清Vaspin、Visfatin比较,差异均有统计学意义(P<0.05)。与ASRM分期Ⅰ~Ⅱ期患者比较,Ⅲ~Ⅳ期患者的血清Vaspin水平较低,Visfatin水平较高。不同疼痛程度的OEM患者血清Vaspin、Visfatin水平比较差异均无统计学意义(P>0.05)。见表1。

表1 血清Vaspin、Visfatin与OEM患者ASRM分期及痛经严重程度的关系
2.3OEM复发影响因素的单因素分析 与未复发组比较,复发组ASRM分期Ⅲ~Ⅳ期患者比例较高,术后妊娠、术后用药患者比例及Vaspin水平较低,Visfatin水平较高,差异均有统计学意义(P<0.05);未复发组和复发组年龄、体重指数、囊肿大小、疼痛程度等方面比较,差异均无统计学意义(P>0.05)。见表2。

表2 OEM复发组和无复发组临床参数比较或n)
2.4多因素Logistic回归分析影响OEM复发的因素 以随访过程中患者是否发生OEM术后复发作为因变量(发生=1,未发生=0),将ASRM分期(Ⅲ~Ⅳ期=1,Ⅰ~Ⅱ期=0)、术后妊娠(有=1,无=0)、术后用药(有=1,无=0)、Vaspin、Visfatin作为自变量,进行多因素Logistic回归分析。结果显示,ASRM分期Ⅲ~Ⅳ期、Vaspin水平降低、Visfatin水平升高是OEM患者术后复发的独立危险因素,术后妊娠和术后用药是OEM患者术后复发的保护因素。见表3。
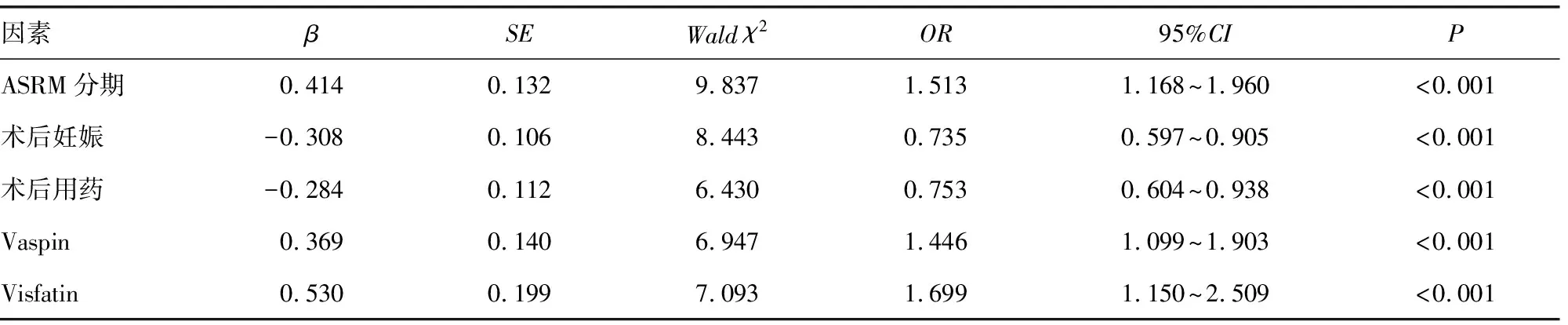
表3 多因素Logistic回归分析影响OEM复发的因素
2.5血清Vaspin、Visfatin单独及联合检测对OEM复发的预测效能 血清Vaspin、Visfatin单独及联合检测对OEM术后复发预测的曲线下面积(95%CI)分别为0.890(0.820~0.959)、0.838(0.767~0.908)及0.931(0.878~0.985),联合检测的预测效能高于血清Vaspin、Visfatin单项指标检测(Z=3.098、4.640,P=0.002、<0.001)。见表4、图1。

图1 ROC曲线分析血清Vaspin、Visfatin单独及联合检测对OEM复发的预测效能
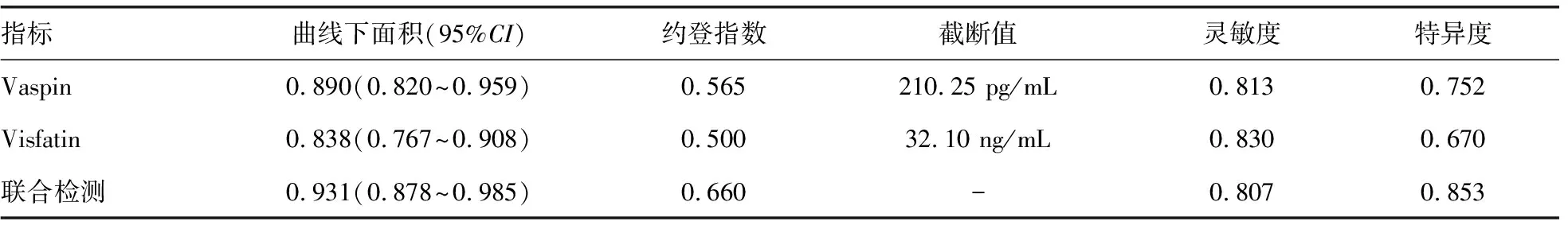
表4 血清Vaspin、Visfatin单独及联合检测对OEM复发的诊断效能
2.6Vaspin、Visfatin表达对OEM患者无复发生存的影响 以OEM患者血清Vaspin、Visfatin水平的平均值为界,将OEM患者分为Vaspin高表达组(n=42)和低表达组(n=44),Visfatin高表达组(n=41)和低表达组(n=45)。Vaspin高表达组和低表达组无复发生存率分别为80.95%(34/42)、45.45%(20/44),Vaspin低表达组累积无复发生存情况差于Vaspin高表达组,差异有统计学意义(Log-Rankχ2=4.079,P=0.041)。Visfatin高表达组和低表达组无复发生存率分别为53.66%(22/41)、71.11%(32/45),Visfatin高表达组累积无复发生存情况差于Visfatin低表达组,差异有统计学意义(Log-Rankχ2=6.601,P=0.010)。见图2。
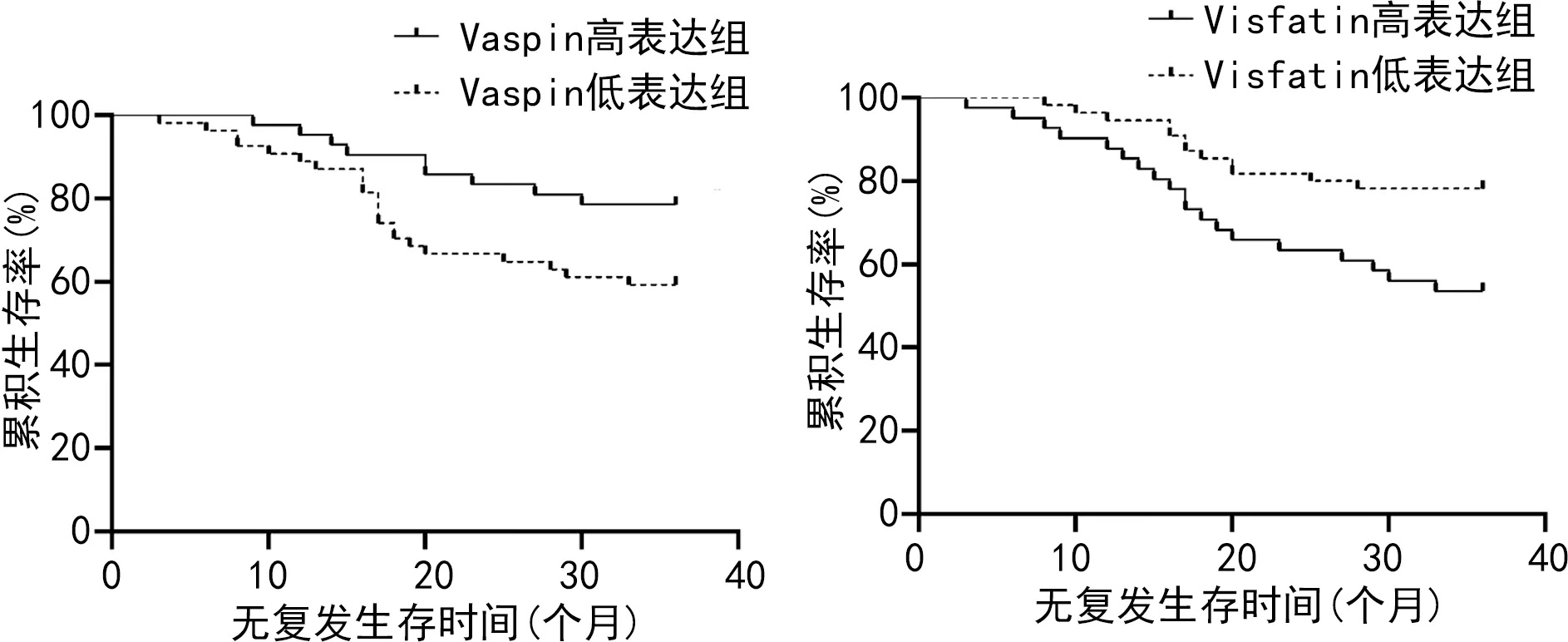
图2 Kaplan-Meier法分析Vaspin、Visfatin表达对OEM患者无复发生存的影响
3 讨 论
子宫内膜异位症中的促炎症介质包括白细胞介素(IL)-6、肿瘤坏死因子-α,它们的表达异常增加,可引起血管内皮功能障碍,诱导细胞错配修复功能异常,促进卵巢子宫内膜异位症的恶性转化[9-10]。脂肪细胞因子是由白色脂肪组织分泌的蛋白质,影响机体新陈代谢、免疫、内分泌系统和炎症调节[11]。脂肪细胞因子是影响子宫内膜异位症发生的重要因素,其能够影响机体的抗炎和促炎过程,参与子宫内膜异位症疾病的发生、发展[12]。
Vaspin是一种新型脂肪细胞因子,具有胰岛素增敏的作用,参与机体脂质代谢的调节,在糖尿病、多囊卵巢综合征和不孕症等疾病中发挥重要的作用[13-14]。子宫内膜异位症患者脂质代谢存在紊乱的现象[3],因此,笔者推测Vaspin可能与OEM疾病发生、发展关系密切。有学者在子宫内膜异位症患者中发现血清Vaspin mRNA水平明显下调[12],这与本研究中OEM组患者血清Vaspin水平降低的结果一致,但本研究是在蛋白水平进行检测,结果更为准确。本研究中血清Vaspin水平与ASRM分期有关,提示Vaspin水平的降低参与了OEM疾病进展。有研究报道,Vaspin能够促进细胞中AKT蛋白的磷酸化水平,抑制核因子kappa B的激活,减弱促炎性细胞因子如IL-1β及黏附因子如上皮型钙黏素的表达[15]。此外,Vaspin还能够通过抑制CCAAT/增强子结合蛋白α的转录,抑制肿瘤坏死因子α及IL-6的表达和分泌,促进3T3-L1前脂肪细胞的分化和脂质积累[16]。因此,OEM中Vaspin的表达降低导致其抗炎作用显著降低,促进OEM疾病的发生、发展。OEM虽然是一种良性疾病,但具有侵袭、浸润和转移的特点。本研究中,Vaspin水平降低是OEM复发的独立危险因素,而且Vaspin低表达患者无复发生存情况较差,提示Vaspin是新的评估OEM术后复发的血清标志物。有研究报道,Vaspin能够通过结合并抑制葡萄糖调节蛋白78介导的内质网应激,抑制细胞增殖,迁移和侵袭能力[17]。因此,Vaspin低表达会导致异位的子宫内膜细胞侵袭迁移能力增强,腹腔镜术中部分肉眼不可见的细微病灶不能去除,增加术后复发风险。
Visfatin是一种烟酰胺磷酸核糖基转移酶,可分泌到细胞外,并作为一种炎性细胞因子,参与糖尿病、恶性肿瘤等多种疾病的病理过程。本研究中,OEM患者血清Visfatin水平明显升高,与既往研究报道一致[12]。OEM中Visfatin高表达的机制与OEM炎症微环境中炎症因子的作用有关。有学者发现,促炎性细胞因子如IL-6和Toll样受体的激活能够显著上调Visfatin的表达[18]。此外,ASRM分期Ⅲ~Ⅳ期的OEM患者血清Visfatin水平较高,提示Visfatin可促进OEM的发生、发展。有研究发现,Visfatin能够诱导核因子kappa B的转录,进而激活下游促炎性细胞因子肿瘤坏死因子α和基质金属蛋白酶2的表达,导致局部炎症程度加重,促进异位内膜组织的浸润深度,导致ASRM分期进展[19]。本研究中,Visfatin水平升高是OEM患者术后复发的危险因素,表明Visfatin有助于评估OEM患者的预后。有学者发现,Visfatin能够通过促进转录因子Snail-1的表达,促进细胞间质性标志N型钙黏素的表达,抑制E-钙黏素的表达,促进异位内膜细胞的迁移和侵袭能力[20]。此外,Visfatin高表达的患者OEM分期较高,术中病灶难以彻底清除,术中残留风险较大,从而增加术后复发风险。本研究发现,血清Vaspin、Visfatin联合检测对OEM患者术后OEM复发有较高的预测效能,联合检测的灵敏度及特异度分别为0.807、0.853。临床中,医生可以对不同复发风险的OEM患者采取个体化治疗方案和随访方案,以减少疾病复发和患者的痛苦。
综上所述,OEM患者Vaspin水平降低,Visfatin水平升高,两者与OEM患者ASRM分期有关,是OEM患者术后复发的独立危险因素。Vaspin低表达和Visfatin高表达的OEM患者无复发生存情况较差,血清Vaspin、Visfatin联合检测对OEM患者术后复发具有较高的预测效能。但本研究样本量有限,未能对治疗前后Vaspin、Visfatin的动态变化进行监测,有待今后扩大样本量深入研究两者的临床应用价值。

