Act1 对高糖诱导肾小管上皮细胞炎症反应及细胞外基质表达的调控作用
赵瑞玲 林彩霞
1 广州市越秀区儿童医院 (广州 510000)
2 广东药科大学 (广州 510000)
糖尿病肾病是常见的糖尿病微血管并发症之一,也是我国导致终末期肾脏病的常见病因。血糖控制不佳、糖尿病病程长是糖尿病肾病发病的相关因素,肾小球内皮细胞、肾小管上皮细胞在高糖环境下发生损伤是与糖尿病肾病发生发展密切相关的生物学环节[1-2]。有研究报道,肾小管上皮细胞在高糖环境下发生转分化对糖尿病肾病发病过程中的肾脏纤维化、肾功能损害具有促进作用,转分化过程涉及炎症反应激活、细胞外基质沉积[3-4]。核因子-κB激活剂1(NF-κB activator 1,Act1)是近些年新发现的炎症调控基因,该基因表达的蛋白能够在胞浆中介导炎症信号的传导、促进下游NF-κB活化并激活炎症反应。为深入认识Act1介导的炎症反应在糖尿病肾病发生发展中的作用[5],本研究通过细胞实验观察了Act1对高糖诱导肾小管上皮细胞炎症反应及细胞外基质表达的调控作用。
1 材料与方法
1.1 材料
肾小管上皮细胞株MK2购自中科院上海细胞资源中心,阴性对照(negative control,NC)siRNA、Act1 siRNA购自上海吉玛生物科技公司,总RNA提取试剂盒、cDNA第一链合成试剂盒、荧光定量检测试剂盒购自北京天根生化科技公司,Act1、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、I型胶原(type I collagen,Col-I)、III型胶原(type III collagen,Col-III)的特异性一抗购自美国Abcam公司,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、干扰素-γ(interferon-γ,IFN-γ)的酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海酶联生物科技公司。
1.2 方法
1.2.1 细胞培养 MK2细胞复苏后在含有10%胎牛血清的RPMI1640培养基中贴壁培养,每2天更换1次培养液,当细胞密度达到约80%时用0.25%胰蛋白酶进行消化,然后收集细胞、按照1∶3比例传代培养。
1.2.2 细胞分组处理 传代后的MK2细胞按照1×106个/孔的密度接种在12孔板中,贴壁24 h后进行分组处理。对照组用含有5.5 mmol/L葡萄糖的常规RPMI1640培养基处理,高糖组用含有30 mmol/L葡萄糖的RPMI1640培养基处理,每组处理12 h、24 h、48 h、72 h;si-NC在常规RPMI1640培养基中转染NC siRNA,si-NC+高糖组在含有30 mmol/L葡萄糖的RPMI1640培养基中转染NC siRNA,si-Act1在含有30 mmol/L葡萄糖的RPMI1640培养基中转染Act1 siRNA,每组连续处理48 h。
1.2.3 细胞中基因mRNA表达水平的检测 取处理后的MK2细胞,使用细胞总RNA提取试剂盒分离提取细胞中的总RNA,采用cDNA第一链合成试剂盒将总RNA反转录为cDNA,使用荧光定量检测试剂盒对cDNA中Act1、E-cadherin、N-cadherin、Col-I、Col-III的mRNA表达进行检测,按照试剂盒说明书配置PCR反应体系、设置PCR反应程序,以β-Tubulin为内参,计算Act1、E-cadherin、N-cadherin、Col-I、Col-III的mRNA相对表达水平。
1.2.4 细胞中蛋白表达水平的检测 取处理后的MK2细胞,加入裂解液并在冰上裂解细胞、提取细胞蛋白,采用BCA法检测蛋白浓度,将30 μg蛋白样本用于检测,在聚丙烯酰胺凝胶电泳后电转移至硝酸纤维素膜,5%脱脂牛奶室温封闭1 h,4 ℃孵育Act1一抗(1∶400稀释)、E-cadherin一抗(1∶600稀释)、N-cadherin一抗(1∶500稀释)、Col-I一抗(1∶1 000稀释)、Col-III一抗(1∶1 000稀释)、β-Tubulin一抗(1∶5 000稀释)过夜。次日,洗膜3次后室温孵育辣根过氧化物酶二抗(1∶5 000稀释)1 h,最后在凝胶成像系统中通过化学发光得到Act1、E-cadherin、N-cadherin、Col-I、Col-III、β-Tubulin的条带,根据蛋白条带灰度值,以β-Tubulin为内参计算Act1、E-cadherin、N-cadherin、Col-I、Col-III的蛋白相对表达水平。
1.2.5 细胞培养基中细胞因子含量的检测 取处理后的MK2细胞培养基,采用ELISA试剂盒检测TNF-α、IL-1β、IFN-γ的含量。按照试剂盒说明书进行操作。
1.3 统计学处理
采用SPSS 23.0版本的软件进行统计学处理,实验数据均为计量资料、以均数±标准差表示,2组间比较采用独立样本t检验,3组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 高糖对MK2细胞中Act1表达的影响
处理12 h、24 h、48 h、72 h时,与对照组比较,高糖组MK2细胞中Act1的mRNA相对表达水平和蛋白相对表达水平均增加(P<0.05);高糖组内不同时间点比较,处理12 h、24 h、48 h时Act1的mRNA相对表达水平和蛋白相对表达水平均随处理时间延长而增加,处理72 h时Act1的mRNA相对表达水平和蛋白相对表达水平与处理48 h比较无差异(P>0.05)。因此后续选择处理48 h研究Act1的生物学功能。

表1 对照组与高糖组不同时间点MK2细胞中Act1 mRNA相对表达水平的比较 n=5
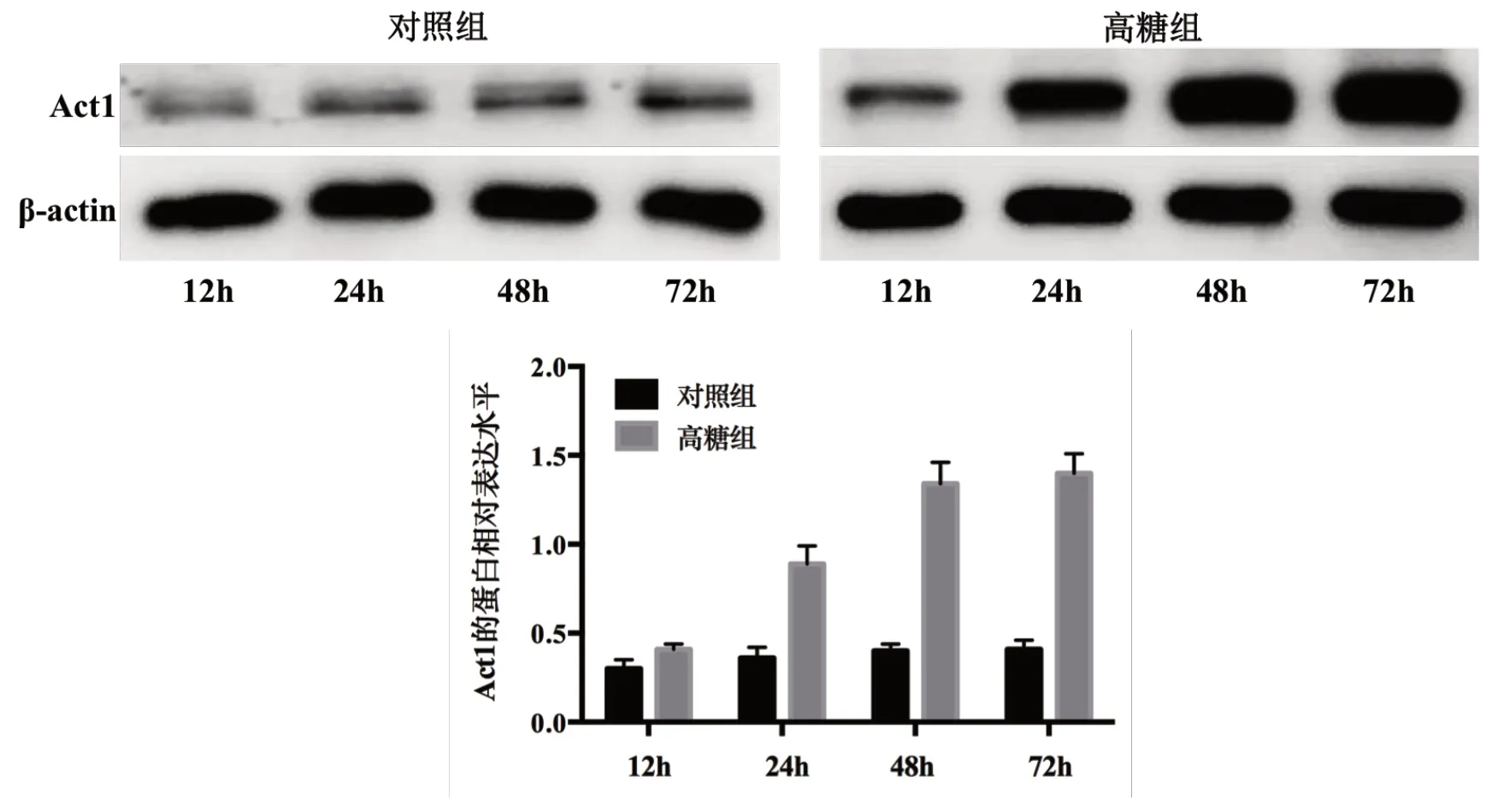
图1 对照组与高糖组不同时间点MK2 细胞中Act1 蛋白相对表达水平的比较

图2 MK2 细胞中Act1 的蛋白条带图

图3 3 组MK2 细胞中E-cadherin、N-cadherin 蛋白表达水平的比较
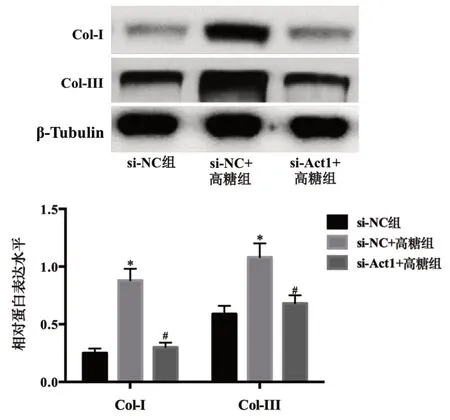
图4 3 组MK2 细胞中E-cadherin、N-cadherin 蛋白表达水平的比较
2.2 常规葡萄糖和高糖环境下转染Act1 siRNA对MK2细胞中Act1表达的影响
在常规葡萄糖环境下进行siRNA转染,处理48 h时,si-NC组与si-Act1组MK2细胞中Act1的mRNA相对表达水平和蛋白相对表达水平比较,差异无统计学意义(P<0.05)。见表2。
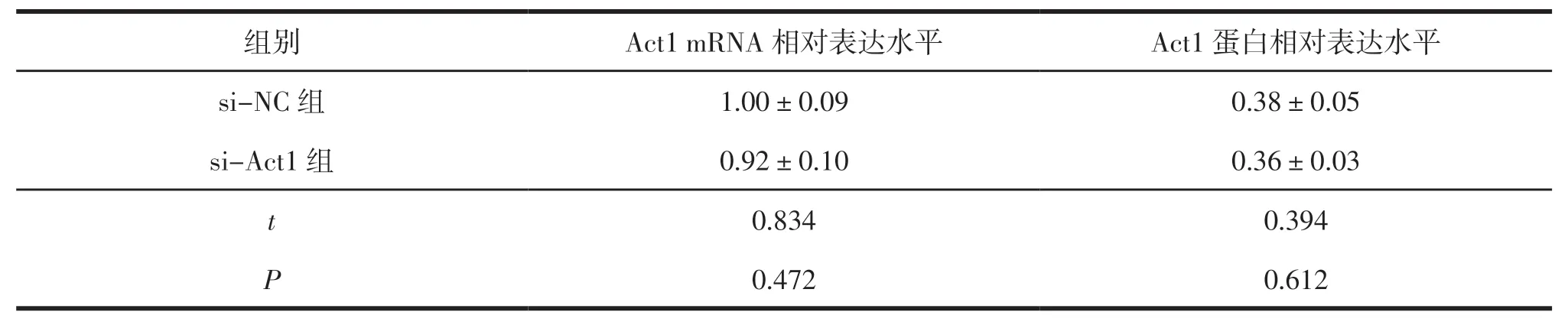
表2 si-NC组与si-NC+高糖组MK2细胞中Act1 mRNA和蛋白相对表达水平的比较 n=5
在高糖环境下进行siRNA转染,处理48 h时,与si-NC组比较,si-NC+高糖组MK2细胞中Act1的mRNA相对表达水平和蛋白相对表达水平均明显增加(P<0.05);与si-NC+高糖组比较,si-Act1+高糖组MK2细胞中Act1的mRNA相对表达水平和蛋白相对表达水平均明显降低(P<0.05)。表3。

表3 3组MK2细胞中Act1 mRNA和蛋白相对表达水平的比较 n=5
2.3 敲低Act1对高糖处理MK2细胞中炎症细胞因子含量的影响
处理48 h时,与si-NC组比较,si-NC+高糖组MK2细胞培养基中TNF-α、IL-1β、IFN-γ的含量均增加(P<0.05);与si-NC+高糖组比较,si-Act1+高糖组MK2细胞培养基中TNF-α、IL-1β、IFN-γ的含量均降低(P<0.05)。表4。
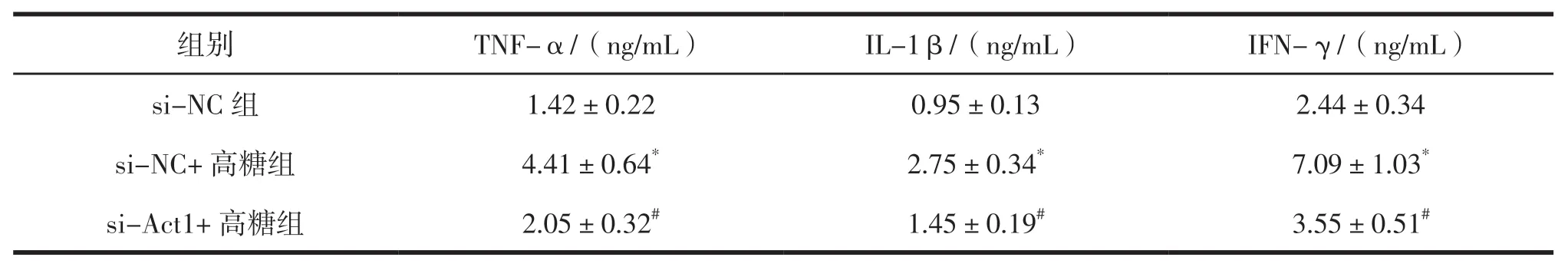
表4 3组MK2细胞培养基中TNF-α、IL-1β、IFN-γ含量的比较 n=5
2.4 敲低Act1对高糖处理MK2细胞中EMT基因表达的影响
处理48 h时,与si-NC组比较,si-NC+高糖组MK2细胞中E-cadherin的mRNA相对表达水平和蛋白相对表达水平均降低,N-cadherin的mRNA相对表达水平和蛋白相对表达水平均增加(P<0.05);与si-NC+高糖组比较,si-Act1+高糖组MK2细胞中E-cadherin的mRNA相对表达水平和蛋白相对表达水平均增加,N-cadherin的mRNA相对表达水平和蛋白相对表达水平均降低(P<0.05)。见表5。

表5 3组MK2细胞中E-cadherin、N-cadherin mRNA表达水平的比较 n=5
2.5 敲低Act1对高糖处理MK2细胞中Col-I、Col-III表达的影响
处理48 h时,与si-NC组比较,si-NC+高糖组MK2细胞中Col-I、Col-III的mRNA相对表达水平和蛋白相对表达水平均增加(P<0.05);与si-NC+高糖组比较,si-Act1+高糖组MK2细胞中Col-I、Col-III的mRNA相对表达水平和蛋白相对表达水平均降低(P<0.05)。见表6。
3 讨 论
肾间质纤维化是糖尿病肾病发生发展过程中重要的病理特征之一,表现为肾小球细胞外基质聚积,最终对肾脏结构和功能造成不可逆损害[6-7]。高糖作用于肾脏、刺激肾小管上皮细胞转分化与肾间质纤维化的发生密切相关。肾小管上皮细胞转分化的过程涉及炎症反应的激活、过度的上皮间质转化、细胞外基质的过度合成和聚积等生物学环节[8-10],但调控上述生物学环节的机制尚不十分清楚。
Act1是近些年新发现的炎症调控基因,编码产物具有多个炎症反应调控结构域,在炎症性肠病、类风湿性关节炎、肺部感染等疾病中通过与多种TRAF蛋白结合的方式促进下游NF-κB活化、启动多种炎症基因表达、促进炎症反应激活[11-12]。为认识Act1在糖尿病肾病发生发展中的作用,本研究首先在高糖处理的肾小管上皮细胞中观察了Act1表达的变化,高糖处理后各个时间点细胞中Act1的mRNA和蛋白表达均明显增加,表明Act1高表达可能参与糖尿病肾病的发生以及高糖诱导的肾小管上皮细胞转分化。
肾小管上皮细胞中Act1在高糖诱导下表达增加的趋势具有时间依赖性并且Act1表达增加在高糖处理48 h时达到峰值,随着处理时间延长至72 h、Act1的表达水平未进一步增加。因此,选择高糖处理48 h的时间点进行Act1生物学功能的研究。为了验证高糖环境下肾小管上皮细胞中Act1表达增加的生物学意义,本研究通过转染siRNA手段在高糖环境下敲低Act1的表达,而后观察肾间质纤维化过程中肾小管转分化相关的炎症反应激活、细胞外基质聚集等环节的变化。
高糖作用于肾小管上皮细胞能够激活炎症反应、促进细胞外基质合成。炎症反应激活的过程涉及TNF-α、IL-1β、IFN-γ等多种促炎细胞因子的大量释放[13-15];细胞外基质合成的过程中涉及细胞的上皮间质转化以及胶原的表达增加[16-17]。本研究在高糖处理的肾小管上皮细胞中检测到TNF-α、IL-1β、IFN-γ含量以及N-cadherin、Col-I、Col-III表达增加,E-cadherin表达降低,与既往糖尿病肾病发病过程中间质纤维化的研究结果吻合。在高糖环境下敲低Act1后,细胞中TNF-α、IL-1β、IFN-γ含量以及N-cadherin、Col-I、Col-III表达降低,E-cadherin表达增加,表明Act1参与高糖诱导肾小管上皮细胞炎症反应激活、细胞外基质表达增加。
综上所述,高糖促进肾小管上皮细胞中Act1的表达;Act1表达增加对高糖诱导肾小管上皮细胞炎症反应激活和细胞外基质增多具有促进作用。

