瘤背石璜来源真菌Penicillium sclerotiorum GZU-XW03-2 液体发酵产物的化学成分研究
卢淇平,赵敏,崔辉,赵钟祥(广州中医药大学中药学院,广东 广州 510006)
从天然产物中发现潜在药物分子是创新药物研制的重要方式之一。海洋因其独特的生态环境,孕育着丰富的生物资源。自2008 年以来,新发现的海洋天然产物数量每年均超过1 000 个[1],这些化合物结构新颖,而且具有广泛而显著的生物活性[2]。20 世纪60 年代头孢菌素C 被成功开发上市,作为海洋天然产物重要来源之一的海洋真菌次级代谢产物,逐渐引起了科学界的重视。青霉属真菌(Penicilliumsp.)广泛分布于自然界[3],可代谢产生结构多样且具有如抗肿瘤、抗炎、酶抑制作用等[4-6]生物活性的次级代谢产物,现已成为发掘活性化合物最具潜力的菌属之一。
本课题组[7-9]从广东徐闻海域的石磺科(Onchidiidae)石 磺 属(Onchidium)动 物 瘤 背 石 磺(Onchidium struma)的肠道内获得一株青霉属真菌Penicillium sclerotiorumGZU-XW03-2,在前期的研究中,已经从该真菌大米固体发酵产物中分离得到30 余个35-二甲基苔色酸(DMOA)途径衍生合成的杂萜类化合物和一些聚酮类化合物,药理活性筛选中发现其中一些杂萜化合物表现出强于阳性药吲哚美辛的NO 释放抑制活性,为先导化合物的筛选提供了科学依据。
为了探究不同培养条件对真菌代谢产物多样性的影响,我们对真菌Penicillium sclerotiorumGZUXW03-2 的液体发酵产物进行了研究,从其乙酸乙酯部位分离得到8 个聚酮类化合物(图1),通过理化性质和现代波谱技术结合文献对比分别鉴定为peniazaphilone J(1)、5-chloroisorotiorin(2)、(+)-sclerotiorin(3)、deacetylsclerotiorin(4)、isochromophiloneⅢ(5)、penazaphilone E(6)、2,4-dihyroxy-6-(5,7-dimethyl-2-oxo-trans-3-trans-5-nonadienyl)-3-methylbenzaldehyde(7)、6-((1E,3E)-35-dimethylhepta-13-dien-1-yl)-2,4-dihydroxy-3-methylbenzaldehyde(8)。其中化合物1 为新的嗜氮酮类化合物,化合物2~8 为首次从该真菌中分离得到。
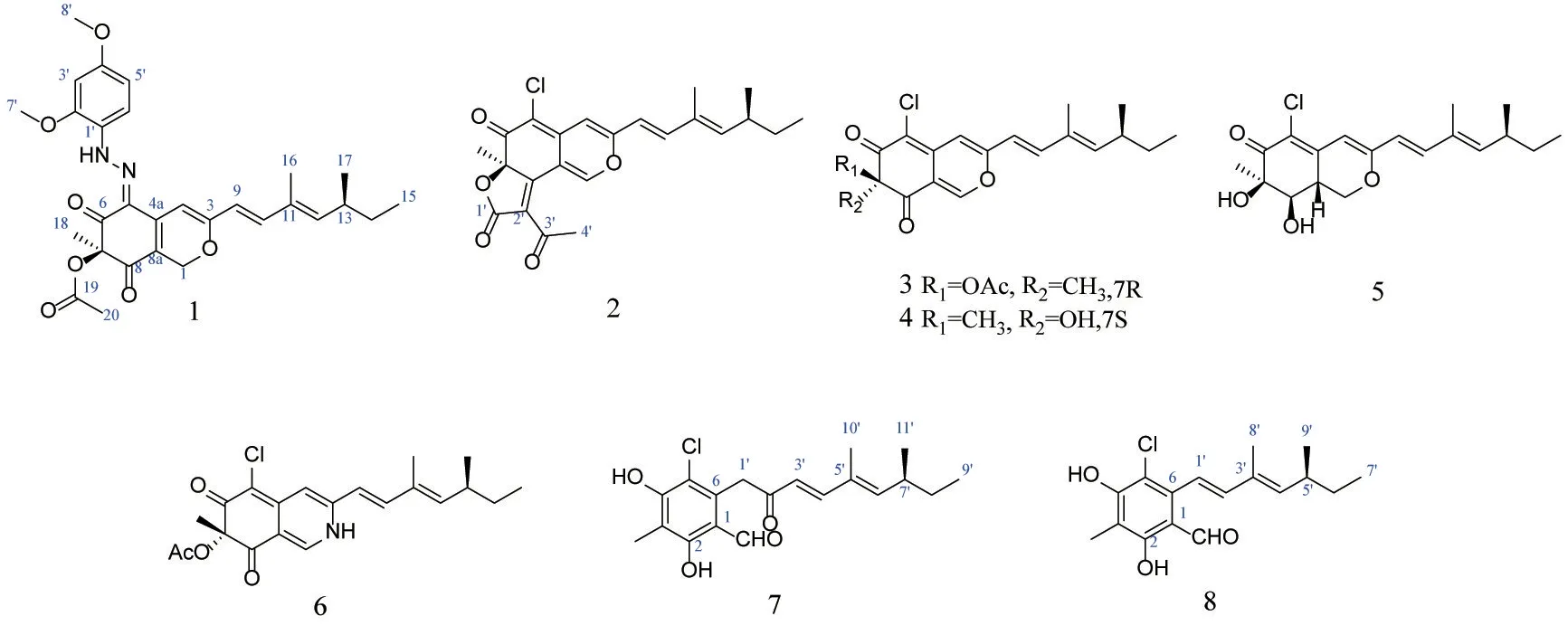
图1 聚酮类化合物1~8 的化学结构Figure 1 Chemical structures of compounds 1-8
1 仪器与材料
Bruker AVANCE400 超导核磁共振仪,瑞士布鲁克公司;AB SCIEX Triple TOFTM5600+四级杆-飞行时间串联质谱,美国AB 质谱公司;Bruker Tensor-27红外分光光度计,德国布鲁克公司;Chirascan 圆二色谱仪,英国应用光物理公司;POLARTRONIC HH W5 旋光仪,德国SCHMIDT+HAENSCH 公司;LC-100 半制备液相色谱仪,上海伍丰科学仪器有限公司;IKA-RU8 旋转蒸发仪,IKA 仪器设备有限公司;SW-CJ-2F 单人单面超净台,南京贝登电子商务有限公司;HZP-250 恒温培养摇床,上海精宏实验设备有限公司;SQ5 10C 高压灭菌锅,深圳市塞亚泰克仪器设备公司。
柱层析硅胶(100~200 目、200~300 目),青岛海洋化工厂;GF254 硅胶薄层板,德国默克公司;Sephadex LH-20 葡聚糖凝胶,日本GE 医疗集团;RP-C18硅胶,日本春日井富士硅业有限公司;色谱甲醇,北京迈瑞达科技有限公司;分析纯石油醚、乙酸乙酯、氯仿、甲醇,天津致远试剂公司。
菌株采集于广东徐闻海域的瘤背石璜Onchidium struma的胃肠道中,根据ITS 序列与BLAST 序列比对,鉴定该菌种为Penicillium sclerotiorum(GenBank:MT071304),菌种样品保存于广州中医药大学中药学院(菌种编号:2018-GZU-XW03-2)。
2 提取与分离
菌株液体发酵完成后,以纱布过滤发酵液,分离得到菌丝和滤液。菌丝体经甲醇浸泡超声提取3 次后,减压回收溶剂至无醇味得粗提物浸膏,浸膏加水分散,用乙酸乙酯等体积萃取得到中等极性部位浸膏。菌液减压浓缩后用等体积乙酸乙酯萃取3 次,与菌丝体乙酸乙酯部位合并得总乙酸乙酯浸膏90.0 g。乙酸乙酯浸膏经硅胶柱层析初步分离,经过石油醚-乙酸乙酯(100∶1→0∶1)体系进行梯度洗脱,TLC 分析合并得到3 个粗组分(Fr.A→C)。Fr. B 中析出黄色粉末,为化合物3(30.3 g)。Fr. A 经过ODS柱层析甲醇-水(40∶60→60∶40)梯度洗脱,得化合物1(6.4 mg)、化合物7(7.3 mg)和Fr.A-1。Fr.A-1 经Sephadex LH-20 柱色谱分离,二氯甲烷-甲醇(1∶1)洗脱得化合物5(14.9 mg)和化合物6(24.1 mg)。Fr.C 经过正相硅胶柱色谱二氯甲烷-甲醇(100∶1→20∶1)体系梯度洗脱以及半制备HPLC(80% 甲醇-水)分离纯化得到化合物4(14.6 mg)、化合物2(33.0 mg)和化合物8(3.9 mg)。
3 结构鉴定

1H-NMR 数据显示低场区存在1 个活泼氢信号δH14.46,7 个芳香质子δH7.71,6.99,6.60,6.52,6.32,6.09,5.60,2 个被氧化的亚甲基质子δH5.20,4.91,2 个甲氧基δH3.94,3.84。13C-NMR 数据提示结构中共29 个碳信号,结合DEPT-135 谱分析可知,包括11 个季碳信号(包括2 个羰基碳信号,1 个乙酰基羰基碳信号,7 个芳香碳信号和1 个sp3杂化的季碳信号),9 个次甲基信号,2 个亚甲基,2 个甲氧基信号,1 个乙酰基甲基和4 个甲基碳信号。以上数据与已知嗜氮酮类化合物peniazaphilone B[10]大体相似。
对化合物1 核磁数据进行全归属(见表1),与peniazaphilone B 比较差别较大的核磁数据发现,化合物1 中缺少1 个芳香次甲基,而存在1 个被氧化的亚甲基信号(δH5.20,4.91;δC64.2),推测Δ1,2被饱和,且2 号位为氧原子。在异核多键相关(HMBC)谱信号中,H-1 与C-3/C-4a/C-8a/C-8 相关,结合peniazaphilone B 分子式(C29H33N3O6)和化合物1 分子式(C29H34N2O7),证实是1 号位被饱和,且2 号位为氧原子取代的推测。其余部分与peniazaphilone B 相同,以上数据阐明了化合物1 的平面结构,其1H-1H COSY 同核化学位移相关谱(1H-1H COSY)及HMBC 信号见图2。

表1 化合物1 的1H-NMR(400 MHz,CDCl3)和13C-NMR(100 MHz,CDCl3)数据归属Table 11H-NMR(400 MHz,CDCl3)and13C-NMR(100 MHz,CDCl3)data of compound 1
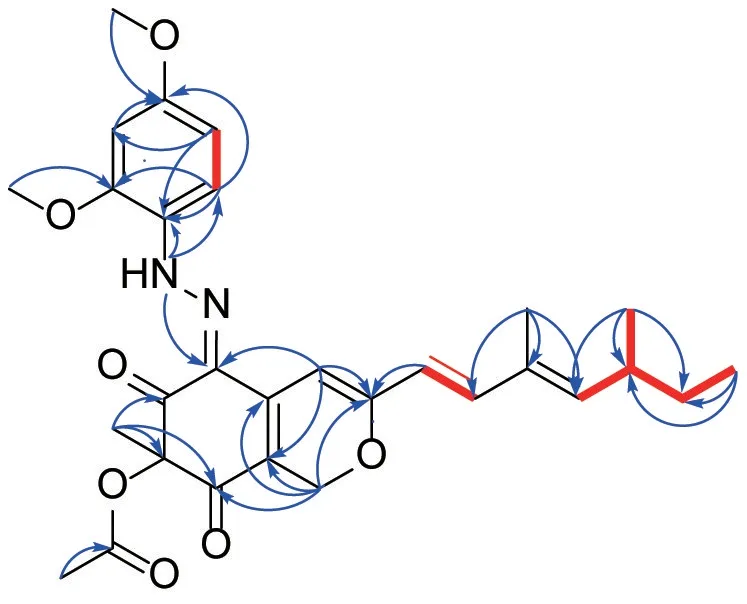
图2 化合物1 的1H-1H COSY、HMBC 信号Figure 2 Key 1H-1H COSY,HMBC correlations of compound 1
据该类化合物的相关文献报道[10], CH3-17 位均为β 构型,考虑到它们生源合成途径相同,故将化合物1 的CH3-17 暂定为β 构型。在NOE 增强谱中,C-7 和C-13 处两个手性中心相距较远,无法进行CH3-18 处相对构型判断。化合物1 的实验ECD 光谱(见图3)与文献报道化合物peniazaphilone B 的ECD谱线比较,二者在相同波长范围内具有相同的Cotton效应,故推断化合物1 的绝对构型为7R,13S。最终,将化合物1 命名为peniazaphilone J。
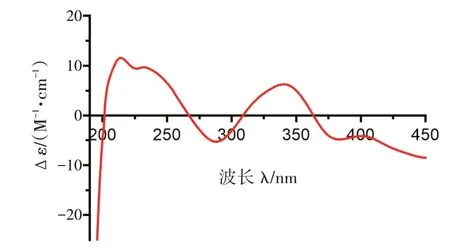
图3 化合物1 的实验ECD 光谱Figure 3 Experimental ECD spectrum of compound 1
化合物 2:酒红色固体。HR-ESI-MSm/z:415.130 1[M+H]+(计算值C23H23O5Cl,415.130 6)。1HNMR(400 MHz,CDCl3)δ:8.82(1H,s,H-1),7.11(1H,d,J= 15.6 Hz,H-10),6.60(1H,s,H-4),6.08(1H,d,J= 15.6 Hz,H-9),5.72(1H,d,J= 9.8 Hz,H-12),2.58(1H,s,H-4′),2.46(H,m,H-13),1.83(3H,s,CH3-16),1.70(3H,s,CH3-18),1.42(1H,m,H-14a),1.29(1H,m,H-14b),1.00(3H,d,J= 6.6 Hz,CH3-17),0.86(3H,t,J= 7.4 Hz,CH3-15);13C-NMR(100 MHz,CDCl3)δ:194.3(C-6),183.2(C-3′),168.0(C-1′),163.9(C-8),158.2(C-3),152.2(C-1),149.5(C-12),143.7(C-10),139.8(C-4a),132.1(C-11),123.8(C-2′),115.7(C-9),110.3(C-5),108.6(C-8a),105.7(C-4),87.6(C-7),35.2(C-13),30.1(C-14),30.1(C-4′),26.4(C-18),20.2(C-17),12.4(C-16),12.0(C-15)。以上数据与文献报道[11]基本一致,故鉴定化合物2 为5-chloroisorotiorin。
化 合 物 3: 黄 色 粉 末。 HR-ESI-MSm/z:391.099 8[M+H]+(计算值C21H23O5Cl,391.123 4)。1HNMR(400 MHz,CDCl3)δ:7.91(1H,s,H-1),7.04(1H,d,J= 15.7 Hz,H-10),6.62(1H,s,H-4),6.06(1H,d,J= 15.7 Hz,H-9),5.61(1H,d,J= 9.8 Hz,H-12),2.46(1H,m,H-13),2.15(1H,s,H-20),1.82(3H,s,CH3-16),1.55(3H,s,CH3-18),1.42(1H,m,H-14a),1.30(1H,m,H-14b),0.99(3H,d,J=6.6 Hz,CH3-17),0.84(3H,t,J= 7.4 Hz,CH3-15);13C-NMR(100 MHz,CDCl3)δ:191.8(C-6),186.0(C-8),170.1(C-19),158.2(C-3),152.7(C-1),148.9(C-12),142.9(C-10),138.8(C-4a),132.1(C-11),115.8(C-9),114.6(C-5),110.8(C-8a),106.4(C-4),84.7(C-7),35.2(C-13),30.1(C-14),22.6(C-18),20.6(C-20),20.1(C-17),12.4(C-16),12.0(C-15)。以上数据与文献报道[12]基本一致,因此,确定化合物3 为(+)-sclerotiorin。
化 合 物 4: 橙 色 粉 末。 HR-ESI-MSm/z:349.449 9[M+H]+(计算值C19H21O4Cl,349.120 1)。1HNMR(400 MHz,CDCl3)δ:7.93(1H,s,H-1),7.09(1H,d,J= 15.7 Hz,H-10),6.62(1H,s,H-4),6.08(1H,d,J= 15.7 Hz,H-9),5.73(1H,d,J= 9.8 Hz,H-12),2.48(H,m,H-13),1.85(3H,s,CH3-16),1.58(3H,s,CH3-18),1.43(1H,m,H-14a),1.33(1H,m,H-14b),1.01(3H,d,J= 6.6 Hz,CH3-17),0.86(3H,t,J= 7.4 Hz,CH3-15);13C-NMR(100 MHz,CDCl3)δ:194.1(C-8),189.8(C-6),158.7(C-3),151.8(C-1),149.5(C-12),143.5(C-4a),140.1(C-10),132.1(C-11),115.7(C-9),115.3(C-8a),109.1(C-5),106.1(C-4),84.0(C-7),35.3(C-13),30.2(C-14),28.9(C-18),20.3(C-17),12.5(C-16),12.1(C-15)。以上数据与文献报道[13]基本一致,故鉴定化合物4 为deacetylsclerotiorin。
化 合 物 5: 橙 色 粉 末。 HR-ESI-MSm/z:353.151 1[M+H]+(计算值C19H25O4Cl,353.151 4)。1HNMR(400 MHz,CDCl3)δ:7.01(1H,d,J= 15.5 Hz,H-10),6.09(1H,s,H-4),5.99(1H,d,J= 15.5 Hz,H-9),5.63(1H,d,J= 9.8 Hz,H-12),4.85(1H,dd,J= 10.9,5.2 Hz,H-1a),3.81(1H,dd,J= 13.6,10.9 Hz,H-1b),3.46(1H,d,J= 9.6 Hz,H-8),3.12(1H,m,H-8a),2.44(1H,m,H-13),1.81(3H,s,CH3-16),1.55(3H,s,CH3-18),1.42(1H,m,H-14a),1.30(1H,m,H-14b),0.99(3H,d,J = 6.6 Hz,CH3-17),0.84(3H,t,J= 7.4 Hz,CH3-15);13CNMR(100 MHz,CDCl3)δ:189.2(C-6),164.2(C-3),147.4(C-12),146.7(C-4a),142.2(C-10),132.4(C-11),119.2(C-9),108.3(C-5),101.8(C-4),75.1(C-7),73.5(C-8),68.9(C-1),37.8(C-8a),35.1(C-13),30.3(C-14),21.3(C-18),20.4(C-17),12.5(C-16),12.1(C-15)。以上数据与文献报道[14]基本一致,故鉴定化合物5 为isochromophiloneⅢ。
化合物 6:酒红色粉末。HR-ESI-MSm/z:390.146 7[M+H]+(计算值C21H24NO4Cl,390.146 6)。1HNMR(400 MHz,CDCl3)δ:8.08(1H,s,H-1),7.20(1H,d,J= 16.1 Hz,H-10),6.99(1H,s,H-4),6.25(1H,d,J= 16.1 Hz,H-9),5.74(1H,d,J= 9.7 Hz,H-12),2.46(1H,m,H-13),2.14(1H,s,H-20),1.85(3H,s,CH3-16),1.59(3H,s,CH3-18),1.41(1H,m,H-14a),1.29(1H,m,H-14b),1.00(3H,d,J = 6.6 Hz,CH3-17),0.85(3H,t,J= 7.4 Hz,CH3-15);13CNMR(100 MHz,CDCl3)δ:193.4(C-6),183.8(C-6),170.5(C-19),148.9(C-12),148.3(C-4a),147.2(C-3),143.5(C-10),139.0(C-1),132.2(C-11),116.7(C-9),114.8(C-8a),110.9(C-4),101.0(C-5),85.1(C-7),35.2(C-13),30.2(C-14),23.8(C-18),20.6(C-20),20.3(C-17),12.5(C-16),12.1(C-15)。以上数据与文献报道[15]基本一致,故鉴定化合物6 为penazaphilone E。
化合物 7:黑褐色固体。HR-ESI-MSm/z:315.160 4 [M+H]+(计算值C19H24O4,315.159 0)。1HNMR(400 MHz,CDCl3)δ:12.58(1H,s,H-2),9.81(1H,s,1-CHO),7.35(1H,d,J= 15.6 Hz,H-4′),6.19(1H,d,J= 15.6 Hz,H-3′),6.12(1H,s,H-5),5.82(1H,d,J= 9.8 Hz,H-6′),4.06(2H,s,H-1′),2.47(1H,m,H-7′),2.00(3H,s,CH3-3),1.79(3H,s,CH3-10′),1.37(2H,m,H-8′),0.99(3H,d,J= 6.6 Hz,CH3-11′),0.84(3H,t,J= 7.4 Hz,CH3-9′);13C-NMR(100 MHz, CDCl3)δ: 198.3(C-2′), 192.5(1-CHO),164.5(C-2),162.3(C-4),152.4(C-4′),151.0(C-6′),137.2(C-6),132.0(C-5′),122.4(C-3′),111.5(C-5),112.7(C-3),111.1(C-1),43.8(C-1′),35.4(C-7′),30.0(C-8′),20.1(C-10′),12.5(C-11′),12.0(C-9′),7.1(CH3-3)。以上数据与文献报道[16]基本一致,故鉴定化合物7 为2,4-dihyroxy-6-(5,7-dimethyl-2-oxo-trans-3-trans-5-nonadienyl)-3-methylbenzaldehyde。
化合物 8:浅黄色粉末。HR-ESI-MSm/z:275.163 9 [M+H]+(计算值C17H22O3,275.164 1)。1HNMR(400 MHz,CDCl3)δ:12.66(1H,s,H-2),10.15(1H,s,1-CHO),6.81(1H,d,J=15.7 Hz,H-1′),6.62(1H,d,J = 15.7 Hz,H-2′),6.46(1H,s,H-5),5.56(1H,s,H-4),5.46(1H,d,J= 9.6 Hz,H-4′),2.46(1H,m,H-5′),2.11(3H,s,CH3-3),1.87(3H,s,CH3-8′),1.41(1H,m,H-6′a),1.33(1H,m,H-6′b),1.00(3H,d,J= 6.7 Hz,CH3-9′),0.87(3H,t,J=7.4 Hz,CH3-7′);13C-NMR(100 MHz,CDCl3)δ:193.2(1-CHO),163.6(C-2),163.6(C-6),160.8(C-4),143.3(C-4′),140.6(C-2′),132.2(C-3′),119.3(C-1′),112.1(C-1),109.7(C-3),105.9(C-5),34.7(C-5′),30.3(C-6′),20.5(C-9′),12.7(C-8′),12.0(C-7′),7.1(CH3-3)。以上数据与文献报道[17]基本一致,故鉴定化合物8 为6-((1E,3E)-3,5-dimethylhepta-1,3-dien-1-yl)-2,4-dihydroxy-3-methylbenzaldehyde。
4 讨论
本研究对采自中国南海湛江徐闻海域的瘤背石璜胃肠道中提取得到的一株真菌Penicillium sclerotiorumGZU-XW03-2 进行液体发酵培养,对发酵物甲醇提取物的乙酸乙酯部位进行分离纯化,从中分离并鉴定了8 个聚酮类化合物,其中新化合物1为罕见的具有氮-氮键的聚酮类化合物。本研究发现,该真菌液体发酵后代谢产物类型主要为聚酮类化合物,与大米固体发酵产物中发现的众多杂萜类化合物相比,产物类型存在较大差异。以上研究成果丰富了青霉属真菌的化学成分,为该属真菌的进一步开发利用提供了参考。

