直接稀释结合UPLC-MS/MS测定贻贝中3种微囊藻毒素
黄连琴 谢范英 卢宗桂 陈巧 林丽容 宁晨 赵馨 王兴进
摘 要:為建立一种快捷、有效的定量测定贻贝等双壳贝类中微囊藻毒素MC-LR、MC-YR和MC-RR的方法,以贻贝为研究对象,通过优化提取溶剂、提取溶剂浓度、稀释倍数等因素,最终建立直接稀释结合超高效液相色谱—串联质谱测定贻贝中3种微囊藻毒素MC-LR、MC-YR和MC-RR含量的分析确证方法。结果表明:贻贝中的3种毒素测定方法为,用90%甲醇水溶液提取,提取液经0.5%乙酸甲醇溶液稀释,稀释液直接用超高效液相色谱—串联质谱测定。该方法的检出限为5 μg·kg-1,定量限为15 μg·kg-1。在贻贝中添加15、30、150 μg·kg-1微囊藻毒素混合标准品进行加标回收试验,3种微囊藻毒素MC-LR、MC-RR和MC-YR的回收率分别为89.4%~91.8%、77.1%~106.3%、75.8%~102.3%,相对标准偏差RSD分别为3.5%~13.5%、5.6%~9.2%、4.5%~8.1%(n=6)。该测定方法简单、快捷、成本低、操作性强,能够满足当前批量定量检测贻贝中3种微囊藻毒素的技术要求。
关键词:微囊藻毒素;贻贝;直接稀释;UPLC-MS/MS
中图分类号:TS 254.7 文献标志码:A 文章编号:0253-2301(2023)04-0036-06
DOI: 10.13651/j.cnki.fjnykj.2023.04.005
Determination of Three Microcystins in Mussels by Direct Dilution Combined with UPLC-MS/MS
HUANG Lian-qin, XIE Fan-ying, LU Zong-gui, CHEN Qiao, LIN Li-rong, NING Chen, ZHAO Xin, WANG Xing-jin
(Ningde Institute of Product Quality Inspection, Ningde, Fujian 352100, China)
Abstract: In order to establish a rapid and effective method for the quantitative determination of microcystins (MC-LR, MC-YR and MC-RR) in bivalves such as mussels, by taking the mussels as the research object and optimizing the factors such as the extracting solvent, the concentration of extracting solvent, and dilution ratio, etc., a method for the determination of three microcystins (MC-LR, MC-YR and MC-RR) in mussels was established by using the direct dilution combined with ultra-high performance liquid chromatography-tandem mass spectrometry. The results showed that: the determination method of three toxins in mussels was as follows: after being extracted with 90% methanol aqueous solution, the extract fluid was diluted with 0.5% acetic acid methanol solution, and the diluent was directly determined by ultra-high performance liquid chromatography-tandem mass spectrometry. The limit of detection (LOD) was 5 μg·kg-1 and the limit of quantification (LOQ) was 15 μg·kg-1. The mixed standard substance of 15, 30, and 150 μg·kg-1 microcystins was added to mussels for the spiked recovery test, and the recovery rates of three microcystins (MC-LR, MC-RR and MC-YR) were 89.4%-91.8%, 77.1%-106.3%, and 75.8%-102.3%, respectively. The relative standard deviations were 3.5%-13.5%, 5.6%-9.2%, and 4.5%-8.1% (n=6), respectively. The determination method was simple and fast, with low cost and strong operability, which could meet the technical requirements of the current batch quantitative detection of three microcystins in mussels.
Key words: Microcystins; Mussels; Direct dilution; UPLC-MS/MS
受到人类活动和气候变化的影响,各地区水域水体富营养化导致蓝细菌剧增,从而出现水华或赤潮[1]。微囊藻毒素是蓝细菌产生的具有很强肝毒性的次级代谢产物,容易通过食物链富集在一些以虑食浮游藻类为生的软体动物中[2],对环境和人类健康造成极大的潜在危害[3]。近年来,微囊藻毒素污染情况在淡水和海水无脊椎动物中都已有相关研究报道[4-5]。闽东地区近海养殖业丰富,随着微囊藻毒素污染风险的加大,对近海水域中微囊藻毒素的监控显得尤为重要[6-7]。贻贝,俗称淡菜,是以虑食藻类为生的双壳软体动物,是评估微囊藻毒素生物富集作用的重要动物载体。因此,建立贻贝等双壳贝类中的微囊藻毒素定量测定的方法可以有效地监测这些生态系统的状态和污染程度。
微囊藻毒素因其分布的广泛性和毒性强烈,是研究最多的蓝藻毒素[8]。微囊藻毒素的基本结构是由7个氨基酸残基形成的环状七肽,包括D-丙氨酸-X可变氨基酸-D-甲基天门冬氨酸-Z可变氨基酸-Adda-D-谷氨酸-Mdha,其中Adda是(2S,3S,8S,9S)-3-氨基-9甲氧基-2,6,8-三甲基-10-苯基-4,6-二烯酸,Mdha是甲基脱氢丙氨酸。MC-LR、MC-RR和MC-YR分别表示X可变氨基酸和Z可变氨基酸为亮氨酸(leucine,L)、精氨酸(arginine,R)或酪氨酸(tyrosine,Y)[9-10]。在已经鉴别出的两百多种微囊藻毒素结构类似物中,MC-LR、MC-RR和MC-YR是最常见的变体,且肝毒性较强[11-12]。因此测定贻贝中这3种微囊藻毒素的含量能够有效评估闽东地区贻贝受到近海赤潮和淡水水华的污染情况。
液质联用(LC-MS,LC-MS/MS)测定各类基质中的微囊藻毒素的方法已有相关研究报道,诸如水样、水华生物量、蓝藻菌株、软体动物和鱼类[13-16]。UPLC-MS/MS更是一种快速有效测定多种样品基质中微囊藻毒素的分析方法。不同样品基质采样的前处理手段多有差异。常见的UPLC-MS/MS分析方法的前处理需要经过固相萃取柱净化[13,17],在调查研究需要批量筛查的时候耗时较长、成本高。因此,本研究建立直接稀释结合UPLC-MS/MS测定贻贝中3种微囊藻毒素,操作过程简便、快捷、成本低,可以有效地用于监测闽东地区贻贝中微囊藻毒素的污染状况。
1 材料和方法
1.1 试验材料
20份贻贝样品主要购自宁德蕉城、福安、霞浦、福鼎4个辖区的沿海乡镇。
1.2 仪器和试剂
1.2.1 主要仪器 LC-30AD高效液相色谱仪(日本Shimadzu公司);Triple Quad 5500质谱仪(美国AB公司);ME204E电子天平(精度0.1 mg, 梅特勒托利多仪器有限公司); KQ500DE超声波清洗器(昆山市超声仪器有限公司);318K高速冷冻离心机(德国Sigma公司);UPT-II-10T超纯水机(成都超纯科技有限公司)。
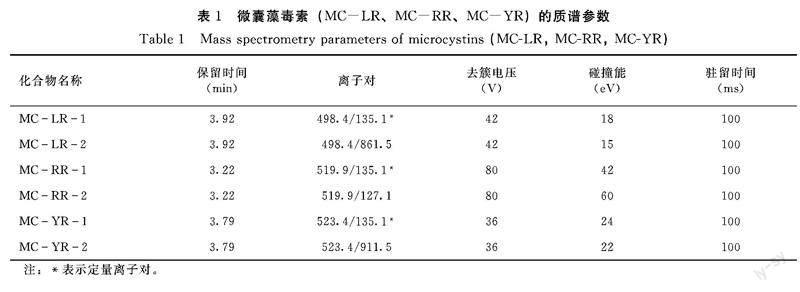
1.2.2 主要试剂 3种微囊藻毒素标准储备溶液:MC-LR(浓度20 μg·mL-1,扩展不确定度0.12 μg·mL-1,上海安谱科技公司)、MC-RR(浓度20 μg·mL-1,扩展不确定度0.12 μg·mL-1,上海安谱科技公司)、MC-YR(纯度≥95%,浓度10 μg·mL-1,上海安谱科技公司);乙腈、甲醇、乙酸、甲酸(均为色谱纯)(上海安谱科技公司);有机相针式尼龙过滤器(13 mm,0.22 μm,上海安谱科技公司)。
3种微囊藻毒素标准储备溶液用甲醇稀释成1 μg·mL-1混合标准中间溶液。提取液用90 mL甲醇和10 mL纯水配制,稀释溶液用0.5 mL乙酸和99.5 mL甲醇配制。
1.3 前处理方法
1.3.1 样品前处理 取1 kg贻贝用清水洗净,去壳干净,取出可食部分(包括肌肉部分和内脏组织),收集所有样品组织,均质匀浆,获得待分析式样。
称取上述试样1 g左右(精确至0.01 g)于50 mL聚丙烯离心管中,准确加入5 mL的90%甲醇溶液, 充分振荡涡旋1 min,然后再40℃超声20 min,4000 r·min-1离心5 min。准确移取1.0 mL上清液到50 mL聚丙烯离心管中,并加入9.0 mL的0.5%乙酸甲醇溶液,充分振荡涡旋1 min,12000 r·min-1冷冻离心5 min,上清液过尼龙膜,置于棕色进样瓶中,当天上机。
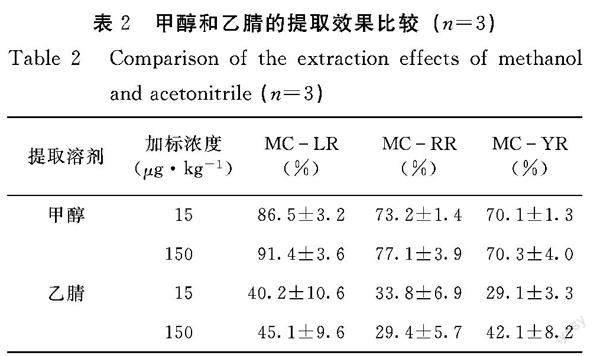
1.3.2 贻贝中微囊藻毒素提取条件的优化 (1)不同提取溶剂的条件优化。分别用5 mL甲醇和乙腈提取毒素加标浓度为15、150 μg·kg-1(鲜重计)
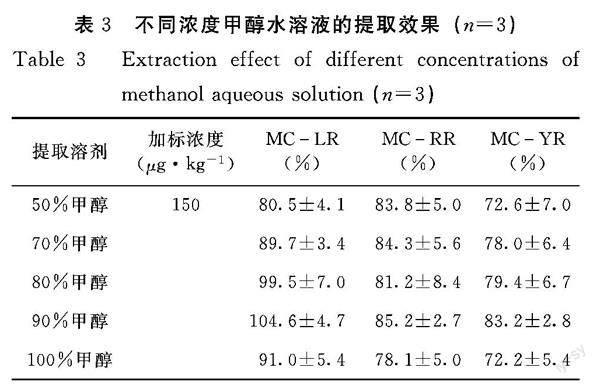
的贻贝样品,按照1.2.1前处理方法进行分析,计算加标回收率。(2)不同浓度甲醇水的条件优化。分别用50%甲醇水、70%甲醇水、80%甲醇、90%甲醇水和100%甲醇对贻贝加标样品(加標浓度为150 μg·kg-1)中3种微囊藻毒素进行提取,按照1.2.1的前处理方法进行分析,计算加标回收率。
1.3.3 微囊藻毒素稀释倍数的选择和基质效应评估 前人研究表明,当进样体积为5 μL时,进样溶液为0.5%乙酸甲醇,3种微囊藻毒素的色谱峰峰型较好[20]。综合考虑方法灵敏度和基质效应的影响,采用5 mL的90%甲醇水溶液提取后进一步用0.5%乙酸甲醇稀释。分别采用3种稀释倍数(2、10、20倍)进行试验,利用溶剂标准曲线进行定量,分析3种微囊藻毒素的回收率结果(加标浓度为150 μg·kg-1)。
采用0.5%乙酸甲醇直接配制溶剂标准曲线,另外用阴性贻贝样品处理后得到的空白基质溶液配制基质校准曲线。基质效应=基质校准曲线的斜率/溶剂标准曲线的斜率[18],根据公式计算基质效应的大小。研究表明基质效应在0.8~1.2,可忽略其影响[19]。
1.3.4 回收率与精密度试验 分别称取18份微囊藻毒素阴性的贻贝样品,分成3组,分别加入适量的3种微囊藻毒素混合标准工作溶液,使得每组样品中3种微囊藻毒素的加标量分别为15、30、150 μg·kg-1。加标样品按照上述步骤进行提取,UPLC-MS/MS测定,外标法定量,分别计算3种微囊藻毒素的含量,以评估毒素的回收率和相对标准偏差。
1.3.5 检出限和定量限试验 称取毒素阴性的贻贝样品(1.00±0.01) g,在低浓度毒素添加水平(5、15 μg·kg-1)进行试验,处理后进行UPLC-MS/MS分析。每个浓度水平重复测定11次,计算信噪比,以确定检出限和定量限。
1.3.6 实际样品测定 20份贻贝样品采用1.2.1 前处理方法进行试验,利用1.4色谱质谱条件进行仪器分析,获得贻贝中微囊藻毒素的污染水平。
1.4 标准工作溶液配制
溶剂标准工作溶液:分别准确移取适量的1 μg·mL-1 3种微囊藻毒素混合标准中间溶液,用0.5%乙酸甲醇溶液逐级稀释,配制成0.2、0.5、1、5、10、20 μg·mL-1的微囊藻毒素混合溶剂标准工作溶液。
贻贝基质标准工作溶液:分别准确移取适量的1 μg·mL-1 3种微囊藻毒素混合标准中间溶液,用贻贝基质溶液逐级稀释,配制成0.2、0.5、1、5、10、20 μg·mL-1的微囊藻毒素混合基质标准工作溶液。
1.5 色谱质谱条件
1.5.1 色谱条件 Shim-pack GIST C18AQ HP 色谱柱(1.9 μm,2.1×100 mm);进样体积5.00 μL;柱温箱温度40℃;流速为 0.3 mL·min-1;流动相:A为0.1%甲酸水溶液,B为乙腈。洗脱条件:0~4.0 min,20%~60% B;4.0~5.0 min,60%~90% B;5.0~6.0 min,90%~20%B;6.0~8.0 min,20%B。
1.5.2 质谱条件 气帘气压力 35.0 psi;离子喷雾电压IS 5500.0 V;离子源温度:500.0℃;辅助气1压力50.0 psi;辅助气2压力55.0 psi;碰撞气压力9.0 psi;3种微囊藻毒素离子对的去簇电压、碰撞能、驻留时间见表1。
2 结果与分析
2.1 贻贝中微囊藻毒素提取条件的优化
2.1.1 提取溶剂的条件选择 由表2可知,3种微囊藻毒素加标浓度在15 μg·kg-1和150 μg·kg-1(鲜重计)条件下,甲醇对贻贝中3种微囊藻毒素的提取回收率高于乙腈。因而,本研究采用甲醇作为贻贝中3种微囊藻毒素的提取溶剂。
2.1.2 不同浓度甲醇水溶液的条件选择 由表3可知,50%甲醇水、70%甲醇水、80%甲醇水和100%甲醇对MC-YR的提取回收率低于80%。90%甲醇水溶液对3种微囊藻毒素的提取回收率均符合GB/T 27404-2008《實验室质量控制规范 食品理化检测》中的相关规定,能够满足检测需要。
2.2 微囊藻毒素稀释倍数的优化和基质效应的评估
由表4可知,稀释倍数为2倍时,3种毒素加标回收率偏低,基质干扰大,表现为基质抑制作用;稀释倍数为20倍时,总体基质干扰小,但是MCRR表现为基质增强作用;当稀释倍数为10倍时,3种毒素的加标回收率在91.0%~95.7%,符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》标准要求,结果满意。10倍稀释条件下基质效应评估结果表明,3种微囊藻毒素的基质效应分别是:MCLR为0.89,MCRR为1.03,MCYR为0.83。采用直接稀释法可以有效地减小基质效应的干扰。综合考虑基质效应影响和方法灵敏度的需求,本研究在90%甲醇提取后,采用0.5%乙酸甲醇进行10倍的稀释,冷冻离心后,取上清液直接过膜上机分析。
2.3 方法的线性范围、检出限和定量限
由表5可知,3种微囊藻毒素溶剂标准曲线的线性范围为0.2~20.0 ng·mL-1,相关系数r2≥0.999,线性关系良好。以目标化合物的响应值信噪比大于3时所对应的含量作为检出限,信噪比大于10作为定量限。结果表明,本研究所建立的方法中3种微囊藻毒素的检出限和定量限分别为5 μg·kg-1和15 μg·kg-1。
2.4 方法回收率和精密度
由表6可知,在添加水平为15、30和150 μg·kg-1时,3种微囊藻毒素MCLR、MCRR和MCYR的回收率分别为89.4%~91.8%、77.1%~106.3%、75.8%~102.3%,相对标准偏差分别为3.5%~13.5%、5.6%~9.2%、4.5%~8.1%(n=6)。该方法的加标回收率和实验室内精密度符合GB/T 27404-2008《实验室质量控制规范 食品理化检测》中的相关规定,能够满足检测需要。
2.5 应用确证方法分析测定实际样品
采样本研究的确证方法对闽东地区市售20份贻贝样品的微囊藻毒素进行分析。结果表明,所有贻贝样品中3种微囊藻毒素均未检出。
3 结论与讨论
本研究建立了直接稀释法结合UPLC-MS/MS同时测定贻贝中3种微囊藻毒素的方法。与现有方法相比,本研究方法简化了样品前处理的过程,采用直接稀释代替其他复杂净化步骤,使得样品的分析过程更加快捷、简便,且结果有效,适用于调查研究中微囊藻毒素的批量筛查和定量。
本研究中闽东地区市售20份贻贝样品中3种微囊藻毒素检出值均低于方法定量限,说明闽东地区市售贻贝主要为海水养殖区产出,受到微囊藻毒素污染风险较低。文献报道中,MCs在沿海地区贝类中的区域性分布特征表现为:受到内陆富营养化淡水河流交汇的海湾或近海滩涂地区,其产出的贝类产品中较容易检出MCs[20-22]。Lance等[22]研究表明,受到淡水水库富营养化的影响,法国布列塔尼海湾的贻贝和水体中均检出MCs。Kalaitzidou等[20]研究报道,受到希腊多地区淡水区域水华影响,希腊Thermaikos海湾养殖紫贻贝中检出MCs,其消化腺中MCs的含量可达到(53.9±3.2)ng·g-1 (湿重计)。因此,采用本研究方法可进一步针对闽东地区与江河交汇的海湾地区养殖贻贝进行批量筛查和定量,以考察这些地区贻贝受到微囊藻毒素污染的情况。
参考文献:
[1]邱雨,马增岭,张子怡,等.水生态系统中微囊藻毒素的分布及其生态毒理效应研究进展[J].应用生态学报,2023,34(1):277-278.
[2]王鑫宇,戴伟,毕相东.脱毒水华蓝藻粉对硬壳蛤幼贝生长、摄食及肠道微生物的影响[J].饲料研究,2022(11):46-51.
[3]毕相东.微囊藻毒素(MCs)对淡水池塘养殖业的危害及防控研究进展[J].大连海洋大学学报,2021,36(4):535-545.
[4]AVERY T,MEREDITH H,CAREY N,et al.Multiple Stressors at the Land-Sea Interface: Cyanotoxins at the Land-Sea Interface in the Southern California Bight[J].Toxins,2017:DOI:10.3390/toxins9030095.
[5]GIBBLE C M,PEACOCK M B,KUDELA R M.Evidence of freshwater algal toxins in marine shellfish: Implications for human and aquatic health[J].Harmful Algae,2016,59:59-66.
[6]DEZ-QUIJADA JIMNEZ L,GUZMN-GUILLN R,CTUNESCU G M,et al.A new method for the simultaneous determination of cyanotoxins (Microcystins and Cylindrospermopsin) in mussels using SPE-UPLC-MS/MS[J].Environ Res,2020,185:109284.
[7]ELENA B,VITTORIA V M,TIZIANA S,et al.Microcystins Presence in Mussels (M.galloprovincialis) and Water of Two Productive Mediterranean′s Lagoons (Sardinia, Italy)[J].BioMed Research International,2017,2017:1-7.
[8]BERRY M A,DAVIS T W,CORY R M,et al.Cyanobacterial harmful algal blooms are a biological disturbance to Western Lake Erie bacterial communities[J].Environ Microbiol,2017,19(3):1149-1162.
[9]SCHMIDT J R,WILHELM S W,BOYER G L.The Fate of Microcystins in the Environment and Challenges for Monitoring[J].Toxins,2014,6(12):3354-3387.
[10] 柴玉婕,冯佳,周见庭,等.微囊藻毒素生物治理技术研究进展[J].中国生物工程杂志,2022,42(08):109-127.
[11]叶冠琛,王一如,徐立红.微囊藻毒素对多种靶器官的毒性作用研究进展[J].中国细胞生物学学报,2019,41(6):1193-1200.
[12]DIEZ-QUIJADA L,PUERTO M,GUTIERREZ-PRAENA D,et al.Microcystin-RR:Occurrence, content in water and food and toxicological studies.A review[J].Environ Res,2019,168:467-489.
[13]ZERVOU S K,CHRISTOPHORIDIS C,KALOUDIS T,et al.New SPE-LC-MS/MS method for simultaneous determination of multi-class cyanobacterial and algal toxins[J].J Hazard Mater,2017,323(Pt A):56-66.
[14]袁瑞,付云,张鹏,等.南太湖水体及水产品中微囊藻毒素污染状况调查[J].中国卫生检验杂志,2021,31(10):1243-1245,1249.
[15]郭雅欣,錢宗耀,龚婷婷,等.太湖贝类中微囊藻毒素的测定与健康风险评估[J].环境化学,2020,39(10):2673-2682.
[16]MASSEY I Y,WU P,WEI J,et al.A Mini-Review on Detection Methods of Microcystins[J].Toxins (Basel),2020,12(10):641.
[17]徐潇颖,刘柱,梁晶晶,等.多壁碳纳米管分散固相萃取净化在测定水产品中3种微囊藻毒素的应用及与固相萃取法的比较[J].食品科学,2018,39(18):315-319.
[18]ZHAO L,LUCAS D,LONG D,et al.Multi-class multi-residue analysis of veterinary drugs in meat using enhanced matrix removal lipid cleanup and liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2018,1549:14-24.
[19]陈丽惠,贾玉珠,张斌,等.分散固相萃取液相色谱串联质谱法测定淡水鱼中柱孢藻毒素,节球藻毒素和微囊藻毒素[J].色谱, 2019,37(7):723-728.
[20]KALAITZIDOU M P,NANNOU C I,LAMBROPOULOU D A,et al.First report of detection of microcystins in farmed mediterranean mussels Mytilus galloprovincialis in Thermaikos gulf in Greece[J].J Biol Res (Thessalon),2021,28(1):8.
[21]PREECE E P,MOORE B C,HARDY F J.Transfer of microcystin from freshwater lakes to Puget Sound, WA and toxin accumulation in marine mussels (Mytilus trossulus)[J].Ecotoxicol Environ Saf,2015,122:98-105.
[22]LANCE E,LEPOUTRE A,SAVAR V,et al.In situ use of bivalves and passive samplers to reveal water contamination by microcystins along a freshwater-marine continuum in France[J].Water Res,2021,204:117620.
(责任编辑:柯文辉)
收稿日期:2022-12-05
作者简介:黄连琴,女,1988年生,硕士研究生,工程师,主要从事食品质量安全研究。
基金项目:福建省市场监督管理局科技项目(FJMS2019050)。

