缺氮与恢复供氮后水稻铵转运蛋白基因的表达特征分析
胡太蛟 张珊珊 林艳 宋亚娜

摘 要:为了解水稻吸收和利用铵态氮的分子机制,利用实时荧光定量PCR检测了水稻全部预测的12条铵转运蛋白基因在缺氮及恢复供氮处理后的表达情况。结果表明:全部铵转运蛋白基因在水稻根、茎和叶中都有表达,AMT1.1在叶中表达水平最高,其表达受到氮缺乏和氮源类型的影响。缺氮处理后,水稻根部的表达全部大幅下调,茎中多数下调,少数上调或波动,叶中大部分先上调再回落;恢复供氮后,水稻根部多数大幅上调,茎和叶中则有所分化,部分上调或先上调再回落。这一现象与水稻氮代谢途径的整体铵转运途径有关,铵的吸收是由根到茎再到叶转运,铵代谢消耗则反向转运。
关键词:表达;实时荧光定量PCR;水稻;AMT基因;氮
中图分类号:S 511 文献标志码:A 文章编号:0253-2301(2023)04-0012-10
DOI: 10.13651/j.cnki.fjnykj.2023.04.003
Analysis of the Expression Characteristics of Rice Ammonium Transporter Gene Afterthe Treatment of Nitrogen Deficiency and the Recovery of Nitrogen Supply
HU Tai-jiao1, ZHANG Shan-shan2, LIN Yan1, SONG Ya-na1
(Institute of Biotechnology, Fujian Academy of Agricultural Sciences / Fujian Key Laboratory of
Agricultural Genetic Engineering, Fuzhou, Fujian 350003, China; 2. Crop College,
Fujian Agriculture and Forestry University, Fuzhou, Fujian 350000, China)
Abstracts: In order to understand the molecular mechanism of absorption and utilization of ammonium nitrogen in rice, the real-time fluorescence quantitative PCR was used to detect the expression of all the 12 predicted ammonium transporter genes in rice after the treatment of nitrogen deficiency and nitrogen restoration. The results showed that all the ammonium transporter genes were expressed in the roots, stems and leaves of rice. AMT1.1 had the highest expression level in leaves, and its expression was affected by nitrogen deficiency and the types of nitrogen source. After the treatment of nitrogen deficiency, the expression in rice roots was all significantly down-regulated, the expression in most of the stems were down-regulated, a few were up-regulated or fluctuated, and the expression in most of the leaves were first up-regulated and then down. After restoring the nitrogen supply, the expression in most of the rice roots were significantly up-regulated, while the expression in stems and leaves were differentiated, partially up-regulated or first up-regulated and then down-regulated. This phenomenon was related to the overall ammonium transport pathway of rice nitrogen metabolism pathway. The absorption of ammonium was transported from roots to stems and then to leaves, and the metabolic exhaustion of ammonium was reversed.
Key words: Expression; Real-time fluorescence quantitative PCR; Rice; AMT gene; Nitrogen
氮是水稻生長和发育过程必不可少且需求量最大的3种主要营养元素之一,约占水稻干物质总量的1%~5%,被称为生命元素[1-2]。自然条件下的土壤中含氮量千变万化且浓度普遍不高,人工增施氮肥是农业生产的常规操作[3]。然而,水稻及其他农作物的氮利用效率都普遍很低,平均效率为30%~50%[4],国内更低,只有28.3%[5]。土壤中过多的氮肥无法充分利用不仅造成极大的资源浪费,同时也产生严重的环境问题。通过增施氮肥提高农作物产量的生产方式也已经达到了一个技术平台期,继续增加氮肥已难以达到大量提高产量的目的。因此,深入了解氮的吸收机制后可以对症下药,对提高水稻及其他农作物氮的利用效率意义深远。
植物吸收利用土壤中的氮主要是无机态的氮,分为两种形态:铵态氮(ammonium,NH4+)和硝态氮(nitrate,NO3-)[6-7]。由于铵态氮的吸收耗能更少,有研究表明植物偏向于优先利用铵态氮[8-9]。水稻是喜铵作物,偏向于优先利用铵态氮[10]。水稻对铵态氮的吸收是通过铵转运蛋白(ammonium transporter,AMT)来实现的[11-12]。
水稻中预测有12个AMT基因(TIGR数据库,http://rice.plantbiology.msu.edu/)[13],所有12个基因的蛋白都含有铵转运蛋白结构域(Accession No.PF00909)(Pfam分析,http://pfam.sanger.ac.uk/search/sequence),符合铵离子转运的功能。大部分蛋白都含有10~11个跨膜结构域,其中N端在膜外,C端在膜内,与已知的其他AMT蛋白的晶体结构相符合[13]。
研究基因的表达,通常从转录水平定量检测转录产物mRNA,或者从翻译水平定量检测转录后翻译产物蛋白质。前者的方法包括反转录PCR(RT-PCR)、基因芯片、Northern Blot和实时荧光定量PCR(real-time fluorescence quantitative PCR),后者一般是酶联免疫吸附测定法 (Enzyme-Linked Immunosorbent Assay , ELISA)、蛋白芯片和蛋白质免疫印迹(Western blot)法。早期研究一般采用RT-PCR[14-15],目前主流是采用特异性和高敏感性的实时荧光定量PCR法[16-18],ELISA和Western blot受限于目标抗体的获得难度难以普及。据报道:OsAMT1.1是组成型表达,主要表达部位是嫩枝和根,其表达几乎不受氮缺乏、氮源提供的形式与水平的影响[19-20]。OsAMT1.2和OsAMT1.3是根特异性表达的,但在嫩枝中也能检测到,前者受铵的诱导,后者受铵的抑制,后者还受光周期的调控,白天比晚上的表达水平高很多[19]。Kumar等[20]研究表明AMT1家族基因在籼稻与粳稻中的表达是有差别的。cDNA芯片分析表明,氮缺乏试验处理后,粳稻品种武运粳7中组成型表达的AMT2.1在根中增强表达,AMT3.1在嫩枝中明显下调表达,AMT3.2和AMT3.3在根中都明显增强表达,嫩枝中只有AMT3.3明显增强[13]。Li等[21]报道9个水稻铵转运蛋白基因在水稻植株的不同部位都有表达,包括成熟根、幼嫩根、茎和新老叶片,结果表明:OsAMT1.1、OsAMT3.2和OsAMT3.3主要在老叶中表达,根和茎中也表达;OsAMT1.2和OsAMT1.3主要在根中表达;OsAMT2.1、OsAMT2.2、OsAMT2.3和OsAMT3.1主要在幼苗中表达,尤其在新叶中表达最高,相对于其他茎中表达的AMT基因,它们是优势表达的;幼苗期和分蘖期的9个水稻铵轉运蛋白基因的表达模式一致,只是分蘖期需要更多的氮营养;氮缺乏处理48 h后,OsAMT1.1、OsAMT1.2、OsAMT3.1、OsAMT3.2和OsAMT3.3的表达是上调的,OsAMT1.3的表达是下调的;氮缺乏后再恢复供铵氮或硝酸铵后,OsAMT1.2和OsAMT3.3的表达是下调的,OsAMT1.3的表达是上调的;氮缺乏后再恢复供硝态氮后,OsAMT1.1和OsAMT1.2的表达是下调的[21]。
总的来说,水稻AMT的研究在相关的序列预测、结构与基本功能以及部分基因的表达与调控方面都有了可喜的进展,但是每个基因具体的生物学功能以及表达调控机制仍然不太清楚。本研究通过实时荧光定量PCR的方法检测了籼稻明恢86全部预测的12条AMT基因于缺氮及恢复供氮处理后的表达情况,以期为解析水稻每个AMT基因具体的生物学功能以及表达调控机制提供基础数据参考。
1 材料与方法
1.1 试验材料
以水稻明恢86为材料,采用水培方式。
1.2 主要试剂与仪器
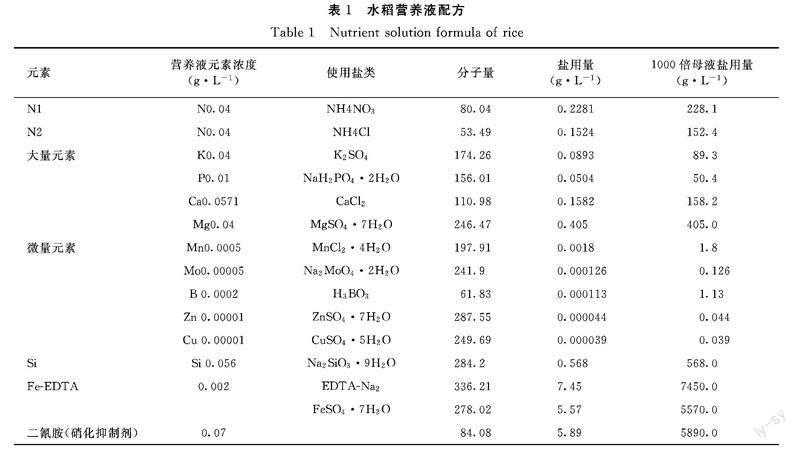
1.2.1 主要试剂 水稻营养液配方参照国际水稻所水稻营养液配方配制,略有调整(表1),其中常规氮用N1(NH4NO3)、铵氮用N2(NH4Cl)、缺氮处理时不添加氮元素,其他所有元素都相同。
RNA提取试剂RNA-easy Isolation Reagent、cDNA反转录试剂HiScript II Q RT SuperMix for qPCR (+g DNA wiper)和荧光定量PCR Mix试剂Taq Pro Universal SYBR qPCR Master Mix均购自南京诺唯赞生物科技股份有限公司,引物由生工生物工程(上海)股份有限公司合成。
1.2.2 主要仪器 植物培养使用加拿大CONVIRON公司的A1000PG多功能植物生长箱;核酸定量使用美国Nanodrop公司的NanoDrop 1000超微量分光光度计;荧光定量PCR反应采用美国ABI公司的QuantStudio 3荧光定量PCR仪。
1.3 试验方法
1.3.1 水稻种子预培养 水稻种子于室温清水浸种48 h,其间换水2~3次,然后控干水分37℃黑暗中催芽1 d,再转移到90 mm培养皿中,用常规氮N1水培营养液混合培养。
1.3.2 水稻幼苗培养条件及管理 采用多功能植物生长箱培养,参数设置为26℃/28℃各12 h,光照12/黑暗12 h,相对湿度为80%,光照强度设置为3。苗龄7~10 d时,选取粗壮且生长较一致的幼苗单株转移至水培盒中继续水培,水培盒容积约2.5 L。使用常规氮N1水培营养液培养,pH 5.5,加入硝化抑制剂二氰胺5.89 mg·L-1。每隔3 d换1次营养液[22]。
1.3.3 试验设计 苗龄15 d时进行处理1:缺氮处理(N水平为0,其他元素同常规氮N1营养液),缺氮前样品为对照组。缺氮处理96 h后,一组样品进行处理2:常规氮N1营养液处理;另一组样品进行处理3:铵氮N2营养液处理;处理2和3的对照组为缺氮处理96 h后样品。每个处理3个重复,试验重复2次[21]。
1.3.4 取样与水稻cDNA模板合成 参照Li等[21]和赵首萍等[22]的方法并稍有修改,缺氮处理后,分别在0、2、6、48和96 h各取样1次,根、叶和剩余的茎秆部分分开。样品经液氮速冻后,于-80℃保存备用。恢复供氮后分别在2、24 h各取样1次,样品同样处理[21-22]。所有样品经液氮研磨后,用RNA-easy Isolation Reagent(货号:R701-02)提取,详细步骤按说明书操作。所提取的总RNA经琼脂糖凝胶电泳检测其纯度及质量,然后使用NanoDrop 1000超微量分光光度计来定量其浓度。下一步使用约1 ug总RNA进行cDNA的合成,使用诺唯赞公司的HiScript II Q RT SuperMix for qPCR (+g DNA wiper),按照产品说明书操作。
1.3.5 测定项目 依据水稻12条AMT基因对应的NCBI数据库中的cDNA序列以及内参OsActin(X16280.1)的序列(表2)分别设计特异引物(表3),送生工生物工程(上海)股份有限公司合成。
1.3.6 数据处理 实时荧光定量PCR所获得的原始数据为Ct值,其3个重复的平均值即为CtMean,其标准误差为SD。各样品的Ct值与对应的内参的CtMean值之差即为ΔCt,其中对照组的为ΔCt1,处理组的为ΔCt2,则ΔCt2-ΔCt1=ΔΔCt。各基因相对内参基因的表达水平用E表示,则E=2^(-ΔΔCt)。采用EXCEL软件进行数据分析以及绘图。
2 结果与分析
2.1 实时荧光定量PCR引物的确认
已合成好的引物用一个标准水稻样品作为模板进行实时荧光定量PCR反应,通过该反应所获得的扩增曲线来判断引物是否可用于后续的检测。同一引物同一模板4次重复所获得的扩增曲线要满足尽量靠近,不能有太大的偏离(或者不同重复的Ct值最高相差小于0.5),且Ct值最好小于35。由图1可知,预试验满足条件的引物选定为后续试验的引物。
2.2 缺氮情况下水稻各部位AMT基因的表达情况
总体来看,缺氮处理后,水稻12条AMT基因的相对表达E值绝大多数与对照相比都达到了极显著水平(P<0.01),其中在根部和茎秆部中的表达是明显下调的(E值小于1),在叶中则大部分是明显上调的(E值大于1)。
在根中(表4):全部AMT基因的相对表达都是下调的,只是下调的幅度与趋势稍有差别。AMT1.1、AMT1.3、AMT2.2、AMT3.1和AMT5.2的下调幅度达到或超过80%(E值<0.2或接近),且随时间变化波动不大。AMT2.3和AMT4也下调明显,且随时间逐步下调至20%以下或接近于0的极低水平。AMT1.2和AMT2.1的下调幅度较小,其随时间的变化趋势与基因AMT3.2、AMT3.3和AMT5.1的一致,都是先逐步下调然后有一个回调的波动,总体还是在下调的范围内变化。
在茎秆中(表5):基因AMT1.1、 AMT1.2、 AMT1.3、 AMT2.3、 AMT3.3、 AMT4、 AMT5.1和AMT5.2的相对表达下调明显,且随时间变化波动不大。基因AMT2.1和AMT2.2的相对表达先是明显下调然后再上调,波动幅度在2倍以内。基因AMT3.1和AMT3.2总体也下调明显。
在叶中(表6):除了基因AMT2.1和AMT3.3的相对表达是一个逐步上调的趋势,其他AMT基因的相对表达都是先上调然后再下调,上调的峰值大多数出现在6 h或以内,一般上调2倍左右,最高AMT5.1可达11倍以上。96 h以后,基因AMT1.2、AMT2.2、AMT2.3、AMT3.1、AMT4和AMT5.2等6条AMT基因的相对表达已下降到50%以内(E值<0.5),其中最低的AMT2.3几乎下降为0;而基因AMT2.1、AMT3.3、AMT3.2和AMT5.1则上调到2.5倍以上。
2.3 缺氮后恢复供氮情况下水稻各部位AMT基因的表达情况
总体来看,缺氮再恢复供氮处理后,水稻12条AMT基因的相对表达E值绝大多数與对照相比都达到了极显著水平(P<0.01)。除AMT1.2外,水稻其余11条AMT基因在根部的表达是明显上调的(E值>1),且上调的幅度都较大,一般达4倍以上,最高AMT1.3可达600倍以上;在茎秆和叶中则大部分是下调的(E值<1),或者先上调然后再下调,其幅度也比在根部的变化小。
在根中(表7):恢复常规氮N1后,基因AMT1.1、AMT3.1、AMT3.2、AMT3.3、AMT5.1和AMT5.2的相对表达都是先上调再下调,与恢复氨氮N2后比较,以上基因除AMT1.1外,其他的变化趋势一致,且后者的变化波动更大。AMT1.2是恢复常规氮N1后唯一出现下调的基因,它在恢复氨氮N2后却是缓缓上调的。AMT1.3、AMT2.1、AMT2.2、AMT2.3和AMT4的相对表达在恢复常规氮N1后都是持续上调(E值>1)的,且上调幅度均在4倍以上,最高达到294倍以上;与恢复氨氮N2后比较,前3个基因的表达还是持续上调,且幅度较大,最高达到693倍以上,后两个基因则是先上调再下调,变化幅度相对较小。
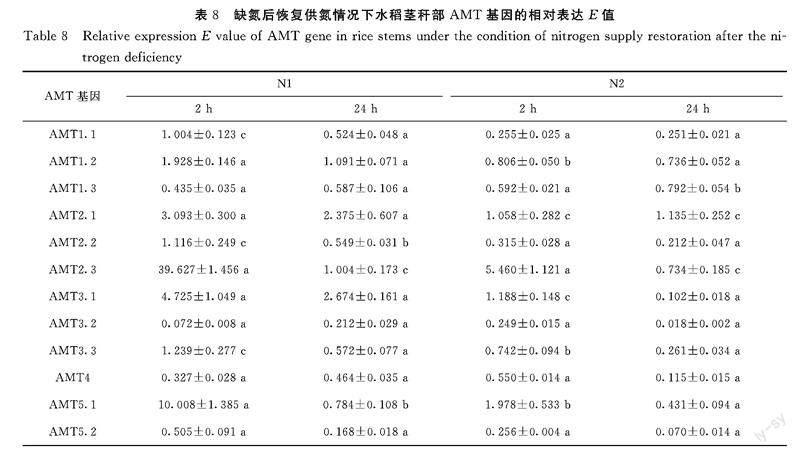
在茎秆中(表8):除了基因AMT1.2、AMT2.1、AMT2.3、AMT3.1和AMT5.1的相对表达是先有一个明显的上调再下调,其他AMT基因的相对表达都是下调的,只是随时间变化波动不大。另外,所有AMT基因的相对表达变化趋势似乎与恢复供氮的氮素类型无关。
在叶中(表9):基因AMT1.1、AMT1.2、AMT3.2、AMT3.3和AMT5.2的相对表达都是下调的,与恢复供氮类型无关,波动幅度也不大。基因AMT1.3和AMT2.2的相对表达在恢复N1或N2后都是先下调再上调的,一般上调2倍以上,最高可达14倍以上,比较而言,恢复N2后的变动幅度比恢复N1的变动幅度更大。 基因AMT2.1的相对表达在恢复N1或N2后都是先上调再下调的,幅度变化较小(<50%)。基因AMT2.3、AMT3.1和AMT5.1的相对表达在恢复N1后会有一个明显的上调,至少3倍以上,最高可达116倍以上,然后下调;在恢复N2后,其变化趋势是相反的,先下调再上调,变化幅度也更小,最高不超过5倍。基因AMT4的相对表达在恢复N1后是先下调再上调的,上调幅度最高达4倍;在恢复N2后基本是下调的,下调幅度超过50%。
3 结论与讨论
本研究通过实时荧光定量PCR的方法,分析了水稻全部预测的12条AMT基因在缺氮处理后及缺氮再恢复供氮处理后的基因表达情况,为解析每个AMT基因具体的生物学功能以及表达调控机制,帮助理解水稻吸收和利用铵态氮的分子机制,进一步寻找提高水稻氮利用效率,培育水稻氮高效品种提供了理论参考数据。
Sonodaet等[19]和Li等[9]报道AMT1.1是组成型表达,主要表达部位是嫩枝和根,其表达几乎不受氮缺乏、氮源提供的形式与水平的影响。本研究中,在常规氮N1营养液培养的水稻中,全部AMT基因在根部、茎秆和叶中都有检测到基因表达,只是部分基因在一些组织中的表达水平极低。这与Li等[21]报道的9个水稻铵转运蛋白基因在水稻植株的不同部位都有表达部分相一致。可能由于AMT基因的表达水平普遍不高,早期的研究方法可能受检测精度的局限,难以全面检测到。Sonoda等[19]报道AMT1.2和AMT1.3是根特异性表达的,但在嫩枝中也能检测到。前者受铵的诱导,后者受铵的抑制。本研究中,都是全部位表达的。AMT1.2可能受铵的诱导,但同时也受硝基氮的影响,缺氮再恢复常规氮N1时,它是下调的,更换成铵氮N2时,它是上调的。本研究中缺氮再恢复供氮后AMT1.3在根部和叶中都是上调的,根部的上调幅度比叶中更大,恢复N2比恢复N1的上调幅度更大,表明AMT1.3也是铵诱导的,且它的诱导效率比AMT1.2更高。缺氮处理后,粳稻中的AMT2.1、AMT3.1、AMT3.2和AMT3.3的表达变化与本研究籼稻中的不一致
[23],这有可能是供试材料的品种差异影响的。从本研究中的结果来看,可能是与取样时间和取样频次也有关,早期的研究多数是终点取樣或者间隔时间太长[9,17,19-21]。缺氮或缺氮再恢复供氮后,大多数基因的表达变化可能是一个随时间波动变化的过程,由于取样时间点还不够多不够密,有可能影响了结果的判断,后续可以考虑引入转录组分析等方法。
参考文献:
[1]AERTS R,CHAPINF S.The mineral nutrition of wild plants revisited: are-evaluation of processes and patterns[J].Advances In Ecological Research,1999,30:1-67.
[2]LUDEWIG U,NEUHAUSER B,DYNOWSKI M.Molecular mechanisms of ammonium transport and accumulationin plants[J].FEBS Letters,2007,581:2301-2308.
[3]MULVANEY R L,KHAN S A, ELLSWORTH T R.Synthetic nitrogen fertilizers deplete soil nitrogen: aglobal dilemma for sustainable cereal production[J].Journal Of Environmental Quality,2009,38:2295-2314.
[4]GARNETT T,CONN V,KAISER BN.Root based approaches to improving nitrogen use efficiency in plants[J].Plant Cell & Environment,2009,32:1272-1283.
[5]张福锁,王激清,张卫峰,等.中国主要粮食作物肥料利用率现状与提高途径[J].土壤学报,2008,45(5):915-924.
[6]STUART F.Chapin, III.Themineralnutritionofwildplants[J].Annual Review of Ecology and Systematics,1980,11:233-260.
[7]MARSCHNER H L.Mineral Nutrition in Higher Plants[B].London: AcademicPress,1995.
[8]NICOLAUS V W,SONIA G,ALAIN G,et al.The molecular physiology of ammonium uptake and retrieval[J].Current Opinion in Plant Biology,2000,3:254-261.
[9]LI B Z,XIN W J,SUN S B,et al.Physiological and molecular responses of nitrogen-starved rice plants to re-supply of different nitrogen sources[J].Plant Soil,2006,287:145-159.
[10]BU Y Y,TAKANO T,NEMOTO K,et al.Research progress of ammonium transporter in rice plants[J].Genomics and Applied Biology,2011,2(3):19-23.
[11]SCHJOERRING J K,HUSTED S,MACK G,et al.The regulation of ammonium translocation in plants[J].Journal of Experimental Botany,2002,53(370):883-890.
[12]GLASS A D M,BRITTO D T,KAISER B N,et al.The regulation of nitrate and ammonium transport systems in plants[J].Journal of Experimental Botany,2002,53(370):855-864.
[13]LI B,MEERICKM,LI S,et al.Molecular basis and regulation of ammonium transporter in rice[J].Rice Science,2009,16(4):314-322.
[14]王荣,李红菊.半定量RT-PCR法在检测基因表达水平中的应用[J].阜阳师范学院学报(自然科学版),2007,24(4):49-52.
[15]高海波,张栓林,陈燕红.半定量RT- PCR在基因表达方面的应用[J].畜禽业,2008, 226:34-37.
[16]孙淑斌,李宝珍,胡江,等.水稻低丰度表达基因OsAMT1;3 实时荧光定量PCR方法的建立及其应用[J].中国水稻科学,2006,20(1):8-12.
[17]LI S M,SHI W M.Quantitative characterization of nitrogen regulation of OsAMT1;1, OsAMT1;2, and OsAMT2;2 expression in rice seedlings[J].Russian Journal of Plant Physiology,2006,53(6):837-843.
[18]杨帆,丁菲,杜天真.盐胁迫下构树DREB转录因子基因表达的实时荧光定量PCR分析[J].林业科学,2010,46(4):146-150.
[19]SONODA Y,IKEDA A,SAIKI S,et al.Distinct expression and function of three ammonium transporter genes (OsAMT1;1 - 1;3) in rice[J].Plant & Cell Physiology,2003,44:726-734.
[20]KUMAR A,SILIM S N,OKAMOTO M,et al.Differential expression of three members of the AMT1 gene family encoding putative high-affinity NH4+ transporters in roots of Oryza sativa subspecies indica[J].Plant Cell & Environment,2003,26:907-914.
[21]LI S M,LI B Z,SHI W M.Expression patterns of nine ammonium transporters in rice in response to N status[J].Pedosphere,2012,22(6):860-869.
[22]趙首萍,施卫明.水稻NH4+转运蛋白基因OsAMT1.1~1.3, OsAMT3.1 和OsAMT4.1 表达部位及表达特性初析[J].土壤,2007,39(3):460-464.
[23]SUENAGA A,MORIYAK,SONODAY,et al.Constitutive expression of a novel-type ammonium transporter OsAMT2 inrice plants[J].Plant & Cell Physiology,2003,44(2):206-211.
(责任编辑:柯文辉)
收稿日期:2023-03-26
作者简介:胡太蛟,男,1975年生,博士,助理研究员,主要从事植物基因工程研究。
*通信作者:宋亚娜,女,1973年生,研究员,主要从事土壤微生物研究。
基金项目:福建省科技计划公益类项目(2019R1027-2);福建省人民政府、中国农业科学院“5511”协同创新工程(XTCXGC2021002)。

