原发性醛固酮增多症的临床特征及列线图应用
丁源,倪会芳,李隽,付群,贺慧甜,吴文迅
(郑州大学第一附属医院 内分泌及代谢性疾病科,河南 郑州 450052)
原发性醛固酮增多症(primary aldosteronism,PA)是因肾上腺皮质自主分泌过多醛固酮,使肾素-血管紧张素系统受抑制,导致体内潴钠排钾,血容量增多,临床主要表现为高血压和低血钾。研究发现,醛固酮分泌增多会引起心、脑、肾损害。因此PA的早期诊断、早期治疗尤为重要。PA包含多种亚型,醛固酮腺瘤(aldosterone-producing adenoma,APA)首选手术治疗,而特发性醛固酮增多症(idiopathic hyperaldosteronism,IHA)首选药物治疗。因部分病例的影像学表现经计算机断层扫描(computed tomography,CT)难以判断,需要借助肾上腺静脉取血(adrenal vein sampling,AVS)来进行鉴别,而AVS作为金标准却因技术难度和设备要求难以大范围推广,所以有必要寻找非侵入性的分型方法。本文旨在分析不同PA的特点,对其临床特征进行比较、归纳与总结,为临床PA亚型的鉴别诊断提供新的思路。
1 对象和方法
1.1 研究对象选取2008—2022年于郑州大学第一附属医院就诊的204例诊断为PA的患者为研究对象。(1)纳入标准:PA诊断参考2020版原发性醛固酮增多症诊疗专家共识[1]。(2)排除标准:①已明确诊断的其他继发性高血压,如肾动脉狭窄、库欣综合征或嗜铬细胞瘤;②肾功能不全(肾小球滤过率>正常上限2倍);③肝硬化;④目前正在使用糖皮质激素治疗相关疾病;⑤心功能不全(美国纽约心脏病学会心功能分级3级及3级以上或者左室射血分数<50%);⑥近6个月有脑卒中及急性心肌梗死发作;⑦妊娠期、哺乳期;⑧所需临床资料不全。
1.2 分组方法将204例患者分为APA组(134例)和IHA组(70例)。APA分型参考2006年发表的PASO研究[2],符合以下标准之一即可:(1)AVS时醛固酮分泌的偏侧化;(2)病理诊断为肾上腺腺瘤;(3)肾上腺切除术后血压的完全缓解或部分缓解,术后180 d后进行评估,可停用降压药且血压<140/90 mmHg(1 mmHg=0.133 kPa)为完全缓解,仍需服用降压药但用药量较前减少且血压<140/90 mmHg为部分缓解。IHA分型依据:符合PA诊断标准且AVS时醛固酮无偏侧化分泌。
1.3 诊断方法
1.3.1PA 对可疑的高血压患者,首先应用筛查试验,筛查试验阳性后,进行确证试验,若确证试验也出现阳性则诊断为PA。确证后进一步行AVS确定分型。
1.3.2高血压 参考《中国高血压防治指南(2018年修订版)》[3],在PA的诊断前、诊断过程中患者的收缩压≥140 mmHg或舒张压≥90 mmHg,诊断为高血压。
1.3.3低血钾 血清钾<3.5 mmol·L-1诊断为低钾血症。
1.3.4多尿 24 h排尿量>2 500 mL诊断为多尿。
1.3.5影像学检查 由2名资深的影像学专家在不知AVS结果的情况下分别作出对CT结果的描述,结果不一致时经共同协商后得出一致的结论。若肾上腺的CT影像表现为大腺瘤(CT直径>10 mm)、小腺瘤(CT直径≤10 mm)或增粗则定义为肾上腺有病变。根据CT影像表现分为双侧正常、单侧病变和双侧病变。若双侧正常或双侧病变则定义为具有双侧CT表现,若单侧病变则定义为无双侧CT表现。
2 结果
2.1 不同类型PA患者临床特征共纳入204例研究对象,患者年龄为21~80岁,平均(51.47±11.37)岁,其中18~40岁有38例,>40~60岁有120例,>60岁以上有46例。男性有101例(49.51%),女性有103例(50.49%)。204例患者全部存在高血压,131例(64.22%)合并低血钾,124例(60.78%)合并四肢乏力,48例(23.53%)存在多尿,35(17.16%)合并阵发性室上性心动过速。不同临床亚型患者年龄、收缩压、舒张压、单核细胞(mononuclear cell,MON)、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)、空腹血糖(fasting blood glucose,FBG)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、早8点促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、早8点皮质醇(cortisol,COR)、立位血浆醛固酮/肾素浓度比值(aldosterone to renin ratio,ARR)、24 h尿肾上腺素(urinary adrenaline,UE)差异无统计学意义(P>0.05),不同亚型之间的体重指数(body mass index,BMI)、血钾、卧立位血浆醛固酮浓度(plasma aldosterone concentration,PAC)、卧位ARR、24 h尿醛固酮(urine aldosterone,UALD)差异有统计学意义(P<0.05)。见表1。

表1 不同类型PA患者的临床特征比较
2.2 影像学表现APA组双侧CT表现有42例,占本组病例的31.34%,IHA组双侧CT表现有50例,占本组病例的71.43%;IHA组双侧CT表现的比率比APA组高(χ2=29.840,P<0.001)。
2.3 观察组和验证组的临床特征应用随机数字表将研究对象分为观察组(n=144)与验证组(n=60)。两组人群年龄、BMI、收缩压、舒张压、血钾、FBG、TG、TC、早8点ACTH、早8点COR、卧立位PAC、卧立位ARR的差异无统计学意义(P>0.05),两组人群APA所占比率的差异无统计学意义(P>0.05)。见表2。

表2 观察组和验证组的临床特征比较
2.4 列线图
2.4.1列线图的建立 经单因素回归分析,BMI、血钾、双侧CT表现、卧位PAC、立位ARR及24 h UALD是IHA分型的危险因素(P<0.05);多重共线性分析后发现各因素VIF<10,彼此独立,无共线性问题。对其进行多因素logistic回归分析,发现3个指标差异有统计学意义,分别是BMI、血钾、双侧CT表现(P<0.05)。见表3。IHA的列线图模型建立在这3个变量上:BMI、血钾浓度及双侧CT表现(见图1,CT=0表示无双侧CT表现,CT=1表示有双侧CT表现)。

图1 基于BMI、血钾浓度和CT表现预测IHA的列线图
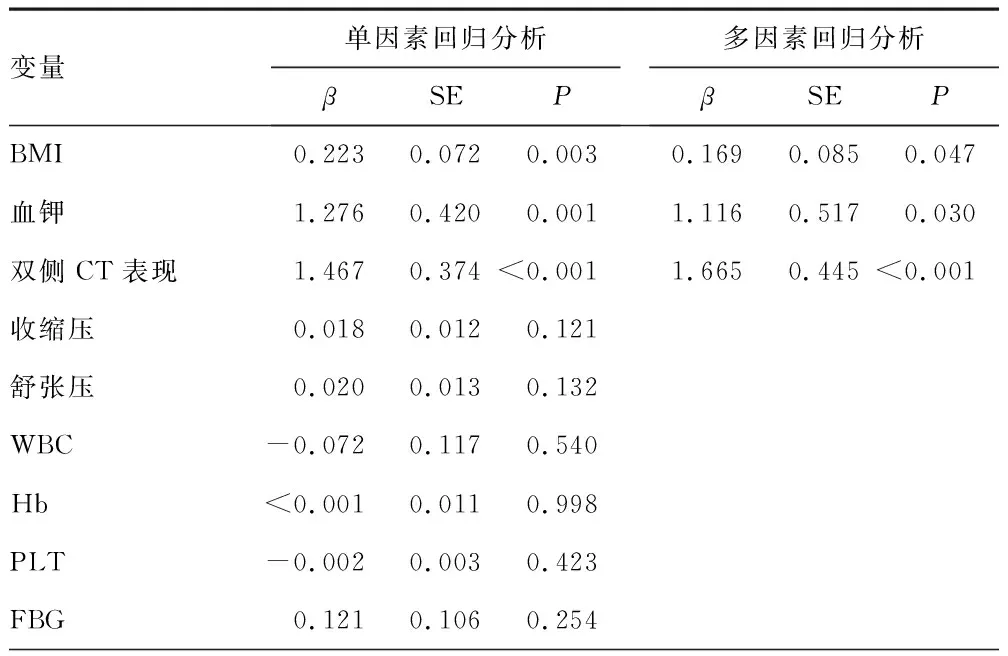
表3 对IHA分型的logistic单因素分析及多因素分析
2.4.2列线图模型的区分度和校准 分别计算观察组和验证组的ROC曲线下面积(area under the curve,AUC),观察组AUC=0.777(95% CI: 0.697~0.857,P<0.001),敏感度为67.30%,特异度为81.10%;验证组AUC=0.846(95% CI: 0.740~0.953,P<0.001),敏感度为85.70%,特异度为74.40%(图2A、B)。校准曲线提示预测IHA发生的概率和实际发生IHA的概率差距较小,一致性好(图2C、D),应用Hosmer-Lemeshow(H-L)test检验模型的拟合度,观察组P=0.479,验证组P=0.745。观察组及验证组P均≥0.05,表示模型的预测值拟合数据的观察值。

A为观察组的区分能力;B为验证组的区分能力;C为观察组的校准能力;D为验证组的校准能力。图2 预测IHA列线图的区分能力和校准能力
3 讨论
PA是继发性高血压的常见病因之一,既往认为PA发病男女之比大约为1∶2,近年来研究显示男女发病率并无太大差别[4]。本研究中男女比例约为1∶1.02,与文献报道相似。有研究显示PA患者以中年居多[5],本研究中204例患者,以40~60岁最多,占患者总人数的58.82%,与文献报道[6]一致。
PA临床表现主要为高血压、低钾血症及相关症状。本研究中,患者主要表现为高血压引起的头晕、头痛等症状。另外,低钾血症可导致肌肉无力等症状。本研究中,约60.78%的患者因低血钾出现四肢乏力,且严重低钾血症可引起室性早搏、室性心动过速、甚至心室颤动等心律失常。本研究中,35例阵发室上性心动过速患者经补钾处理后,复查心电图均未见异常。PA患者由于长期失钾,肾脏浓缩功能恶化,表现为多饮、多尿等。本研究中,约23.53%的患者出现多尿的症状。
APA与IHA为常见的2种PA亚型。有研究显示,APA患者的临床症状及生化异常较增生型PA患者明显且典型[7]。本研究中,APA组的血钾水平低于IHA组,与尹晓燕等[8]研究结果相符。
PA确诊后需明确分型,目前临床上一个重要分型方法为CT,其作为常规影像学检查,可显示病变部位和形态,但无法判断腺瘤是否具备功能。在鉴别IHA与APA方面,AVS目前被认为是PA症分型的金标准[7,9]。但是,AVS是侵入性检查,操作难度大,无法在国内临床中心普及。由于本院AVS引进时间有限,因此本研究进行分组时纳入了手术病理结果作为参考,即2006年在JAmCollCardiol杂志上发表的PASO研究[2]。
由于目前分型金标准AVS无法大范围推广,所以重要的是优化AVS的实施指征,减少行AVS的人数。既往的预测模型提出了多个预测因子,均包括双侧CT表现及血清钾;相关研究的几个临床评分,也证实了它们的分型作用[10-12]。另外在近年的一项研究中,低钾血症和单侧CT表现的患者极有可能出现AVS偏侧化[13]。PRA、PAC、ARR等参数并未纳入模型,可能是因为这些参数与亚型诊断无关[10,14]。本研究纳入了近年的新预测指标BMI,有报告称,BMI>25 kg·m-2是区分IHA和APA的独立风险因素[15]。另外,有研究也加入了BMI这一指标进行模型预测[16],但是他们的研究为单中心研究,还需其他研究进行验证。
BMI能作为预测指标可能与脂肪细胞的生理作用相关。研究发现,醛固酮与肥胖相关。Ehrhart-Bornstein等[17]报道,分离的人脂肪细胞分泌的产物可刺激人肾上腺皮质细胞分泌醛固酮。刺激醛固酮分泌的候选介质是补体C1q-肿瘤坏死因子相关蛋白1(complement C1q- tumor necrosis factor-related protein 1,CTRP1)、瘦素和抵抗素[18-20]。此外,有文章称肥胖患者出现的高胰岛素血症和高瘦素血症是交感神经激活的原因,交感神经活性的增加激活了肾素钙调肽系统[21]。另一方面,也有报道称醛固酮对脂肪成熟有重要作用[22]。因此,肥胖被认为是通过脂肪细胞因子的作用和交感神经系统的激活诱发醛固酮增多症,而醛固酮增多症也被认为是通过盐皮质激素受体激活促进脂肪成熟导致肥胖,从而形成恶性循环。原因可能为肥胖诱导产生脂肪细胞因子,如CTRP1、瘦素和抵抗素,它们通过肾素非依赖性途径升高醛固酮。醛固酮升高可增加循环血浆容量并抑制肾素活性。同时,肥胖也可通过交感神经系统的激活和肾素底物水平的增加来提高肾素活性。当前者超过后者时,ARR升高,出现IHA表型。
本研究中,BMI、血钾水平、双侧CT表现均对IHA有一定的预测价值,但单指标对IHA的预测效能有限。BMI、血钾、CT表现在临床中容易获得,且变化不大,很适合作为预测工具,因此本研究联合了这几个指标构建模型。本列线图模型AUC为0.777(95% CI 0.697~0.857),大于0.75,表明区分度较好。对模型进行Bootstrap自抽样内部验证,C-index为0.775,校准曲线显示该列线图的预测结果与实际结果之间的误差不大。总之,本研究显示,如果PA患者的BMI越高,血钾水平越高,且有双侧CT表现,那么患者分型为IHA的概率就越高。

