尤瑞克林不良反应文献分析及临床应用监护流程
柴东燕,徐成阳,阚亦菲,赵成龙,张楠楠,马培志,乔利景,王艳玲,段红艳b,
(1.河南省人民医院 a.药学部;b.全科医学科,河南 郑州 450003;2.河南省国际医疗中心,河南 郑州 450003;3.宁陵县中医院 药学部,河南 商丘 476700)
尤瑞克林是从人尿液中提取的蛋白水解酶,主要成分为人尿激肽原酶,可将激肽原转化为激肽和血管舒张素,舒张动脉,并抑制血小板聚集,是我国自主研发的一种治疗急性脑梗死的药物,2005年仅在中国上市,目前是临床上常用的脑梗急性期用药。该药品说明书中提示药品不良反应(adverse drug reactions,ADRs)发生率大约为6.7%,实际应用中报道的ADRs发生率在5.45%~26.67%[1-4],严重时甚至发生过敏性休克[1,5-8]。该药的临床应用过程中也存在一些误区:如配制浓度,滴速,降压药物的选择等。既往文献报道的ADRs多为案例报道,一篇关于尤瑞克林有效性和安全性的meta分析[9]仅概括了ADRs的具体表现,缺乏对影响因素的细致分析,更未系统地提出全面的不良反应防范措施。本研究通过1例尤瑞克林引起低血压休克的不良反应上报,对现有尤瑞克林ADRs的案例报道进行汇总复习,梳理临床应用全程中存在的风险点并提出防范措施,规范药物临床应用,保障用药安全。
1 资料与方法
1.1 资料来源本研究检索了国内尤瑞克林注射液ADRs的案例报道,检索时间为2005年5月至2022年5月,检索方法为在中国生物医学文献数据库、中国期刊全文数据库、中文科技期刊数据库、中华医学期刊全文数据库、中国知网、维普网及万方数据库上检索“尤瑞克林”“不良反应”“安全性”和“过敏性休克”的文献并进行汇总(表1),因该药未在国外上市,未检索外文文献。

表1 尤瑞克林ADRs文献汇总
1.2 文献纳入/排除标准(1)纳入标准:尤瑞克林不良反应详细描述的文献;研究类型包括个案报道或病例报道,及对ADRs详细描述的临床研究。(2)排除标准:①对ADRs描述不清的研究,例如安全性的队列研究;②重复发表的文献;③二次文献研究,例如meta分析;④基础实验研究、综述、摘要类文献。检索文献38篇,排除28篇,最终纳入10篇。
1.3 统计分析方法提取纳入文献的相关信息,统计患者年龄、性别、滴速、出现ADRs时间、症状、处理方式、结果及ADRs分级[10]。
2 结果
2.1 检索结果纳入的10篇ADRs报道,5篇为系列报道,5篇为个案报道;涉及患者23例,其中男10例,女6例,7人未记录性别;年龄45~80岁,平均(63.75±8.59)岁。
2.2 分析结果
2.2.1ADRs分级情况 Ⅰ级ADRs 6例,临床表现多为面部潮红和腹部症状;Ⅱ级ADRs 5例,临床表现为恶心、呕吐、腹泻、胸闷、烦躁、上消化道出血、喉部收紧感,停药均后可自行缓解;Ⅲ级ADRs 3例,主要表现为发热、恶心、呕吐等,给予对症处理后缓解;Ⅳ级ADRs 9例,均出现血压下降。见表2。

表2 尤瑞克林的ADRs表现及处理方式
2.2.2ADRs发生时间 13例(56.52%)患者在首次用药即出现不良反应;在Ⅳ级ADRs中,8例发生在首次用药(88.89%),8例发生在输液开始的前10 min内,1例发生在用药1 h后。见表3。
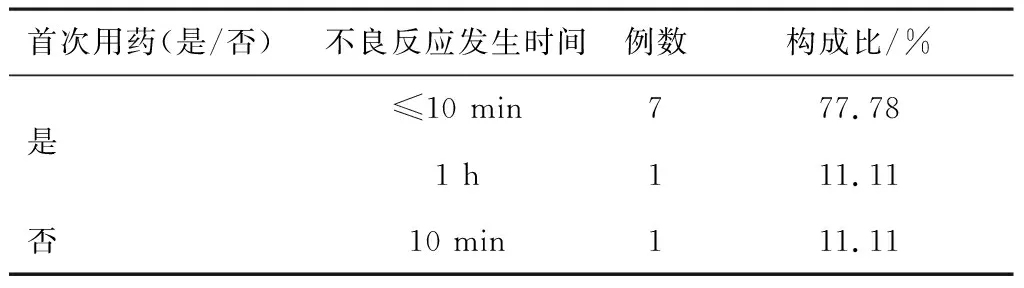
表3 尤瑞克林Ⅳ级ADRs发生时间
2.2.3合并用药情况 9例无是否应用血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)类药物的记录。3例明确联用ACEI,其中1例患者连续2日晨起均自行服用了贝那普利片0.01 g,均发生临床表现相同的Ⅰ级ADRs,停用尤瑞克林后缓解[11],另外2例服用卡托普利片,输注尤瑞克林10 min出现休克症状。
2.2.4用药速度 12例报道中未描述滴速,其余记录的滴速为25~50滴·min-1。
3 讨论
3.1 尤瑞克林用药风险点梳理及用药建议
3.1.1明确患者用药史 尤瑞克林说明书中的药物相互作用项下提示:禁止与ACEI联用。在临床中会遇到医生将血管紧张素受体抑制剂(angiotensin receptor inhibitor,ARB)类药物也停用的情况,这是一种误区。尤瑞克林与ACEI禁止合用的机制分析如下:血管紧张素转化酶(angiotensin converting enzyme,ACE)可催化肽类扩血管物质的降解,因此,ACEI能增加缓激肽和胰腺肽的浓度[12]。尤瑞克林能增加2种缓激肽受体的表达[13],与ACEI合用可使体内缓激肽水平增高,作用于缓激肽受体效应增加而发挥协同扩张血管作用,进而导致血压下降,而与其他降压药物协同降压作用不明显,因此无需禁用ARB类药物。
临床常见的ACEI类药物有:卡托普利、贝那普利、培哚普利等。因为药物在体内消除大约需要5个半衰期(t1/2),ACEI类药物t1/2为3~12 h,建议停用ACEI类3 d后再开始应用尤瑞克林。尤瑞克林t1/2为156~197 min,故应在末次使用尤瑞克林24 h后再开始启用ACEI类降压药物[14]。
用药建议:使用尤瑞克林之前建议询问患者3 d内是否服用过ACEI类药物,停用尤瑞克林24 h后再重新启用。
3.1.2注射液的配制 尤瑞克林说明书中的注射液项下提示:0.15 对硝基苯胺(p-Nitroaniline,PNA)溶于100 mL 9 g·L-1氯化钠注射液,即配即用。Lieberthal等[15]发现阳离子(钠、钾、镁离子)可以增加人激肽原酶的活性,这可能是选用生理盐水作为溶媒的原因。李蕴博等[3]发现将溶媒量由100 mL改为250 mL后,不仅临床疗效差异无统计学意义,还避免了不良反应的发生。因为尤瑞克林是从新鲜人尿中提取精制的一种由238个氨基酸组成的糖蛋白,建议即配给用。
用药建议:0.15 PNA溶于≥100 mL氯化钠注射液,即配即用。
3.1.3输注速度 尤瑞克林说明书中的给药方式说明项下提示:滴速不可过快,尤其在开始注射的15 min内应缓慢,滴注时间不少于50 min,可根据患者情况增加溶媒和(或)减慢滴速。该药的Ⅲ期临床试验中已发现滴速和不良反应发生相关,尤其是滴注的前5 min[16],除外与ACEI类药物相互作用外,可能与临床操作相关,例如在静脉穿刺成功针头固定后或更换液体后观察一段时间再进行滴速的调整,因此,很可能在调速前的滴速过快而发生ADRs。本研究案例汇总分析显示,12例(52.17%)未报道滴速情况,表明在药物应用过程中容易忽视滴速问题。王福花[2]将医院收治的90例采用尤瑞克林治疗的急性脑梗死患者作为研究对象,开展了一项随机对照试验,发现减慢滴速可以显著降低ADRs的发生率。
用药建议:在用药时的前15 min内调整滴速为30滴·min-1左右,如未见不适改为40~50滴·min-1[3],静滴总时间不少于50 min。
3.1.4输注监护要点 尤瑞克林药品说明书特别提示刚开始注射的15 min内应密切关注患者的血压。Nakayama等[17]研究发现,尤瑞克林在输注前15 min内血药浓度迅速升高,随后上升速度变慢,约30 min达到峰值。尤瑞克林本身为一种蛋白制剂,它影响的激肽释放酶-激肽系统涉及诸多生理和病理过程,例如血压调节、炎症反应、心血管稳态、痛觉传递、细胞因子释放、前列环素代谢等[18]。黑明伟[8]排除了配置因素的影响、年龄、药物相互作用因素后,考虑可能和药物本身相关。本研究通过ADRs案例汇总分析,发现56.52%患者在首次用药即出现ADRs,88.89% Ⅳ级 ADRs也发生在首次用药,8例(88.89%)Ⅳ级ADRs发生在输注10 min内。张蕊等[7]个案报道首次用药1 h后发生过敏性休克。因此,对于所有首次应用尤瑞克林的患者应全程警惕药物ADRs的发生,再次用药输注前15 min内应密切关注患者。一篇meta分析[9]提示,轻度血压下降占所有ADRs的36%,其次为面部潮红(23%)、球结膜充血(20%)和恶心、呕吐伴心悸。
用药建议:首次用药全程密切监护血压、皮肤、眼结膜、胃肠道症状,再次用药重点监护输注前15 min。
3.1.5关注特殊人群 尤瑞克林通过肝脏代谢成低分子产物后通过尿液排出,老年人器官功能下降,对药物的适应性和应变能力减弱,使ADRs发生率升高,因此对于老年人或肝、肾功能不全的患者建议延长滴注时间。
3.2 ADRs的处理较轻症状,例如:颜面潮红和脸部发热感、呕吐、头痛、腹泻、结膜充血、心慌胸闷、注射部位红痒等症状,建议立即减慢滴速,测量血压,必要时停药,同时关注药物配置情况、患者肝肾功能及合并用药情况,一般给予对症治疗后均可缓解[19]。如果患者情况持续未缓解,应立即告知医生。严重的ADRs,如:过敏性休克、癫痫发作等,应立即给予急救抢救处理。
3.3 尤瑞克林临床用药监护流程的建立通过对尤瑞克林的ADRs案例报道的复习及相关机制分析,从药物相互作用、配制方法、输注速度、监护时间等方面整理了尤瑞克林的临床用药风险,经过多学科讨论,构建了尤瑞克林用药风险防范措施,并制定了尤瑞克林临床用药监护流程图,方便查阅和学习。见图1。
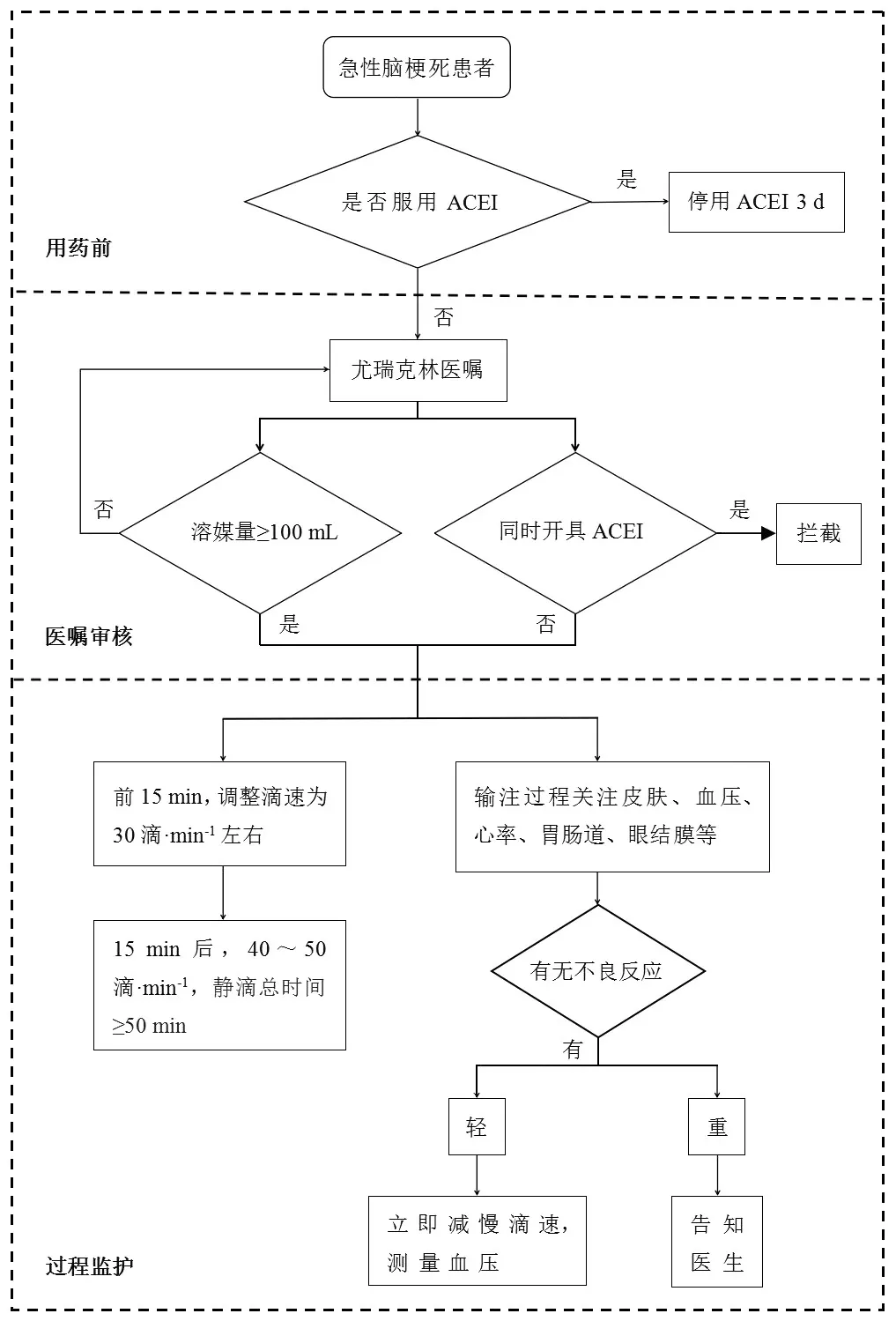
图1 尤瑞克林临床应用监护流程图
综上所述,ADRs是指合格药品在正常用法用量下出现的与治疗目的无关的有害反应。ADRs可以影响患者的健康与生活,并带来经济上的损失,降低ADRs诊治成本的主要途径是防止不良反应的发生[20]。通过分析影响用药安全的主要因素,建立系统化措施来规避用药风险。本研究通过1例严重ADRs的上报,对既往尤瑞克林ADRs案例报道进行汇总复习,从用药史的确认、药物的配置、输注过程的注意事项等全流程梳理风险点,并提出相应的防范措施,编辑相应的医嘱审核规则嵌入医嘱录入系统中,多学科团队共同制定尤瑞克林注射液临床应用监护流程方便查阅、学习和推广实施。临床药师从ADRs的简单上报转变为深入思考如何避免ADRs的发生,让安全用药工作从开具医嘱前就进入风险防范系统,真正实现全程保障临床用药安全的目标。

