基于网络药理学研究萘哌地尔衍生物YMⅢ降压作用及机制初探
李冬梅,边梦霓,侯毅杰,董永和,马俊兵,邱敏,杨征
(包头医学院,内蒙古 包头 014040)
高血压已成为威胁全球公共卫生安全的重大隐患之一。长期高血压容易诱发各种心脑血管疾病,造成心、脑、肾等重要靶器官损害,最终导致器官衰竭。目前经典的降压药无法满足难治性高血压人群的降压目标值。因此,迫切需要进一步探索高血压发生发展的新机制和更有效的降压药物。
萘哌地尔为国内批准的一类降压药,通过特异性α1肾上腺素受体拮抗、钙离子通道阻断、5-HT1A激活等作用介导血管扩张,发挥降压作用[1,2]。鉴于其降压作用有限,中国科学院贵州省天然药物化学重点实验室通过加工修饰萘哌地尔侧链,人工合成萘哌地尔衍生物YMⅢ,如图1 所示(R 为保密基团)。本课题组前期研究表明YMⅢ具有拮抗α1-AR及抑制VSMC 增殖的作用[3,4],对于其降压机制的系统性研究报道国内外罕见。作为当前热门的新兴学科,网络药理学是以网络生物学、药理学、生物信息学、系统生物学等相关学科为基础,通过构建生物网络来研究疾病发病机制,并全面剖析药物干预疾病的分子关联机制,破除了传统医学“一靶标一疾病一药物”治疗模式的局限性,为疾病高效治疗和新药开发提供新思路新方法[5,6]。本课题运用网路药理学方法,阐述YMⅢ在高血压治疗中发挥关键作用的靶点、分子途径和生物过程,分析YMⅢ的降压机制,并通过实验加以验证,为推进新型降压药物的发现和应用提供参考。

图1 YMⅢ结构图Fig.1 YMⅢstructure diagram
1 材料与方法
1.1 化合物靶点预测
从PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载萘哌地尔2D 格式化学结构,输入到Swiss Target Prediction(Gfeller et al.,2013;Daina et al.,2019)(http://www.swisstargetprediction.ch/),经去支链、保主链处理(即为YMⅢ主要研究结构),物种选择“智人”,取预测分数大于0的靶点作为YMⅢ药理靶点。SwissADME(swissadme.ch)为检索化合物物理化学性质、药代动力学、药物相似性和药物化学友好性的网络工具,为新药的开发和临床应用提供重要信息[7]。通常药代动力学分析,胃肠道吸收高和药物相似性分析中超过3 个“是”,“0”违规,证明该化合物具有活性[8]。将药物靶点导入UniProt(https://www.UniProt.org/)数据库,规范基因名称。
1.2 疾病相关靶点识别
以Gene Cards(http://www.genecards.org/)人类基因数据库作为搜索疾病靶点工具,以“高血压”为关键词,筛选高血压靶点,再以前述同样方式经UniProt规范基因名称。
1.3 PPI网络构建
将筛选的疾病和药物靶点导入Draw Venn Diagram(http:// bioinformmatics.psb.ugent. be/webtools/venn/)获取交集靶点。STRING 数据库(https://STRINGdb.org/)用来检索已知和预测的蛋白质与蛋白质之间关联,将交集基因导入该数据库,物种选择“智人”,最高置信度蛋白互交参数评分值>0.4,默认其他参数设置,去掉网络中的游离节点后,将蛋白互作数据传入Cytoscape 3.8.2 进行拓扑分析并构建PPI网络,预测YMⅢ抗高血压的重要靶点。
1.4 GO和KEGG富集分析
通过DAVID(https://DAVID.ncifc rf.gov/)进行基因本体(GO)功能富集分析、京都基因和基因组百科全书(KEGG)途径富集分析,探索YMⅢ抗高血压涉及的生物过程和相关信号通路,P<0.05 视为参考范围。通过微生信(http://www.bioinformatics.com.cn)在线作图工具直观展示基因功能与通路富集结果。
1.5 分子对接
分子对接用于预测小分子化合物与目标蛋白的结合能力。YMⅢ骨架结构(去掉R 集团)作为小分子化合物获取SDF 格式,其3D 结构在RCSB PDB数据库(http://www.rcsb.org/)中获取。分子对接所涉及的配体和蛋白质由Auto Dock 软件(http://vina.scripps.edu/)实现,对目标蛋白进行去除水分子、加氢、修饰氨基酸、优化能量和调整力场参数,之后利用PyRx 软件内部的Vina 进行虚拟筛选,配体和受体间的结合能力通过Binding Affinity(kcal/mol)值表示,数值越低表示结合越稳定,最后使用DS2019软件作图。
1.6 实验药品与试剂
YMⅢ:由中国科学院贵州省天然药物化学重点实验室提供,纯度为99%,用无水乙醇超声溶解,使用前用三蒸水稀释配制成所需浓度;重酒石酸去甲肾上腺素(NA)、咖啡因(Caffeine):美国Sigma 公司产品,纯度均为99%,使用时用三蒸水配制;正常Krebs保养液的组成(mmol·L-1):NaCl 120.0 mmol·L-1、KCl5.4mmol·L-1、CaCl22.2mmol·L-1、MgSO47.0mmol·L-1、H2O 1.0 mmol·L-1、NaHCO325.0 mmol·L-1、葡萄糖(C6H12O6)5.6 mmol·L-1、溶液pH 7.4;无钙Krebs保养液的组成(mmol·L-1):不含CaCl2,并加入EGTA 0.5 mmol·L-1,其他同正常Krebs保养液。
1.7 动脉血管条制备
家兔体质量(2.3±0.4)kg,雌雄兼用。木棒击头致昏后即刻取出胸主动脉,用棉签擦拭并去除内膜,剪成约长20 mm、直径2.5 mm 的螺旋条,投放于含有Krebs 营养液20 mL 的恒温(37 ℃)水浴槽中,持续通入95 %O2+5 %CO2混合气体,pH 7.3~7.4,静息负荷2 g,每隔15 min 更换营养液1 次,反复冲洗,平衡90 min 后给药观察。血管的收缩经张力换能器连接于XWTD-204 台式自动平衡记录仪记录之。实验中所用药物浓度均按最终浴槽浓度计算。
1.8 YMⅢ对NA 所致动脉血管收缩效应的影响
在浴槽内加入NA 10-6mol·L-1,待动脉条收缩至坪值后冲洗,平衡1 h 后,以同法加入同量的NA,重复数次至收缩高度前后两次基本不变,视为动脉条的收缩已达稳定。平衡1 h 后,用无Ca2+Krebs 冲洗,稳定3 min,再加入NA 10-6mol·L-1,可见动脉条产生迅速而短暂的收缩。待其舒张平稳后,累计加入CaCl21.1 mmol·L-1,2.2 mmol·L-1,可见随Ca2+浓度增加,动脉条再次收缩并达峰值,此为药前对照。然后用正常Krebs反复冲洗,平衡1 h,加入无Ca2+Krebs液,同时加入不同浓度YMⅢ(10-8、5×10-8、10-7mol·L-1),稳定3 min,重复上述实验。实验结束前再做一次无Ca2+NA 收缩对照,将血管条收缩高度与给YMⅢ前基本一致的收入统计资料。
1.9 YMⅢ对咖啡因所致动脉血管收缩效应的影响
在正常Krebs 液浴槽内加入KCl 50 mmol·L-1,使动脉条平滑肌细胞内Ca2+负载,并产生一定的收缩,再用无Ca2+Krebs 液置换正常Krebs 液,3 min 后加入咖啡因60 mmol·L-1,见动脉条产生迅速而短暂的收缩,以此为药前对照。用正常Krebs液反复冲洗并平衡1 h,重复上述实验,但在加入无Ca2+Krebs液的同时加入YMⅢ,然后再加入等量咖啡因。实验结束前再做一次无Ca2+咖啡因收缩对照,将血管条收缩高度与给YMⅢ前基本一致的收入统计资料。
1.10 统计学方法
全部资料的整理、分析均用SPSS 24.0统计学软件。实验数据以(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。检验水准为α=0.05,P<0.05表示差异具有统计学意义。
2 结果
2.1 化合物靶点获取
共获得104 个YMⅢ预测靶点,且YMⅢ符合经SwissADME 评估的药代动力学标准,具备成药开发潜力。预测靶点在规范基因名后得到104 个YMⅢ药理靶点,呈现的化合物-靶点网络(见图2a)有105 个节点(1 个化合物节点,104 个目标节点)和104 条边。

图2 药物-靶点-疾病网络图Fig.2 Drug-target-disease network diagrama 化合物-靶点网络;b 疾病-靶点网络;c YMⅢ和高血压靶标的venn 图;d 蛋白质-蛋白质相互作用网络。节点面积由大到小和颜色由深到浅代表度值的降序。a Compound-target network; b Disease-target network; c The Venn diagram of YMⅢand Hypertension targets;d Proteinprotein interaction network. The node area from large to small and color from dark to light represent the descending order of degree values.
2.2 高血压靶点筛选
共得到8 968 个高血压靶点,靶点相关性评分≥中位数为标准并连续筛选,最终确定“相关性评分>1.074131489”为标准筛选疾病靶点,并通过Uniprot进行基因名称规范,最终获得2 286 个研究相关的高血压靶点,见图2b所示疾病-靶点网络。
2.3 蛋白互作网络图构建和关键靶点筛选
2286 个疾病靶点和104 个药物靶点经Venn 分析得到46 个交叉靶点(见图2c),视为YMⅢ治疗高血压的潜在作用靶点。将交叉靶点导入STRING,去除游离节点UTS2R 和TACR3 后经Cytoscape 软件的“Analyze Network”模块进行拓扑分析,计算网络节点度值,构建出拥有44 个节点、125 条边的PPI网络(见图2d),节点颜色越深度值越大,表示节点越重要,度值较高的靶点依次是SLC6A4、SRC、SLC6A3、CHRNA7、EGFR、DRD2、PRKCB、HTR2A、JAK2、AR、PRKCD、ADRA2A、ADRA2C、HTR2A、HTR1A,可能在YMⅢ抗高血压中发挥重要作用。
2.4 GO和KEGG富集分析和靶点-通路网络搭建
将46 个交集靶点导入DAVID 数据库,物种选择“智人”。GO富集结果显示,共有179 个生物过程(BP)、30 个细胞组分(CC)和50 个分子功能(MF);共有42 条具有统计学意义的KEGG富集通路。根据P值大小取前10 个条目经微生信在线作图(见图3)。结果显示,YMⅢ的降压作用主要通过目标靶点对腺苷酸环化酶激活肾上腺素能受体信号通路、MAPK级联的正调节、突触囊泡胞吐作用调控、胞浆钙离子浓度正调节、细胞钙离子稳态、对药物的反应、血管收缩的正调节等生物过程的调节实现。这些生物过程的调节主要由神经活性受体配体相互作用、钙信号通路、缝隙连接、TRP 通道的炎症介质调节、多巴胺能突触等信号通路介导完成,为了直观展现目标靶点与主要信号通路的相互作用关系,构建图4所示的靶点-通路图,我们发现神经活性受体配体相互作用通路与目标靶点关联最多,可能是YMⅢ治疗高血压的关键通路。
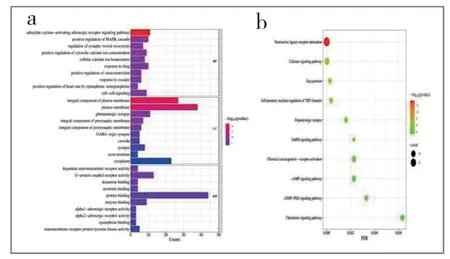
图3 GO和KEGG富集分析Fig.3 GO and KEGG enrichment analysisa GO富集分析(BP:生物过程,cc:细胞组分,MF:分子功能);b KEGG富集分析。a GO enrichment analysis(BP:Biological Process,cc:Cellular Component,MF:MolecularFunction);bKEGGenrichmentanalysis.

图4 靶点-通路网络图Fig.4 Targets-pathways network diagram黄色节点代表靶点,紫色节点代表作用通路。yellow nodes represent targets,and purple nodes represent pathways of action.
2.5 分子对接
YMⅢ骨架结构作为小分子化合物,交集基因中选取度值≥7 的13 个关键靶点作为对接受体(未找到SLC6A3蛋白结构,不纳入受体组),对接结果证实化合物能够与关键靶点紧密结合(见表1、图5),进一步验证了YMⅢ的抗高血压作用。
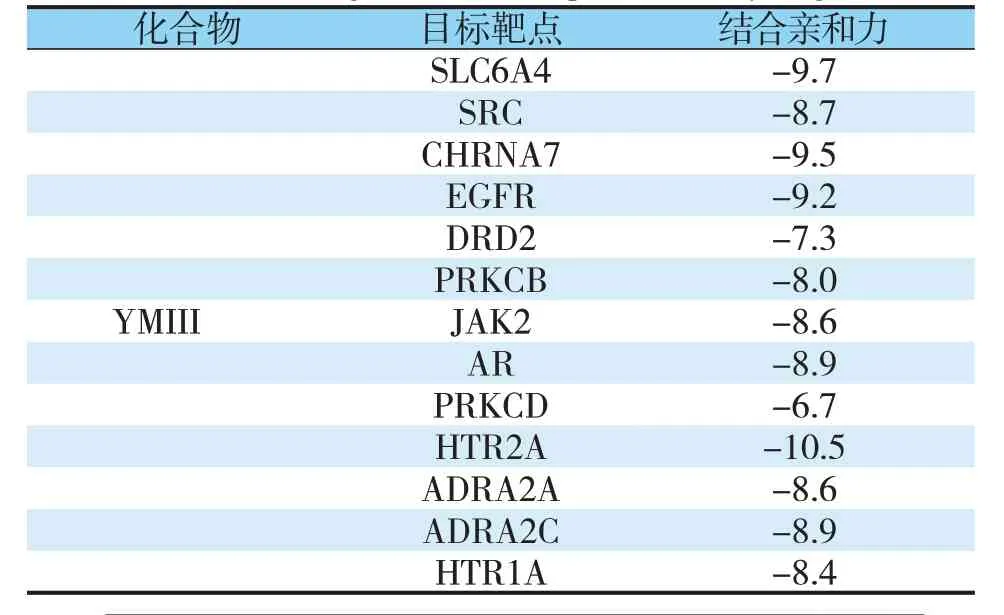
表1 化合物与关键靶点的对接结果Tab.1 Docking results of compounds to key targets

图5 YMⅢ和关键靶点分子对接结果Fig.5 Docking results of YMⅢand key target moleculesa 溶质载体家族6 成员4;b 原癌基因酪氨酸蛋白激酶SRC;c 胆碱能受体烟碱α;d 表皮生长因子受体;e 多巴胺受体D2;f 蛋白激酶C,β;g Janus激酶2;h 雄激素受体;i 蛋白激酶C,δ;j 5-羟色胺受体2A;k 肾上腺素受体α2A;l 肾上腺素受体α2c;m 5-羟色胺受体1A。a SLC6A4;b SRC;c CHRNA7;d EGFR;e DRD2;f PRKCβ;g JAK2; h AR;i PRKCδ;j HTR2A; k ADRA2A;l ADRA2C; m HTR1A.
2.6 萘哌地尔衍生物YMⅢ对NA 所致动脉血管收缩效应的影响
结果表明,与无Ca2+液中NA所致血管条短暂收缩对比,YMⅢ10-8、5×10-8、10-7mol·L-1组对血管条的收缩均呈显著抑制作用,对复Ca2+后NA诱发的血管条持续收缩,同量的YMⅢ组对血管条收缩也有抑制效应(P<0.05)(见图6)。

图6 YMⅢ对NA所致动脉血管收缩效应的影响Fig.6Effect of YMⅢon NA-induced arterialvasoconstriction effecta NA组和YMIII组在无Ca2+和复Ca2+条件下的血管收缩曲线图;b 无Ca2+条件下YMⅢ对NA引起动脉血管收缩的影响;c 1.1 mmol·L-1 Ca2+条件下YMⅢ对NA引起动脉血管收缩的影响;d 2.2 mmol·L-1 Ca2+条件下YMⅢ对NA引起动脉血管收缩的影响,*P<0.05;**P<0.01。a Vasoconstriction curves in the NA and YMⅢgroups under Ca2+-free and Ca2+-loading conditions;b Effect of YMⅢon NAinduced arterial vasoconstriction under Ca2+-free conditions;c Effect of YM Ⅲon NA-induced arterial vasoconstriction under 1.1 mmol·L- 1 Ca2 +conditions;d Effect of YMⅢon NA-induced arterial vasoconstriction under 2.2 mmol·L- 1 Ca2 + conditions,*P<0.05;**P<0.01.
2.7 萘哌地尔衍生物YMⅢ对咖啡因所致动脉血管收缩效应的影响
结果显示,在无Ca2+液中咖啡因可使血管条收缩,加入YMⅢ10-5mol·L-1后对血管条收缩没有抑制作用(P>0.05)(见图7)。
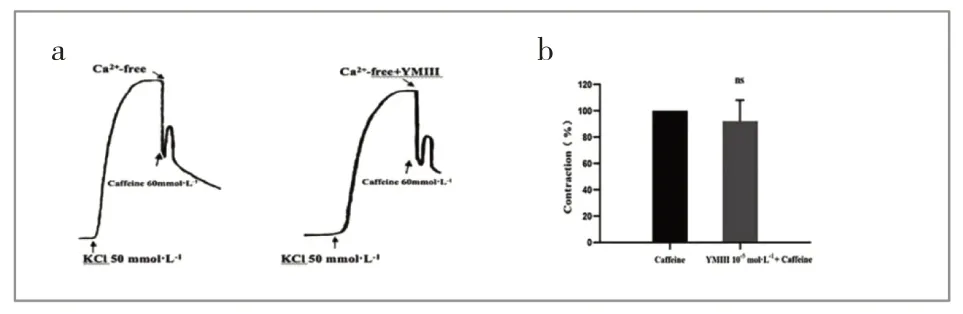
图7 YMⅢ对咖啡因所致动脉血管收缩效应的影响Fig.7Effect of YMⅢon caffeine-induced arterial vasoconstriction effecta 咖啡因组和YMⅢ组在无Ca2+条件下的血管收缩曲线图;b 无Ca2+条件下YMⅢ对咖啡因引起动脉血管收缩的影响,ns:差异无统计学意义。a Vasoconstriction curves in the caffeine group and the YMⅢgroup under Ca2+-free;b Effect of YMⅢon caffeine-induced arterial vasoconstriction under Ca2+-free conditions,ns:Not statistically significant.
3 讨论
高血压是一种常见的由神经、体液、免疫炎症、胰岛素抵抗等多因素共同参与形成的慢性疾病。其特点是血管持续收缩、血容量增多、内皮功能障碍和动脉硬化。因此,降低交感活性、抑制RASS 系统和免疫调节等方式成为高血压治疗的关键。虽然针对特定发病机制的降压药物不断涌现,但目前全世界仅有不足14%的高血压群体降压达标[9],因此迫切需要开发可调控多种高血压发生发展机制的具有高效降压特点的新型降压药。而网络药理学方法具有挖掘尚未开发物质与疾病之间复杂关系的特性,因此,网络药理学成为新药开发的重要手段。
前期研究表明YMⅢ具有抗α1-AR 及抗VSMC增殖作用,血管平滑肌细胞增殖和血管高收缩性与高血压发生发展密切相关[10],由此认为YMⅢ可能具有抗高血压作用,但目前关于YMⅢ降压机制的阐述尚未完全明确。因此,本课题组通过网络药理学深度挖掘YMⅢ与高血压之间的复杂关系,分析其降压机制,并通过实验来验证预测。
经数据库筛选共获得104 个YMⅢ靶点和2 286个高血压靶点,确定了46 个潜在的治疗靶点。图2d 所示,SRC、SLC6A4、SLC6A3、CHRNA7、EGFR、PRKCB、JAK2、DRD2、HTR2A、AR、PRKCD、ADRA2A、ADRA2C、HTR1A、HTR2A 节点度值较大,是YMⅢ抗高血压的重要治疗靶点。分子对接进一步证实YMⅢ与重要靶点紧密对接以发挥其药理作用。为进一步阐明46 个潜在治疗靶点的功能及分子途径,进行了GO和KEGG富集分析。结果显示,YMⅢ通过调节多条信号通路介导的多种生物过程干预高血压,其中神经活性配体受体相互作用通路可能是YMⅢ控制血压的最关键通路。综上所述,YMⅢ能够通过多靶点、多途径作用于高血压的多个病理生理机制,表现出YMⅢ降压的全面性。
如图4 所示,主要信号通路密切相关的靶点有PRKCB、PRKCD、SRC、ADRB1、ADRA1D、ADRA1A、ADRA1B、DRD1、DRD2、DRD5、HTR2A、EGFR、MAPK14、PTGER2、CHRNA7。其中ADRA1D、ADRA1A、ADRA1B 是α1-AR 的三种亚基因型,对维持血压稳定至关重要,α1a-AR 在阻力动脉中显著表达,发挥明显升压作用[11]。ADRA1D、ADRA1A、ADRA1B 是神经活性配体受体相互作用通路中的关键基因,广泛存在于血管平滑肌细胞。其作为G 蛋白偶联受体超家族成员,激活PLC-IP3 信号通路,使细胞内Ca2+含量增加,收缩血管[12~14]。在高血压疾病中,各种因素导致交感神经系统过度激活,通过α-AR 介导血管收缩,增加血压[15]。因此,预测YMⅢ通过调节α 肾上腺能受体-配体间的相互作用发挥降压功能。
血管平滑肌细胞内Ca2+浓度上调主要通过肌质网钙释放和细胞外Ca2+内流两种方式,PLC 激活相关IP3受体和Ca2+,诱导Ca2+释放(CICR)相关的兰尼碱受体(RyR)是肌质网重要的两种Ca2+释放通道[16,17]。本实验中,YMⅢ抑制无钙液中NA 诱导的血管收缩,对咖啡因诱导兰尼碱受体(RyR)激活介导的血管收缩无抑制作用,说明YMⅢ可能对响应于肾上腺素能受体的PLC-IP3 介导的Ca2+释放有抑制作用;复Ca2+后NA 介导血管持续收缩,该过程中激动剂诱导GPCR-PLCβ 信号通路激活并形成IP3、DAG,IP3、DAG参与调控受体操作Ca2+通道(ROCC)和存储操作Ca2+通道(SOCC)并介导细胞外钙内流,维持血管平滑肌持续活化[18~20],YMⅢ抑制复Ca2+后的血管收缩,说明YMⅢ对肾上腺素受体激活依赖的维持细胞内Ca2+稳态所必需的Ca2+内流通路也有抑制作用。因此,考虑YMⅢ可能通过对肾上腺素受体-配体结合的抑制,调节细胞内的Ca2+稳态,从而调节血管收缩和血压,同时也验证了网络药理学的预测。
该实验仅对YMⅢ抗高血压的单一途径进行验证,钙信号通路、缝隙连接、TRP 通道的炎症介质调节、多巴胺能突触等信号通路与高血压的治疗密切相关,还需要进一步的实验验证。
4 结论
我们通过网络药理学研究和分子对接验证,YMⅢ通过多靶点、多途径干预高血压的发生发展,体外实验进一步证实YMⅢ主要通过调节α 肾上腺素受体参与的神经活性受体配体相互作用信号通路发挥降压作用,为YMⅢ抗高血压作用提供了理论依据,并为高血压的治疗提供新思路。

