基于蛋白质相对分子质量与二级结构的阿胶珠炮制程度评价方法研究
阿娜尔,刘 芬,许铭珊,孙 静,李 宇,陈建波,董 玲*
(1.北京中医药大学中药学院,北京 102488;2.北京中医药大学生命科学学院,北京 102488)
阿胶为马科动物驴(Equus asinus L.)的干燥皮或鲜皮经煎煮、浓缩制成的固体胶,具有补血滋阴、润燥、止血等功效。《中华人民共和国药典》2020 年版[1](以下简称《中国药典》2020 年版)收录了阿胶、阿胶珠两种饮片规格。阿胶珠为阿胶丁加蛤粉烫制而成,能降低滋腻之性,矫正不良气味,便于调剂与服用,还能借蛤粉增强清热化痰之功效[2,3]。蛋白质和多肽是阿胶中的主要活性成分[4],蛋白质受热易发生变性,阿胶丁加热膨化为阿胶珠时,若加热不足,蛋白质变性不够,则阿胶丁无法充分膨化,内含溏心;若加热太过,蛋白质严重热解,则阿胶珠焦化,药效降低。现行药典及地方炮制规范对于阿胶珠炮制程度均缺少量化评价指标,故建立阿胶制珠炮制程度量化评价指标,有助于完善阿胶珠炮制规范,可有效控制并优化阿胶珠生产工艺及成品质量。因此,本研究尝试利用凝胶渗透色谱(gel permeation chromatography,GPC)表征蛋白质相对分子质量分布,利用傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)表征蛋白质二级结构,以反映阿胶受热后的蛋白质变性程度。探索根据蛋白质相对分子质量与二级结构评价阿胶珠炮制程度的可行性。
1 材料与方法
1.1 实验材料
阿胶珠A(采购于北京某药房);阿胶珠B、C、D(分别采购于3家四川制药公司);阿胶(由阿胶珠D的生产厂家提供);牛血清白蛋白(纯度:96%,相对分子质量约6.64×104Da,上海源叶生物科技有限公司);细胞色素C(纯度:95%,相对分子质量约1.25×104Da,北京万佳标准物质研发中心);磷酸二氢钠(AR,北京化工厂);氢氧化钠(AR,天津市大茂化学试剂厂);纯净水。
1.2 阿胶珠水分与灰分测定
取适量阿胶珠样品粉末,用DSH-50A-1型卤素快速水分测定仪(上海佑科)测定其水分含量。
按《中国药典》2020年版[1]四部通则2302进行总灰分含量测定。
1.3 阿胶珠溶化性测定
在250 mL 烧杯中注入200 mL 80 ℃热水,称取2.95~3.05 g阿胶珠,放入烧杯后不断搅拌,记录阿胶珠全部溶解所需要的时间,静置后观察烧杯底部沉淀量。
1.4 凝胶渗透色谱(GPC)
1.4.1 对照品溶液 取牛血清白蛋白、细胞色素C标准品适量,精密称定,加水制成每1 mL 含牛血清白蛋白1.0 mg、细胞色素C 1.0 mg 的混合溶液,用0.45 μm水系微孔滤膜滤过,即得。
1.4.2 供试品溶液 取阿胶或阿胶珠样品250 mg,加水约20 mL,超声(300 W,50 kHz)处理1 h,放冷,加水定容至25 mL,摇匀,用0.45 μm 水系微孔滤膜滤过,即得。
1.4.3 色谱仪器与条件 本研究所用色谱系统为LC-20AT高效液相色谱仪、SPD-M20A紫外检测器、SIL-20A 自动进样器(日本岛津),色谱柱为TSKgel G4000PWXL(7.8mm30cm,10μm),流动相为0.05mol·L-1、pH=7.2 的磷酸盐缓冲溶液,流速0.4 mL·min-1,柱温25 ℃,检测波长280 nm,进样体积5 L。
方法学考察:分别取对照品溶液、供试品溶液及磷酸盐缓冲溶液按照上述条件进行测定,谱峰分离度大于1.5,磷酸盐缓冲溶液无明显干扰;取对照品溶液按照上述色谱条件连续进样6 次,色谱峰面积RSD值小于1.5%,表明此方法精密度良好;取阿胶样品6份,每份250 mg,按“1.4.2”项下方法制备供试品溶液,按上述色谱条件进行测试,色谱峰(t=25.5 min)面积RSD值小于2.5%,表明此方法重复性良好。
1.5 傅里叶变换红外光谱(FTIR)
本研究所用仪器为VERTEX 70 傅里叶变换红外光谱仪(德国布鲁克),配有Platinum ATR 衰减全反射附件。用无水乙醇清洁附件的内反射晶体表面后,扫描空气背景光谱,然后将适量样品粉末置于内反射晶体表面,用装置自带压杆压紧,扫描样品光谱。光谱范围4000~400 cm-1,光谱分辨率4 cm-1,单张光谱累积扫描32 次。原始光谱先进行ATR 校正(接触因子设为0),然后进行自动基线校正与纵坐标归一化处理,使2000~800 cm-1区域内最高吸光度为1、最低吸光度为0。
2 结果
2.1 加热程度对阿胶蛋白质相对分子质量的影响
阿胶中蛋白质(以及多肽)的含量为70%~90%[4]。由于驴皮原料、添加辅料等的差异,不同厂家或者不同批次阿胶中蛋白质含量可能波动较大,故难以根据蛋白质含量评价不同阿胶珠的炮制程度。加热可能导致阿胶中蛋白质发生热解,因此,可以考虑根据蛋白质相对分子质量变化来判断阿胶及阿胶珠的加热程度。
驴皮含有的蛋白质种类较多,在阿胶的生产过程中蛋白质发生不同程度的水解,从而产生一定的相对分子质量分布轮廓。基于凝胶渗透色谱、聚丙烯酰胺凝胶电泳、高分辨质谱等技术的研究结果表明,大部分阿胶的蛋白质相对分子质量在5103 ~2.5105Da范围内[5~7]。不同厂家阿胶的蛋白质相对分子质量分布有一定程度的差异,可能与生产过程中蛋白质水解程度有关[8]。如图1左所示,本研究使用的阿胶中大部分蛋白质的相对分子质量在104~105数量级上连续分布,符合文献报道的市售阿胶的凝胶色谱图特征。

图1 左 阿胶不同温度烘烤后的蛋白质GPC图
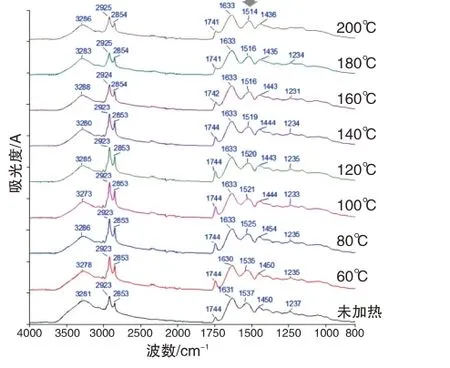
图1 右 阿胶不同温度烘烤后的FTIR图
《北京市中药饮片炮制规范》(2008 年版)规定烫制阿胶珠的蛤粉温度为140 ℃~160 ℃,已有对于阿胶珠炮制工艺的研究使用的加热温度一般为120 ℃~180 ℃[9~11]。故本研究考察了200 ℃以内的烫制温度对于阿胶蛋白质相对分子质量的影响。如图1 左所示,在不超过140 ℃的温度下加热20 min,阿胶蛋白质的相对分子质量分布未发生明显变化。加热温度达到160 ℃或者更高时,保留时间25 min附近的最强色谱峰逐渐右移,说明蛋白质相对分子质量呈现整体降低趋势。保留时间45 min 附近的色谱峰在160 ℃加热时开始出现,加热温度越高,该峰强度越大,说明该峰可能对应阿胶蛋白质的热解产物。由此推测,若蛤粉温度为140 ℃~160 ℃,阿胶烫制成珠后的蛋白质分子没有发生明显热解,相对分子质量分布轮廓未发生直观变化。
2.2 加热程度对阿胶蛋白质二级结构的影响
根据上一节的分析,相对分子质量分布轮廓能够清晰判断阿胶珠是否炮制太过(蛋白质产生明显热解),但对于炮制终点之前的蛋白质性质变化并不敏感。理论上说,即便蛋白质分子的一级结构没有变化(此时相对分子质量不变),其二级结构的变化也会导致红外光谱上酰胺Ⅰ带(主要为酰胺键C=O 伸缩振动吸收峰)和酰胺Ⅱ带(主要为酰胺键N-H 弯曲振动吸收峰)的峰位置、强度或形状的变化。因此,本研究使用能够反映蛋白质二级结构差异的红外光谱,以更加敏锐地评价阿胶珠炮制程度。
如图1右所示,阿胶的红外光谱中3 281 cm-1为氨基N-H 与羟基O-H 伸缩振动吸收峰的叠加,2 923 cm-1和2 853 cm-1为亚甲基C-H反对称和对称伸缩振动吸收峰,1 744 cm-1为酯羰基C=O伸缩振动吸收峰,1 631 cm-1和1 537 cm-1为蛋白质酰胺Ⅰ带和酰胺Ⅱ带吸收峰,1 450 cm-1为C-H弯曲振动吸收峰,1 237 cm-1为C-O伸缩振动吸收峰。上述吸收峰中,2 923 cm-1、2 853 cm-1和1 744 cm-1等主要来自油脂类成分,可以反映阿胶中辅料豆油的多少。1 631 cm-1和1 537 cm-1是蛋白质的特征吸收峰,其位置、强度或形状受到蛋白质二级结构的影响。
根据文献报道[6],阿胶生产过程中的煎煮等处理步骤可能严重破坏蛋白质的空间结构,故不同企业所产阿胶的蛋白质构象无明显差异,均呈无规则卷曲状态。如图1右所示,阿胶经不同温度加热后,酰胺Ⅰ带没有明显变化,而酰胺Ⅱ带呈现明显的红移现象,后者可以反映阿胶蛋白质的二级结构变化程度[12]。未加热的阿胶酰胺Ⅱ带位于1 537 cm-1,80 ℃加热后即明显红移至1 525 cm-1。加热温度升高到100 ℃~140 ℃时,阿胶酰胺Ⅱ带红移至1 520 cm-1附近。加热温度升高到160 ℃~200 ℃时,阿胶酰胺Ⅱ带红移至1 515 cm-1附近。相对于蛋白质,油脂类成分的热稳定性更高,所以加热温度不高于140 ℃时,2 923 cm-1、2 853 cm-1和1 744 cm-1等油脂类成分特征峰的位置没有发生改变。加热温度高于160 ℃时,2923cm-1和2853cm-1两个特征峰发生蓝移,1744cm-1峰发生红移,且1 710 cm-1附近的吸收强度有所增加,显示一部分甘油三酯可能发生热解,产生游离脂肪酸(其羰基C=O伸缩振动吸收峰在1 710 cm-1附近)。
综上所述,根据凝胶色谱表征的蛋白质相对分子质量分布,特别是保留时间25 min 附近色谱峰的位置、保留时间45 min 附近色谱峰的强度,可以区分加热温度140 ℃、160 ℃的阿胶。根据红外光谱表征的蛋白质二级结构,特别是酰胺Ⅱ带的峰位置,可以反映阿胶加热温度从60 ℃到200 ℃的逐渐升高。
2.3 市售阿胶珠的性状特征比较分析
2020 年版《中国药典》对阿胶珠的性状描述为“呈类球形。表面棕黄色或灰白色,附有白色粉末。体轻,质酥,易碎。断面中空或多孔状,淡黄色至棕色。”因此,本研究从外观颜色、质地、内部性状等角度对4 种市售阿胶珠的性状特征进行了比较,同时也对其溶化性及水分、总灰分含量进行了比较,结果见图2、表1。结果可知,阿胶珠A、B、C、D外观性状特征均符合2020年版《中国药典》要求。
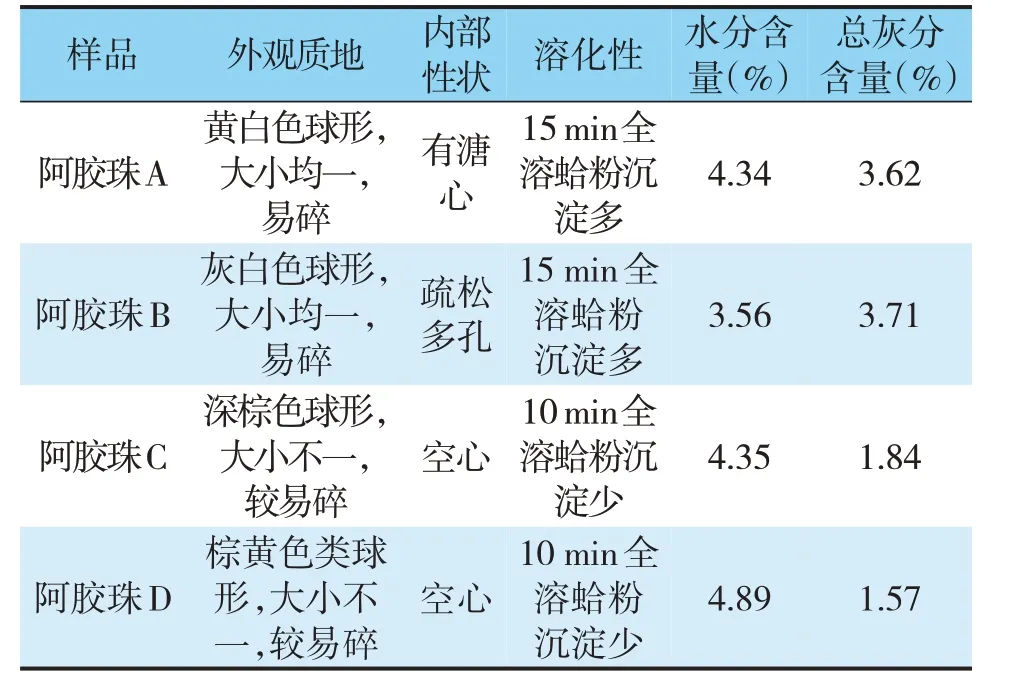
表1 4种市售阿胶珠的性状特征测定结果

图2 4家企业生产的阿胶珠
根据现行《中国药典》对阿胶珠炮制工艺的规定,阿胶需要先切成1 cm 左右的丁,然后用蛤粉烫至成珠。虽然药典未明确规定成品阿胶珠的尺寸,但是可以推测其直径应不小于1 cm。《上海市中药饮片炮制规范》[13](2018 年版)规定阿胶珠“直径2 ~2.5 cm”,《浙江省中药饮片炮制规范》[14](2015 年版)规定阿胶珠“直径2 ~4 cm”。由此可知,符合药典炮制工艺的传统阿胶珠的直径一般在2 cm 左右。由图2 可知,只有阿胶珠A 的炮制工艺可能符合药典要求。但是阿胶珠A 的内部有溏心,未达到药典要求的炮制程度。阿胶珠B、C、D 的直径明显偏小,内无溏心,说明这3种阿胶珠的加热程度应当高于阿胶珠A。
由图2、表1所示,阿胶珠A和B黏附蛤粉较多,故其灰分含量高,对于颜色、质地也有明显影响。因此,难以从表面颜色、内部性状、质地等角度评价几种阿胶珠炮制程度的相对高低。另外,阿胶珠A和B溶解速度较慢。这可能由于炮制不足导致膨化程度不够,也可能是由于炮制太过导致蛋白质焦化、难以溶解,还在一定程度上受到蛤粉含量的影响。
由此可知,内部是否有溏心能够直观评价阿胶珠炮制程度,但是这只能判断是否炮制不及(例如阿胶珠A),不能判断是否炮制太过。
2.4 市售阿胶珠的蛋白质相对分子质量比较分析
由图3 左所示,阿胶珠D 与其原料阿胶的蛋白质相对分子质量分布轮廓基本一致,在45 min 处没有明显的热解产物峰。这说明阿胶珠D 的炮制过程未显著影响蛋白质一级结构。由图4 可知,烘烤温度不超过120 ℃时,所有阿胶珠的蛋白质相对分子质量分布轮廓均无明显改变,在45 min 处也无明显的热解产物峰;烘烤温度达到180 ℃时,所有阿胶珠的蛋白质相对分子质量分布轮廓均发生明显改变,在45 min处出现明显的热解产物峰。由此推测,4种阿胶珠所含蛋白质的一级结构在炮制过程中均无显著改变,不同阿胶珠蛋白质相对分子质量分布轮廓的差异源自其阿胶原料的不同。
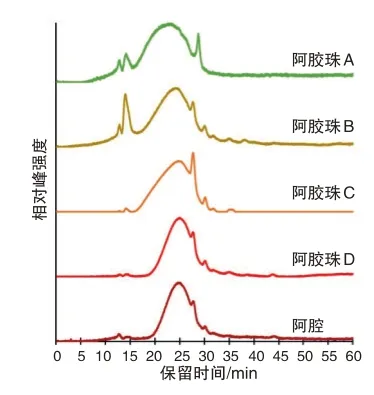
图3 左阿胶与4种市售阿胶珠的蛋白质GPC图

图3 右阿胶与4种市售阿胶珠FTIR图
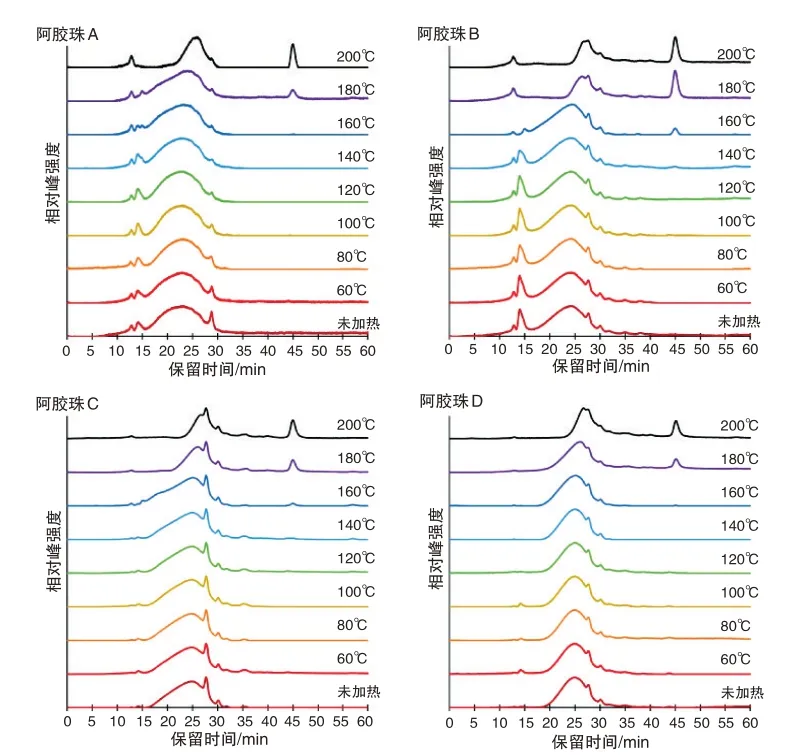
图4 4种市售阿胶珠不同温度烘烤后的蛋白质GPC图
如图3 右所示,阿胶珠A 的最强峰保留时间约为23 min,阿胶珠B 的最强峰保留时间约为24 min,阿胶珠C、D 的最强峰保留时间约为25 min。此外,阿胶珠A、B 在12 ~16 min 区域的色谱峰强于阿胶珠C、D。这说明阿胶珠A的蛋白质平均相对分子质量最大,而且阿胶珠A、B 中都有一些相对分子质量较大的蛋白质。如图4所示,200 ℃烘烤后阿胶珠A的最强峰保留时间约为25 min,阿胶珠B、C、D 的最强峰保留时间位移至27 min 附近。再次说明阿胶珠A 的蛋白质平均相对分子质量最大。根据前述性状特征分析,阿胶珠A 内有溏心且溶解速度较慢,这可能与其蛋白质平均相对分子质量最大有关。140 ℃烘烤后阿胶珠B 中已经出现45 min 处的热解产物峰,160 ℃~200 ℃烘烤后阿胶珠B的该峰明显强于其他阿胶珠。这表明阿胶珠B的蛋白质在炮制过程中的变性程度可能高于其他阿胶珠,故受热后更易分解。实验发现,烘烤温度越高,阿胶与阿胶珠样品越难以在水中溶解。因此,阿胶珠B 的溶解速度较慢,可能由于炮制过程受热程度较高所致。根据上述分析,可以初步推测炮制过程中加热程度最低的为阿胶珠A,加热程度最高的为阿胶珠B。
2.5 市售阿胶珠的蛋白质二级结构比较分析
如图3 右所示,阿胶珠D 与其原料阿胶的酰胺Ⅱ带峰位置有明显差异,前者在1 537 cm-1,后者在1 522 cm-1,反映了阿胶制珠后蛋白质二级结构的变化。根据“2.2”节所述的酰胺Ⅱ带位移规律,阿胶珠D制备时的有效加热温度可能在100 ℃左右。由于阿胶珠D 的尺寸小于2 cm,故其膨化时可能不需要将蛤粉预热到较高温度(例如140 ℃~160 ℃)。阿胶珠A、B、C的酰胺Ⅱ带也都低于1 525 cm-1,但由于未知其所用阿胶原料的红外光谱,故无法直接判断三者制珠前后的酰胺Ⅱ带位移大小。
本研究假设阿胶珠炮制过程中的蛋白质二级结构变化基本为不可逆,若阿胶炮制成珠时以T 温度加热,所得到的阿胶珠再次加热到不高于T温度时,其蛋白质二级结构与室温阿胶珠的差异预期较小。基于该假设,在未知其阿胶原料的情况下,将不同阿胶珠用相同温度加热,比较加热前后酰胺Ⅱ带位移大小,可以初步推测不同阿胶珠在炮制时的受热程度高低。如图5 所示,不同阿胶珠在加热后的酰胺Ⅱ带均发生红移。根据“2.4”节的分析结果,所有阿胶珠在炮制阶段均无明显的蛋白质热解,故其等效加热程度应当不超过本研究所用的140 ℃烘烤。比较阿胶珠在室温与140 ℃烘烤后的酰胺Ⅱ带位移值,阿胶珠A 为8 cm-1,阿胶珠B 为3 cm-1,阿胶珠C为5 cm-1,阿胶珠D为7 cm-1。由此推测,炮制阶段经历的加热程度最低的是阿胶珠A,加热程度最高的是阿胶珠B,这亦与“2.4”节的推测结果一致。
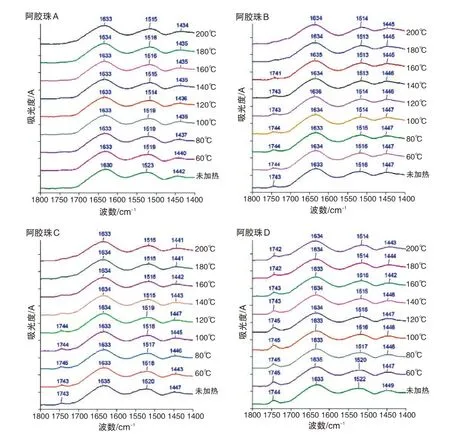
图5 4种市售阿胶珠不同温度烘烤后的FTIR图
3 讨论
本研究从性状特征、蛋白质相对分子质量、二级结构等角度,对4 种市售阿胶珠在炮制阶段可能经受的加热程度进行了比较分析。初步得出,利用性状特征以及蛋白质相对分子质量分布难以直接判断阿胶珠在炮制阶段的加热程度相对高低,而根据蛋白质二级结构对应的红外光谱特征峰,可以直接对炮制不及、适中到太过的阿胶珠加热程度相对高低进行比较。将阿胶珠样品再次加热后,根据蛋白质相对分子质量与二级结构的热响应结果可以间接评价阿胶珠的炮制程度,但是操作较复杂,有一定局限性。综上所述,红外光谱法可作为物质基础层面上客观量化阿胶珠炮制程度的评价方法,此法适用于炮制不及、适中到太过的大范围样品评价。然而,受到加热设备及阿胶丁尺寸等影响,本研究所用加热条件无法简单移植于阿胶珠生产设备,故此方法在实践中的准确性和耐用性还需要更多样品进行验证。
蛋白质为许多动物、植物药的主体成分。在研究此类药材的炮制机制与终点指标时,蛋白质相对分子质量与二级结构都是值得考虑与尝试的方面。

