橙皮苷抑制ROS/NLRP3通路改善小鼠急性支气管炎的作用机制研究
田新磊,朱珊,赵文锦,祝志朋,周怡锦(.河南省中医院儿科,河南 郑州 45000;.河南中医药大学第二临床医学院儿科,河南 郑州 450046)
急性支气管炎(acute bronchitis)是呼吸系统常见疾病,属于中医学“咳嗽”范畴[1]。吸烟、感染、过敏及免疫等因素是导致急性支气管炎患者支气管黏膜组织损伤的主要因素[2]。急性支气管炎发病过程复杂,目前研究[3-4]认为,炎症反应是急性支气管炎发展的核心机制,氧化应激是急性支气管炎发展的中心环节,而黏液高分泌、气道重塑等可作为急性支气管炎炎症反应的继发表现。故抑制炎症及氧化应激性反应对缓解急性支气管炎患者咳嗽、咳痰及肺支气管组织损伤坏死有重要意义。外源性微生物毒素、内源性危险信号及多种刺激物,均可激活NOD样受体家族蛋白3(NOD-like receptor family protein 3,NLRP3)炎症小体激活而介导机体炎症反应[5]。活性氧簇(reactive oxygen species,ROS)除了是促进氧化应激反应的关键因子外,还是激活NLRP3 炎症小体、促进炎症因子成熟及分泌的重要因素[6]。
橙皮苷为中药陈皮中的活性成分,具有抗炎、抗氧化应激、抗肿瘤及调节免疫等多种药理作用[7]。另外中药陈皮有燥湿化痰之功效,是治疗咳喘的常用中药之一[8]。但陈皮及其活性成分橙皮苷在急性支气管炎领域中的研究较少。近来研究[9]报道,橙皮苷具有降低急性支气管炎大鼠支气管肺组织炎症因子释放的作用,但其缓解炎症反应的具体机制还不甚明确。本研究拟建立小鼠急性支气管炎模型,从ROS/NLRP3 通路方面对此进行探究验证,以期为橙皮苷的开发应用提供实验依据。
1 材料与方法
1.1 动物SPF 级C57BL/6 小鼠100 只,雌雄各半,6~7 周龄,体质量20~22 g,购自河南环宇康禾生物科技有限公司,生产许可证号:SCXK(豫)2020-0004,动物质量合格证号:1107252011000123。所有小鼠于河南省中医院动物房中常规饲养,温度(22±2)℃、湿度45%~55%,12 h 光/暗循环。本试验动物符合3R 原则,实验经河南省中医院伦理委员会批准(批号:IACUC-102092)。
1.2 药物及试剂橙皮苷标准品(纯度≥98%),滁州仕诺达生物科技有限公司,批号:SND-1692;ROS/NLRP3 通路激活剂-三甲胺N-氧化物(纯度≥98%),美国MCE 公司,批号:HY-116084;小鼠白细胞介素1β(IL-1β)、白细胞介素18(IL-18)、髓过氧化物酶(MPO)、丙二醛(MDA)ELISA 试剂盒,无锡云萃生物科技有限公司,批号:YRX203063M、YRX203064M、YRX200824M、YRX203032M;HE 染色液,北京伊塔生物科技有限公司,批号:SY2022;ROS 荧光探针DCFH-DA,上海吉至生化科技有限公司,批号:D64620;兔源一抗NLRP3、IL-1β、IL-18、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、硫氧还蛋白结合蛋白(thioredoxin binding protein,TXNIP)、凋亡相关斑点样蛋白(apoptosisassociated speck- like protein containing CARD,ASC)、凋亡前体蛋白(pro-Caspase-1)、半胱天冬酶-1(Caspase-1)、β-actin 抗体和山羊抗小鼠IgG(HRP)二抗,英国Abcam 公司,批号分别为:ab263899、ab283818、ab207323、ab83108、ab209211、ab188865、ab70627、ab179515、ab138483、ab8227、ab205719。
1.3 主要仪器ADVIA 2120i 血液分析仪,德国西门子公司;iMark680 多功能酶标仪,美国Bio-Rad 公司;BX61 光学显微镜,日本Olympus 公司;Tanon 2500 全自动凝胶图像分析仪,上海天能科技有限公司;TGL20M 台式高速冷冻离心机,上海伊沐医疗器械有限公司。
1.4 小鼠急性支气管炎模型建立及分组给药取C57BL/6 小鼠80 只,根据《实用中医证候动物模型学》及相关文献[9]研究方法,用烟熏法(刨花、烟叶各50 g,分别于早上8∶00 及下午15∶00 各烟熏1 次,每次30 min,连续1 周)建立急性支气管炎模型,若小鼠出现呼吸急促、腹式呼吸、咳嗽、扎堆及眯眼等行为,视为造模成功[10]。将造模成功的80 只小鼠随机分为模型组、橙皮苷组、ROS/NLRP3 通路激活剂(三甲胺N-氧化物)组、橙皮苷+三甲胺N-氧化物组,每组20 只;另取20 只小鼠不做任何处理,作为正常对照组。
橙皮苷用0.5%的羧甲基纤维素钠(CMC-Na)配置成混悬液;三甲胺N-氧化物溶于0.9%的生理盐水。橙皮苷组参照相关文献研究[11]设置剂量,并按36 mg·kg-1的剂量灌胃给药,每日1 次;ROS/NLRP3通路激活剂(三甲胺N-氧化物)组尾静脉注射三甲胺N-氧化物2.5 mg·mL-1,每只50 μL,每3 d 给药1 次;橙皮苷+三甲胺N-氧化物组灌胃给予橙皮苷的同时,尾静脉注射给予三甲胺N-氧化物;正常对照组及模型组按10 mL·kg-1的剂量灌胃给予等量0.5%CMC-Na 混悬液,并尾静脉注射等量生理盐水。各组连续给药1 周,末次给药结束后观察小鼠行为变化。
1.5 氨水喷雾法检测小鼠咳嗽次数及咳嗽症状各组小鼠参照文献[12],置于2 500 mL 规格的加盖玻璃烧杯中,用雾化器雾化喷入40 mL、12.5%的氨水40 mL,观察小鼠咳嗽所需时间(咳嗽潜伏期)及2 min 内咳嗽次数。
1.6 肺泡灌洗液中炎症细胞数量及炎症因子检测各组取8 只小鼠,颈椎脱臼处死,取完整左右两肺,左肺用冰生理盐水2 mL 灌洗后,取灌洗液用血液分析系统检测白细胞、淋巴细胞和巨噬细胞数量。另取肺泡灌洗液约1 mL,按ELISA 法测炎性因子IL-1β、IL-18 水平,右肺取左侧中部组织迅速置于4%多聚甲醛中固定24 h 后,进行浸蜡、包埋后,制作切成5 μm 的切片备用。
1.7 HE 染色法测支气管肺组织病理变化及炎症浸润状况取右肺石蜡切片,按HE 试剂盒说明书进行染色、封片后,在显微镜下观察支气管肺组织的病理变化,并根据文献研究[13]对支气管肺组织炎症症状进行评分。
1.8 免疫组化法测支气管肺组织NLRP3 阳性表达水平取右肺石蜡切片,脱蜡水化及抗原修复后,用山羊血清封闭液孵育20 min,滴加一抗(NLRP3,1∶500)4 ℃孵育过夜。用生物素化二抗工作液室温孵育1.5 h,DAB 显色及封片后于光镜下观察并拍照,用Image Pro-Plus 6.0 软件测单位面积内阳性染色的吸光度值。
1.9 肺组织ROS 水平及氧化应激相关指标检测剩余小鼠颈椎脱臼处死,解剖取左右两肺,左肺组织置于-80℃冰箱保存备用。右肺组织在预冷的PBS 洗涤后,加入胰蛋白酶,于37 ℃下消化30 min 后,终止消化。用300 目尼龙网过滤,收集细胞,离心后弃上清。重悬细胞并加入适量荧光探针DCFH-DA,37 ℃孵育30 min 后PBS 洗涤,于流式细胞仪上检测各组小鼠肺组织细胞中ROS 含量。取-80 ℃冰箱保存的部分左肺组织,4 ℃解冻后,机械粉碎研磨,取研磨液按ELISA 试剂盒说明书方法检测氧化应激产物MDA、MPO 水平。
1.10 Western Blot 法测肺组织蛋白表达取“1.9”项下-80 ℃冰箱保存的左肺组织100 mg,4 ℃冰箱中解冻后,剪碎,机械匀浆后,取匀浆液,用蛋白提取试剂盒提取蛋白。BCA 法测蛋白浓度后,取100 μg蛋白行电泳、转膜反应,加入一抗IL-1β、IL-18、SOD、TXNIP、TRX、ASC、pro-Caspase-1、Caspase-1(1∶800)、β-actin 内参抗体(1∶1 000)4 ℃孵育过夜;滴加羊抗兔HRP 二抗(1∶2 000)在37 ℃孵育1 h,增强化学发光法显色,化学发光仪观察条带并拍照,以ImageJ 软件分析蛋白相对表达水平。
1.11 统计学处理方法用SPSS 22.0 软件进行统计分析,计量资料符合正态分布,以均数±标准差(±s)表示。多组间比较采用单因素方差分析,两两比较采用LSD-t检验(方差齐性)或Dunnett-T3 检验(方差不齐)。P<0.05 为差异有统计学意义。
2 结果
2.1 橙皮苷对小鼠行为变化的影响正常对照组小鼠呼吸均匀,毛发、饮食及精神活动正常。模型组小鼠呼吸加快、喘息、肺部有湿啰音,毛发枯槁、精神萎靡,饮食活动减少,且有2 只死亡。橙皮苷组小鼠无死亡,呼吸逐渐平缓,饮食活动有所增加,毛色脱落减少。三甲胺N-氧化物组小鼠有4 只死亡,且上述行为症状进一步加重。橙皮苷+三甲胺N-氧化物组小鼠有2 只死亡,行为变化与模型组相似。
2.2 橙皮苷对小鼠氨水引咳后咳嗽潜伏期及咳嗽次数的影响见表1。与正常对照组比较,模型组小鼠咳嗽潜伏期缩短,咳嗽次数增多(P<0.05)。与模型组比较,橙皮苷组小鼠咳嗽潜伏期延长,咳嗽次数减少(P<0.05);三甲胺N-氧化物组小鼠咳嗽潜伏期进一步缩短,咳嗽次数进一步增多(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组的差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组小鼠咳嗽潜伏期缩短,咳嗽次数增多(P<0.05)。
表1 橙皮苷对小鼠氨水引咳后咳嗽潜伏期及咳嗽次数的影响(±s)Table 1 Effects of hesperidin on incubation period of cough and cough frequency in mice induced by ammonia(±s)

表1 橙皮苷对小鼠氨水引咳后咳嗽潜伏期及咳嗽次数的影响(±s)Table 1 Effects of hesperidin on incubation period of cough and cough frequency in mice induced by ammonia(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
咳嗽次数/次8.78±0.40 20.01±2.22*14.53±1.39#25.26±2.12#19.16±0.22▲组别正常对照组模型组橙皮苷组三甲胺N-氧化物组橙皮苷+三甲胺N-氧化物组鼠数/只20 18 20 16 18咳嗽潜伏期/s 37.38±3.50 15.59±1.44*26.71±2.49#10.11±1.32#16.12±1.43▲
2.3 橙皮苷对小鼠支气管肺泡灌洗液中炎症细胞数量的影响见表2。与正常对照组比较,模型组小鼠肺泡灌洗液中白细胞、淋巴细胞、巨噬细胞数量及IL-1β、IL-18 水平均升高(P<0.05)。与模型组比较,橙皮苷组小鼠支气管肺泡灌洗液白细胞、淋巴细胞、巨噬细胞数量及IL-1β、IL-18 水平降低(P<0.05);三甲胺N-氧化物组小鼠支气管肺泡灌洗液白细胞、淋巴细胞、巨噬细胞数量及IL-1β、IL-18 水平进一步升高(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组的差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组肺泡灌洗液中白细胞、淋巴细胞、巨噬细胞数量及IL-1β、IL-18 水平升高(P<0.05)。
表2 橙皮苷对小鼠支气管肺泡灌洗液中炎症细胞数量的影响(±s)Table 2 Effect of hesperidin on the number of inflammatory cells in bronchoalveolar lavage fluid in mice(±s)

表2 橙皮苷对小鼠支气管肺泡灌洗液中炎症细胞数量的影响(±s)Table 2 Effect of hesperidin on the number of inflammatory cells in bronchoalveolar lavage fluid in mice(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
?
2.4 橙皮苷对小鼠支气管肺组织炎症损伤及NLRP3表达的影响见图1、图2 和表3。HE 染色可见正常对照组小鼠支气管周围肺泡结构,支气管黏膜上皮完整,未见充血、水肿及炎症细胞浸润现象;模型组小鼠可见支气管上皮坏死脱落、腔内有少量脓性分泌物,病变支气管周围肺泡结构模糊,且炎症细胞浸润明显,肺泡壁增厚,间质炎症细胞浸润增多。免疫组化染色显示,模型组小鼠支气管上皮细胞、肺间质细胞中NLRP3 呈强阳性表达,正常对照组支气管肺组织中NLRP3 呈弱阳性表达。与正常对照组比较,模型组织小鼠支气管肺组织中炎症损伤评分、NLRP3 阳性表达升高(P<0.05)。与模型组比较,橙皮苷组小鼠支气管肺组织中炎症损伤评分、NLRP3 阳性表达降低(P<0.05);三甲胺N-氧化物组小鼠支气管肺组织中炎症损伤评分、NLRP3 阳性表达进一步升高(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组的差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组小鼠支气管肺组织中炎症损伤评分、NLRP3 阳性表达升高(P<0.05)。

图1 橙皮苷对小鼠支气管肺组织病理变化的影响(HE 染色,×400)Figure 1 Effect of hesperidin on pathological changes of bronchopulmonary tissue in mice(HE staining,×400)

图2 橙皮苷对小鼠支气管肺组织NLRP3 阳性表达的影响(免疫组化法,×400)Figure 2 Effect of hesperidin on NLRP3 positive expression of bronchopulmonary tissue in mice(IHC,×400)
表3 橙皮苷对小鼠支气管肺组织病理变化及NLRP3 阳性表达的影响(±s)Table 3 Effects of hesperidin on pathological changes and NLRP3 positive expression of bronchopulmonary tissue in mice(±s)

表3 橙皮苷对小鼠支气管肺组织病理变化及NLRP3 阳性表达的影响(±s)Table 3 Effects of hesperidin on pathological changes and NLRP3 positive expression of bronchopulmonary tissue in mice(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
NLRP3/(平均光密度·mm-2)0.28±0.06 1.33±0.14*0.78±0.07#2.60±0.20#1.35±0.16▲组别正常对照组模型组橙皮苷组三甲胺N-氧化物组橙皮苷+三甲胺N-氧化物组鼠数/只8 8 8 8 8肺组织炎症评分/分0.32±0.03 3.99±0.41*2.06±0.18#4.97±0.47#3.96±0.33▲
2.5 橙皮苷对小鼠支气管肺组织ROS 含量及氧化应激产物的影响见图3 和表4。与正常对照组比较,模型组小鼠ROS 含量及氧化应激产物MPO、MDA 水平升高(P<0.05)。与模型组比较,橙皮苷组小鼠ROS 含量及MPO、MDA 水平降低(P<0.05);三甲胺N-氧化物组小鼠ROS 含量及MPO、MDA 水平进一步升高(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组比较,差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组ROS 含量及MPO、MDA 水平升高(P<0.05)。

图3 橙皮苷对小鼠支气管肺组织ROS 含量的影响Figure 3 Effect of hesperidin on ROS content in bronchopulmonary tissue of mice
表4 橙皮苷对小鼠支气管肺组织氧化应激产物ROS、MPO、MDA 水平的影响(±s)Table 4 Effects of hesperidin on oxidative stress poducts ROS,MPO and MDA levels in bronchopulmonary tissue of mice(±s)

表4 橙皮苷对小鼠支气管肺组织氧化应激产物ROS、MPO、MDA 水平的影响(±s)Table 4 Effects of hesperidin on oxidative stress poducts ROS,MPO and MDA levels in bronchopulmonary tissue of mice(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
MDA/(U·mg-1)10.39±1.33 70.97±7.14*41.02±4.11#99.57±9.00#69.95±6.86▲组别正常对照组模型组橙皮苷组三甲胺N-氧化物组橙皮苷+三甲胺N-氧化物组鼠数/只12 10 12 8 10 ROS/%2.19±0.10 18.90±1.19*10.52±1.25#30.99±3.19#19.05±1.91▲MPO/(U·g-1)22.02±2.03 53.07±5.22*30.25±3.22#74.88±7.25#54.08±5.03▲
2.6 橙皮苷对小鼠支气管肺组织IL-1β、IL-18、SOD、CAT 蛋白表达的影响见图4 和表5。与正常对照组比较,模型组小鼠支气管肺组织IL-1β、IL-18 蛋白表达升高(P<0.05),SOD、CAT 蛋白表达降低(P<0.05)。与模型组比较,橙皮苷组小鼠IL-1β、IL-18 蛋白表达降低(P<0.05),SOD、CAT蛋白表达升高(P<0.05);三甲胺N-氧化物组小鼠IL-1β、IL-18 蛋白表达进一步升高(P<0.05),SOD、CAT 蛋白表达进一步降低(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组的差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组IL-1β、IL-18 蛋白表达升高(P<0.05),SOD、CAT 蛋白表达降低(P<0.05)。

图4 各组小鼠支气管肺组织中IL-1β、IL-18、SOD、CAT蛋白表达的条带Figure 4 Protein expression brands of IL-1β,IL-18,SOD and CAT in bronchopulmonary tissue of mice
表5 橙皮苷对小鼠支气管肺组织IL-1β、IL-18、SOD、CAT 蛋白表达的影响(±s)Table 5 Effects of hesperidin on protein expressions of IL-1β,IL-18,SOD and CAT in bronchopulmonary tissue of mice(±s)

表5 橙皮苷对小鼠支气管肺组织IL-1β、IL-18、SOD、CAT 蛋白表达的影响(±s)Table 5 Effects of hesperidin on protein expressions of IL-1β,IL-18,SOD and CAT in bronchopulmonary tissue of mice(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
CAT 1.16±0.10 0.39±0.03*0.83±0.08#0.13±0.01#0.38±0.03▲组别正常对照组模型组橙皮苷组三甲胺N-氧化物组橙皮苷+三甲胺N-氧化物组鼠数/只12 10 12 8 10 IL-1β 1.01±0.08 1.77±0.17*1.31±0.13#2.31±0.21#1.74±0.16▲IL-18 1.15±0.12 1.88±0.18*1.44±0.15#2.49±0.24#1.80±0.18▲SOD 1.19±0.10 0.43±0.04*0.92±0.09#0.19±0.01#0.41±0.04▲
2.7 橙皮苷对小鼠支气管肺组织ROS/NLRP3 通路下游蛋白表达的影响见图5 和表6。与正常对照组比较,模型组小鼠支气管肺组织TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达升高(P<0.05)。与模型组比较,橙皮苷组小鼠TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达降低(P<0.05);三甲胺N-氧化物组小鼠TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达进一步升高(P<0.05);橙皮苷+三甲胺N-氧化物组与模型组的差异无统计学意义(P>0.05)。与橙皮苷组比较,橙皮苷+三甲胺N-氧化物组小鼠上述指标升高(P<0.05)。

图5 小鼠支气管肺组织中TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达的条带Figure 5 Protein expression brands TXNIP,ASC,pro-Caspase-1 and Caspase-1 in bronchopulmonary tissue of mice
表6 橙皮苷对小鼠支气管肺组织TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达的影响(±s)Table 6 Effects of hesperidin on protein expressions of TXNIP,ASC,pro-Caspase-1 and Caspase-1 in bronchopulmonary tissue of mice(±s)
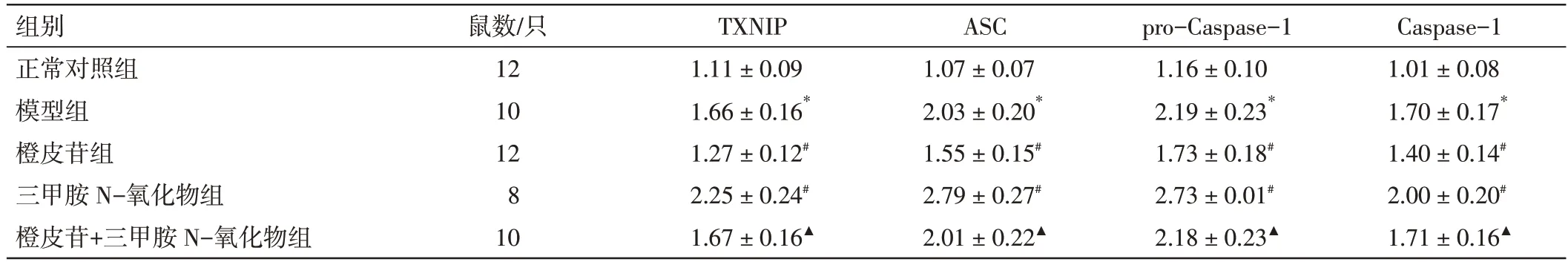
表6 橙皮苷对小鼠支气管肺组织TXNIP、ASC、pro-Caspase-1、Caspase-1 蛋白表达的影响(±s)Table 6 Effects of hesperidin on protein expressions of TXNIP,ASC,pro-Caspase-1 and Caspase-1 in bronchopulmonary tissue of mice(±s)
注:与正常对照组比,*P<0.05;与模型组比,#P<0.05;与橙皮苷组比,▲P<0.05
Caspase-1 1.01±0.08 1.70±0.17*1.40±0.14#2.00±0.20#1.71±0.16▲组别正常对照组模型组橙皮苷组三甲胺N-氧化物组橙皮苷+三甲胺N-氧化物组鼠数/只12 10 12 8 10 TXNIP 1.11±0.09 1.66±0.16*1.27±0.12#2.25±0.24#1.67±0.16▲ASC 1.07±0.07 2.03±0.20*1.55±0.15#2.79±0.27#2.01±0.22▲pro-Caspase-1 1.16±0.10 2.19±0.23*1.73±0.18#2.73±0.01#2.18±0.23▲
3 讨论
急性支气管炎发病率较高,据流行病学分析[13-14],中国安徽省感冒流行率为1.5%,其中有0.9%患者有急性支气管炎发病症状,而在美国急性支气管炎的发病率达12.1%。急性支气管炎反复发作,严重危害患者身心健康,咳嗽、咯痰、双肺呼吸音粗且伴干啰音或粗中湿啰音,其中咳嗽是急性支气管炎患者的主诉病症[15]。目前研究[16]认为炎症是咳嗽产生的主要原因之一。有研究[17]认为炎症可影响气管及支气管、鼻、喉等黏膜分泌痰液,而刺激呼吸道,产生咳嗽。本研究用烟熏法建立小鼠急性支气管炎模型后发现,小鼠出现呼吸急促、呼吸音粗、湿啰音及咳嗽等症状,氨水引咳后,小鼠咳嗽潜伏期缩短,咳嗽次数增多,光镜下可见小鼠支气管上皮细胞坏死、腔内脓性分泌物增多、肺泡结构不清、且中性粒细胞、淋巴细胞浸润明显,肺泡灌洗液中及支气管肺组织中炎性因子IL-1β、IL-18 水平升高,提示造模成功。另外,氧化应激也参与急性支气管炎的发展过程,且是炎症反应的中心环节。有关研究[18]发现吸烟可刺激肺部中性粒细胞和巨噬细胞分泌氧化酶和抗氧化酶类物质,引起氧化酶-抗氧化酶失衡而导致肺部炎症病变;Khan 等[19]发现,戒烟后气道内氧化酶仍呈现持续的高水平,并认为戒烟后气道炎症发应仍持续发展,可能与氧化应激所致的转录因子激活有关。MDA、MPO 及ROS 为氧化应激的主要产物,SOD 为重要的抗氧化酶。本研究用免疫荧光法检测到ROS 在支气管上皮细胞中阳性表达升高,且支气管肺组织MDA、MPO 升高的同时,SOD 抗氧化蛋白表达降低,证实氧化应激反应参与急性支气管炎发病过程。
橙皮苷具有抗氧化、抗炎等药理作用。吴舒懋等[11]发现橙皮苷可为呼吸道抗炎反应的首选药。谢琪等[7]发现橙皮苷能够通过清除ROS 自由基,上调SOD水平来防止脂质过氧化反应,保护肺组织免受损伤。本研究发现,橙皮苷干预治疗后,小鼠呼吸急促及咳嗽等症状均明显缓解,支气管肺组织坏死及炎性浸润等病理损伤减轻,炎症因子IL-1β、IL-18及氧化应激产物ROS、MPO 及MDA 分泌减少,抗氧化酶SOD 水平增加,提示橙皮苷可能通过抗氧化、抗炎反应,缓解急性支气管炎小鼠支气管肺组织损伤。
ROS/NLRP3 是介导机体炎症及氧化应激反应的关键通路之一。研究[20]发现,氧化应激刺激下,ROS可促进细胞内氧化-还原稳态相关通路TXNIP 从抗氧化硫氧还蛋白中解离,来激活NLRP3 炎性小体,释放炎症因子IL-1β、IL-18,炎症因子IL-1β、IL-18释放水平升高可进一步促进ROS 活化释放而加剧氧化应激损伤;另有研究[6]发现,ROS 刺激NLRP3 炎性小体激活的同时,还可刺激NLRP3 下游ASC 活化,促进pro-Caspase-1 激活成为成熟的Caspase-1,并诱导IL-1β、IL-18 成熟及分泌,而介导炎性反应,并认为抑制ROS,可明显降低细胞内Caspase-1 及IL-1β 水平来缓解细胞损伤。本研究发现,使用ROS/NLRP3 通路激活剂(三甲胺N-氧化物)进一步促进模型组大鼠ROS/NLRP3 通路活化后,TXNIP、ASC、pro-Caspase-1、Caspase-1 及IL-1β、IL-18 等表达进一步升高,支气管肺组织炎性浸润及氧化应激反应进一步加重,小鼠咳嗽症状进一步加重,提示ROS/NLRP3 通路活化,可能是介导急性支气管炎小鼠支气管肺组织损伤的重要机制。橙皮苷干预组小鼠支气管肺组织中ROS/NLRP3 通路处于抑制状态,提示橙皮苷降低急性支气管炎小鼠支气管肺组织炎症、氧化应激损伤,改善咳嗽症状的作用,可能与抑制ROS-NLRP3 通路活化有关。为了进一步验证橙皮苷的作用机制,本研究在橙皮苷处理的基础上联合应用三甲胺N-氧化物以诱导ROS/NLRP3 通路激活,结果显示,三甲胺N-氧化物可减弱橙皮苷对急性支气管炎小鼠肺损伤的改善作用。此外,与三甲胺N-氧化物单独干预组比,橙皮苷与三甲胺N-氧化物的联合干预组急性支气管炎小鼠中ROS/NLRP3 通路的活化受到抑制,急性支气管炎小鼠肺损伤程度有所减轻,说明橙皮苷对三甲胺N-氧化物诱导激活后的ROS/NLRP3 通路具有一定的拮抗作用,但这种拮抗作用不足以改善急性支气管炎小鼠的肺损伤。
综上所述,橙皮苷可能通过抑制ROS/NLRP3 通路活化,来改善急性支气管炎小鼠支气管肺组织炎症及氧化应激损伤,缓解咳嗽症状。这可能为阐明橙皮苷缓解急性支气管炎小鼠支气管肺组织损伤的可能机制提供一定参考,但ROS/NLRP3 通路还涉及细胞焦亡、线粒体自噬等其他机制调节,且橙皮苷干预ROS/NLRP3 通路活化的靶标分子也不明确,这有待后续继续研究。

