当归芍药散基于TLR4/MyD88/NF-κB信号通路对阿尔茨海默病模型大鼠神经炎症的影响研究
李平,夏小芳,于文静,杨苗,金怡杰,贺春香,成绍武,邓思思,宋祯彦(中西医结合心脑疾病防治湖南省重点实验室,湖南中医药大学,湖南 长沙 410208)
阿尔茨海默病(Alzheimer’s disease,AD)是一种复杂的中枢神经系统退行性疾病。AD 与衰老相关,以进行性的认知、行为、语言功能障碍等全面性的痴呆为特征[1]。AD 的病因目前尚未明确,研究[2]表明脑内慢性炎症是AD 的始动因素和推动疾病发展的病理基础。AD 中过度的β 淀粉样蛋白(Amyloid beta,Aβ)沉积和过度磷酸化的tau 蛋白持续刺激驱动慢性炎症持续进行[3],炎症刺激激活小胶质细胞和星形胶质细胞分泌各种促炎细胞因子和趋化因子,进一步放大炎症反应最终导致神经退行性病变和认知能力下降[4]。Toll 样受体在免疫细胞中高度表达,脑内主要表达于小胶质细胞和星形胶质细胞。Toll 样受体4(Toll-like receptor 4,TLR4)是单个的跨膜非催化性蛋白,可以识别外源非特异性刺激并激活机体产生免疫细胞应答,TLR4 通过骨髓分化因子88(myeloid differentiation factor 88,MyD88)和核因子κB(nuclear factor kappa-B,NF-κB)对炎症刺激做出反应并介导炎症信号转导[5]。研究[6-7]表明,TLR4 和促炎细胞因子在AD 小鼠和AD 患者的表达增加,抑制TLR4 介导的神经炎症可以减轻AD 认知功能障碍[8]。
当归芍药散出自东汉末年著名医家张仲景所著的《金匮要略》,由当归、白芍、川芎,茯苓、白术、泽泻组成,是疏肝健脾,化痰通络的经典良方。课题组前期研究[9]发现,当归芍药散可以调控NLRP3/Caspase-1 信号通路抑制AD 大鼠神经炎症。基于前期研究的基础,本研究以大鼠双侧侧脑室注射Aβ1-42构建AD 模型,从TLR4/MyD88/NF-κB 信号通路探讨当归芍药散对AD 模型大鼠脑内神经炎症的影响。
1 材料与方法
1.1 动物SD 大鼠,雄性,SPF 级,8 周龄,体质量(160±30)g,24 只,湖南斯莱克景达实验动物有限公司购买,动物质量合格证号:202008004116,动物生产许可证号:SCXK(湘)2019-0004。饲养于湖南中医药大学SPF 级实验动物中心,相对温度22~24 ℃,相对湿度50 %~60 %,12 h 明/暗循环,自由饮水和摄食。动物实验通过湖南中医药大学伦理委员会审批,审批号:LL-2020071501。
1.2 药物及试剂当归芍药散,组方为当归、白芍、白术、茯苓、泽泻、川芎,中药材均购自湖南中医药大学第一附属医院中药房,由湖南中医药大学科创中心制备成冻干粉,-80 ℃保存。戊巴比妥钠,德国Merck KGaA 公司,批号:20210522;Aβ1-42,美国Sigma-Aldrich 公司,批号:AG968;TLR4 抗体、MyD88 抗体、GFAP 抗体,北京博奥森公司,批号分别为:bs-20595R、bs-1047R、bs-0199R;NF-κB p65/RelA 抗体、phospho-NF-κB p65/RelA-s276 抗体,武汉ABclonal 公司,批号分别为:A2547、AP0123;Iba1 抗体,日本WAKO 和光纯药株式会社,批号:011- 27991;TRIzol、SlowFadeTMGold Antifade Mountant with DAPI、驴抗兔荧光二抗Alexa Fluor 488(绿色)、驴抗山羊荧光二抗Alexa Fluor 647(红色),美国赛默飞世尔公司,批号分别为:15596-026、S36942、A21206、A32849;通用二步法检测试剂盒(小鼠/兔增强聚合物法检测系统),北京中杉金桥公司,批号:PV-9000;山羊抗兔二抗,美国Sigma-Aldrich 公司,批号:AP132P;β-actin、IL-1β、IL-6、TNF-α 引物根据NCBI 数据库序列使用Primer 6.0 软件设计,由上海生工生物工程有限公司合成;反转录试剂盒、SYBR 荧光染料,日本宝生物公司,批号分别为:RR047A、RR820L;氯仿、异丙醇、无水乙醇,冰乙酸均为国产分析纯。
1.3 仪器Heraeus Fresco 17 型超速冷冻离心机、HM355S 型石蜡切片机,美国赛默飞世尔公司;垂直电泳转印系统、T100 型实时荧光PCR 仪、Gel Doc XR+型凝胶成像系统,美国伯乐公司;A1+型激光共聚焦显微镜,日本尼康公司;Cytation3 型多功能酶标仪,美国Bio-Tek 公司。
1.4 药物制备按照《金匮要略》中当归芍药散的比例分别称取当归9 g、白芍48 g、白术12 g、茯苓12 g、泽泻24 g、川芎24 g,采取水提法提取药液并浓缩,使用真空干燥设备制备冻干粉并测定主要成分含量进行质控,详细方法参照课题组前期已报道的方案[10]。
1.5 分组及给药方法大鼠24 只,每组6 只,随机分为4 组:假手术组、模型组、当归芍药散组和阳性药物(米诺环素)组。大鼠模型复制2 d 后进行连续灌胃给药,按每日2 次,连续治疗14 d。前期研究[11]发现等效于2 倍临床剂量的当归芍药散干预为最佳剂量,故当归芍药散给药剂量为24 g·kg-1·d-1;米诺环素根据体表面积换算给药剂量为36 mg·kg-1·d-1;假手术组和模型组灌胃等剂量生理盐水。
1.6 模型复制双侧侧脑室脑立体定位注射Aβ1-42的实验方法参照课题组已报道的方案[11],采用3 %戊巴比妥钠腹腔注射麻醉大鼠,以俯卧姿势将大鼠头部固定在脑立体定位仪上,参考《大鼠脑立体定位图谱》(第6 版)找到大鼠双侧侧脑室定位仪坐标,颅骨钻打孔,微量注射器在侧脑室双侧各注5 μL Aβ1-42(2 μg·mL-1),假手术组注射等剂量生理盐水。留针5 min 后出针,伤口消毒并缝合。动物苏醒前保温,苏醒后观察24 h,活动正常视为手术成功。以Morris水迷宫测试评价模型是否成功。
1.7 Morris 水迷宫各组动物给药治疗14 d 后开始Morris 水迷宫检测。前5 d 为学习阶段,训练大鼠寻找平台,水迷宫平均分为4 个象限,将目标平台置于第一象限固定位置低于水面2 cm 处。测试时大鼠头朝池壁依次从每个象限固定位置放入水面,记录大鼠逃逸时间即60 s 内大鼠找到平台并停留的时间,如大鼠未能找到平台则记为60 s,并将大鼠引导至平台站立5 s 帮助学习。每天早晚各学习1 次。第6 天撤去平台测试大鼠记忆能力,从各象相项固定位置池壁放置大鼠,记录大鼠穿越平台次数即在60 s 内穿过目标平台的次数和记录大鼠在目标象限停留的时间。
1.8 组织取材水迷宫观测后采用3%戊巴比妥钠腹腔注射麻醉大鼠,腹部做U 型切口,用50 mL 注射器从左心室插入并开放右心耳,用4 ℃生理盐水进行心脏灌注,直至肝脏发白,断头取脑。冰上操作分离左右脑,左侧使用4%多聚甲醛溶液固定,右侧冰上剥离海马组织,液氮速冻后放入-80 ℃冰箱保存。
1.9 HE 染色脑组织经脱水固定后切片,烘烤脱蜡后,使用苏木素染色,酸水及氨水中分色数秒,流水冲洗1 h 后入蒸馏水片刻。乙醇-伊红染色3 min,以70%~90%梯度乙醇各脱水10 min,100%乙醇脱水,二甲苯透明切片,滴加中性树胶后盖玻片封片,光学显微镜拍照成像。
1.10 免疫荧光固定好的背侧海马石蜡切片,脱蜡与水化,细胞通透及封闭,抗原修复,血清封闭,孵育一抗,孵育二抗。切片显色,复染及封片,显微镜下观察切片并保存图像,记录统计数据。
1.11 蛋白免疫印迹法(Western Blot)取出冻存的海马组织,加入裂解液及蛋白酶抑制剂提取蛋白样品,按BCA 法测定蛋白浓度,制胶及上样;电泳,转膜,5%脱脂牛奶室温封闭1 h;一抗孵育4 ℃过夜,二抗室温孵育2 h;ECL 发光显色,用凝胶图象处理系统分析目标条带的分子量和净光密度值。
1.12 实时荧光定量PCR(qPCR)取大鼠海马组织,TRlzol 法提取总RNA,检测RNA 纯度。根据反转录cDNA 试剂盒逆转录得到cDNA,采用SYBR Green 染料法在实时(Real-time)PCR 仪上运用两步法进行扩增,预变性95 ℃,5 min;变性95 ℃,30 s;退火+延伸58 ℃,30 s,共40 个循环。最终记录各目的基因2-△△Ct值并进行数据分析。引物序列见表1。

表1 qPCR 引物序列Table 1 Primer sequences of qPCR
1.13 免疫组织化学取大鼠脑组织石蜡切块进行切片,取石蜡切片脱蜡与水化,细胞通透及封闭,抗原修复,血清封闭;孵育一抗,孵育二抗;切片显色,复染及封片,显微镜下观察切片并保存图像记录统计数据。
1.14 统计学处理方法数据统计使用SPSS 25.0 软件进行分析,统计结果用均数±标准差(±s)表示,若满足正态性和方差齐性,采用单因素方差分析;若不满足正态性和方差齐性,采用Kruskal-WallH检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 当归芍药散对AD 大鼠学习记忆能力的影响如图1 所示,与假手术组比较,模型组AD 大鼠学习第5 天平均逃逸时间明显延长,第6 天撤出平台后能找到平台的次数明显减少,在目标区域停留的时间也明显降低,差异均有统计学意义(P<0.01),提示模型复制成功。与模型组比较,当归芍药散组大鼠学习第5 天平均逃逸时间明显减少,第6 天撤出平台后穿过平台次数明显增加,且在目标区域停留时间明显增加,差异均有统计学意义(P<0.01)。阳性药物组大鼠同样也表现出平均逃逸时间缩短、穿越平台次数增加和在目标象限停留时间增加,差异均有统计学意义(P<0.05,P<0.01)。

图1 当归芍药散对阿尔茨海默病(AD)大鼠学习记忆能力的影响(±s,n=6)Figure 1 Effect of Danggui Shaoyao San on learning and memory ability of AD rats(±s,n=6)
2.2 当归芍药散对AD 大鼠神经元病理形态的影响如图2 所示,与假手术组比较,模型组大部分神经元组织排列紊乱,较多神经元细胞丢失、核固缩。与模型组比较,当归芍药散干预组神经元排列更整齐且清晰可见,神经元丢失、核固缩减少;阳性药物(米诺环素)干预组也可以观察到相同的病理改变。
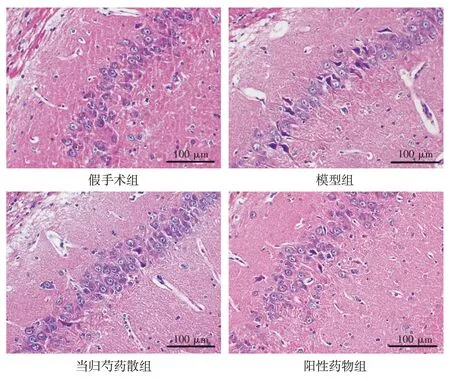
图2 当归芍药散对阿尔茨海默病(AD)大鼠神经元海马组织病理形态的影响(HE 染色,×400)Figure 2 Effect of Danggui Shaoyao San on the pathological morphology in hippocampal tissue of AD rats(HE staining,×400)
2.3 当归芍药散对AD 大鼠海马组织小胶质细胞和星形胶质细胞活化的影响如图3 所示,与假手术组比较,模型组大鼠脑内小胶质细胞和星形胶质细胞活化数量明显增多,差异均有统计学意义(P<0.01),且呈现聚集性,多分布在海马组织周围。与模型组比较,当归芍药散和米诺环素干预后大鼠脑内小胶质细胞和星形胶质细胞活化均明显减少,差异均有统计学意义(P<0.01)。
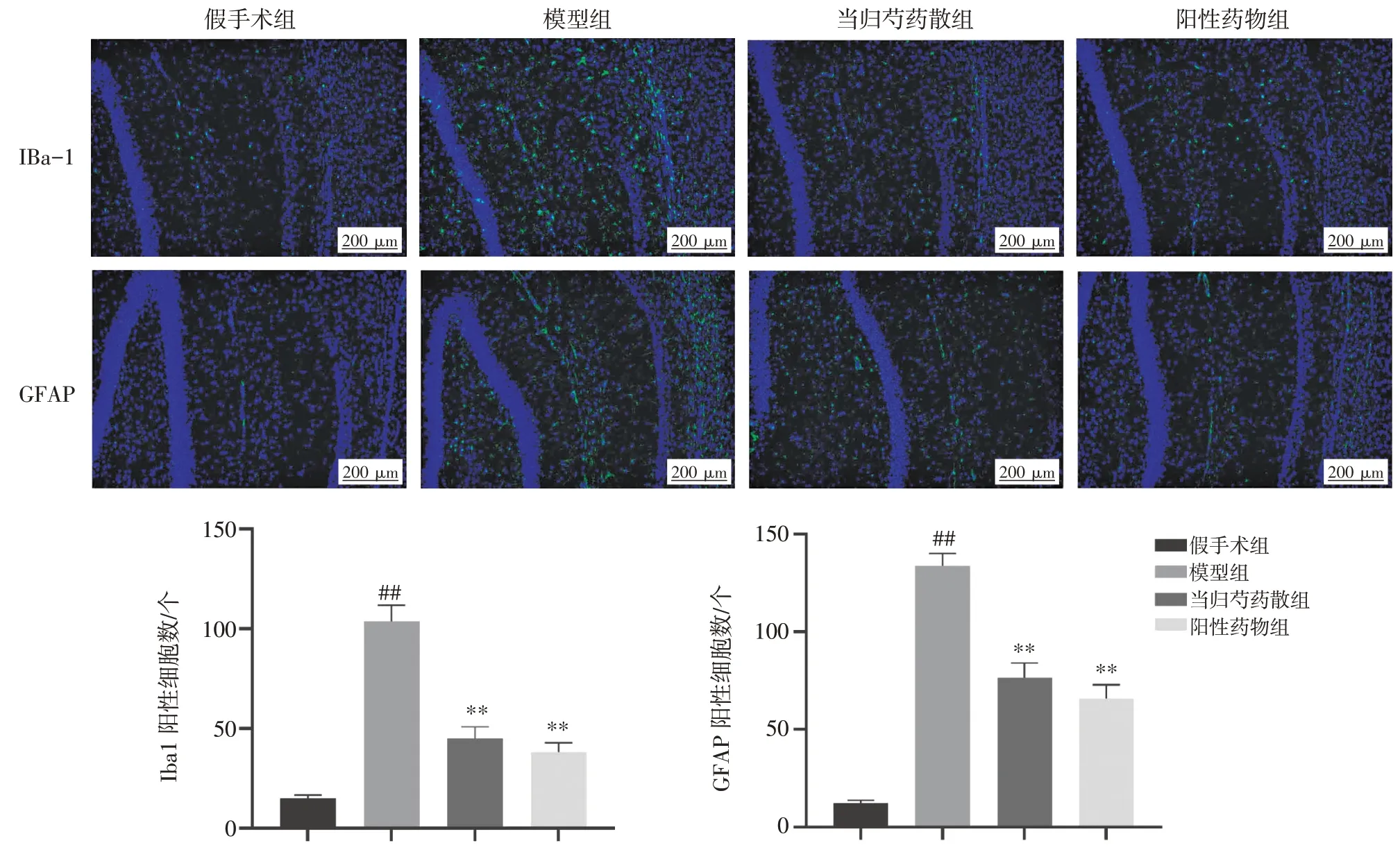
图3 当归芍药散对阿尔茨海默病(AD)大鼠海马组织小胶质细胞和星形胶质细胞活化的影响(±s,n=6)Figure 3 Effects of Danggui Shaoyao San on microglia and astrocyte activation in hippocampus of AD rats(±s,n=6)
2.4 当归芍药散对AD 大鼠海马组织炎症因子IL-1β、TNF-α 和IL-6 mRNA 表达的影响如图4 所示,与假手术比较,模型组IL-1β、TNF-α 和IL-6 mRNA表达明显增高,差异均有统计学意义(P<0.01)。与模型组比较,当归芍药散和阳性对照组IL-1β、TNF-α 和IL-6 mRNA 表达均明显下降,差异均有统计学意义(P<0.01)。

图4 当归芍药散对阿尔茨海默病(AD)大鼠海马组织TNF-α、IL-6 和IL-1β mRNA 表达的影响(±s,n=6)Figure 4 Effect of Danggui Shaoyao San on mRNA expressions of TNF-α,IL-6 and IL-1β in hippocampus of AD rats(±s,n=6)
2.5 当归芍药散对AD 大鼠海马组织TLR4、MyD88和p-NF-κB p65 蛋白表达的影响如图5 所示,与假手术组比较,模型组TLR4、MyD88 和p-NF-κB的蛋白表达量明显增多,差异均有统计学意义(P<0.01)。与模型组比较,当归芍药散组和阳性药物组TLR4、MyD88 和p-NF-κB 蛋白表达量均明显降低,差异均有统计学意义(P<0.01)。
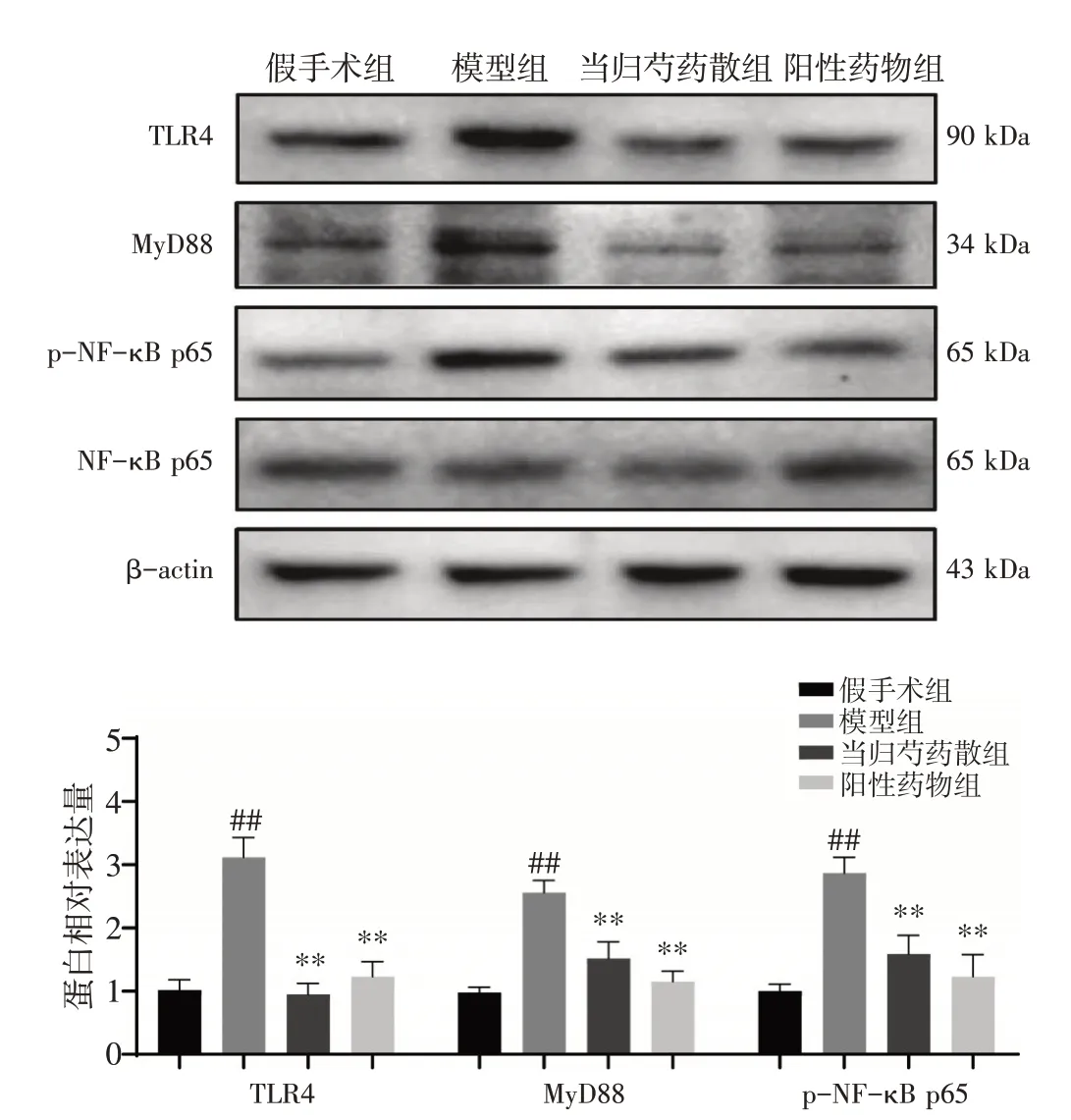
图5 当归芍药散对阿尔茨海默病(AD)大鼠海马组织TLR4、MyD88 和p-NF-κB p65 蛋白表达的影响(±s,n=3)Figure 5 Effect of Danggui Shaoyao San on the protein expressions of TLR4,MyD88 and p-NF-κB p65 in hippocampus of AD rats(±s,n=3)
2.6 当归芍药散对AD 大鼠模型海马组织NF-κB p65 核转移的影响如图6 所示,与假手术组比较,模型组大鼠海马组织神经元中NF-κB p65 出现散点状入核的细胞数量明显增多,差异有统计学意义(P<0.01)。与模型组比较,当归芍药散组和阳性药物组大鼠海马组织神经元中NF-κB p65 出现散点状入核的细胞数量均明显减少,差异均有统计学意义(P<0.01),且与Western Blot 结果一致。

图6 当归芍药散对阿尔茨海默病(AD)大鼠海马组织NF-κB p65 核转移的影响(±s,n=3)Figure 6 Effect of Danggui Shaoyao San on nuclear translocation of NF-κB p65 in hippocampus of AD rats(±s,n=3)
3 讨论
中医认为,阿尔茨海默病(AD)属于痴呆范畴,其主要病机为脏腑亏虚、痰浊瘀血蒙蔽清窍。研究[2]指出,神经炎症可能是导致AD 神经退行性病变的关键病理过程。陈可冀院士指出:“无形之瘀病理实质是炎症反应”,可见AD 神经炎症的基本病机为血瘀,痰阻气滞以致血瘀,瘀血流注于脑,清窍受蒙。当归芍药散是《金匮要略》中记载的一个肝脾同调、痰瘀并治的名方。研究[12-14]表明,中药复方当归芍药散对AD 具有积极的治疗改善作用。课题组前期研究[15]发现,与炎症相关的TNF 信号通路及NF-κB信号通路是当归芍药散治疗AD 的主要作用途径。本研究结果显示AD 大鼠的学习记忆能力在通过当归芍药散干预后明显改善,脑内小胶质细胞和星形胶质细胞的活化数量明显减少,炎症因子表达下降,神经元形态和功能恢复,提示当归芍药散能抑制AD 大鼠脑内神经炎症且与抑制胶质细胞活化有关。TLR4/NF-κB 途径是调节神经炎症和胶质细胞活化的重要信号通路[16]。前期研究[17]提示,当归芍药散能调控抑制NF-κB 信号通路激活降低炎症反应,但当归芍药散是否能调控TLR4 信号通路抑制AD 神经炎症仍不清楚。
Toll 样受体是一种重要的天然受体免疫蛋白。TLR 的激活可通过促进细胞内信号通路促进炎性细胞因子的表达,这对识别和清除入侵病原体至关重要[18]。MyD88 依赖性途径是TLR 的主要信号途径之一,MyD88 具有模块化结构,在其N 端有一个死亡域(DD),DD 结构域激活后,MyD88 通过产生肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6),激活kappa B 抑制因子激酶(inhibitor of kappa B kinase,IKK)并泛素化、磷酸化降解核因子κB 抑制蛋白(inhibitor of NF-κB,IκB),使得胞浆内NF-κB 解离活化并转移入核(尤其是p65 亚单位),从而与炎症相关基因结合,启动炎性细胞因子转录,诱发炎症[19]。NF-κB 是炎症反应调节的核心,可以活化包括小胶质细胞在内的炎性细胞,从而促进炎症反应的形成、发展和恶化[20]。本研究中,在大鼠侧脑室注射Aβ1-42后,Western Blot 结果显示Aβ1-42注射后大鼠脑内TLR4、MyD88、NF-κB 含量增加,表明Aβ1-42毒性刺激不仅影响到NF-κB 途径启动炎症因子,还影响到TLR4/MyD88 信号通路的激活,促进炎症因子的分泌。另外,给予当归芍药散干预后胶质细胞活化减少,炎症因子的表达水平明显下降,一定程度上表明当归芍药散作用于MyD88 及其下游的信号通路,并参与调控NF-κB 信号通路发挥抗炎作用,这与我们前期的细胞实验结果一致[17]。
综上所述,AD 中Aβ 聚集物的持续毒性刺激驱动脑内神经炎症,小胶质细胞和星形胶质细胞过度活化导致促炎细胞因子和趋化因子产生过多损伤神经元,最终导致神经退行性病变和认知能力下降。当归芍药散能改善Aβ1-42诱导的神经炎症反应,其机制可能是通过调控TLR4/MyD88 信号通路抑制炎症因子的激活,发挥抗炎作用,从而保护神经元。

