邓老御膅膏对2型糖尿病大鼠的影响
郭雪莹,朱梓宁,郑绍琴,,王兆佳,陈颖谊,袁诗佳,杜岵骏,徐志勇(.广州中医药大学青蒿研究中心,广东 广州 50006;.邓老金方药业科技集团有限公司,广东 广州 5000;.广州中医药大学科技产业园有限公司,广东 广州 50445)
糖尿病的发病率正随着人们生活水平提高、人口老龄化及生活方式的改变而逐渐升高,我国糖尿病发病率已高达9.75%[1]。预计到2035 年全球将有近5.92 亿糖尿病患者[2]。约95%以上的糖尿病患者被诊断为2 型糖尿病,由于胰岛素分泌不足或人体胰岛素抵抗导致血糖升高,具有典型的“三多一少(多食、多饮、多尿、体质量降低)”症状。中医将糖尿病归为“消渴病”的范畴,认为其病因病机与过食肥甘、外感受邪、七情内伤等有关,导致体内痰饮不除,久病伤肾,日久脾肾两虚。因此,2 型糖尿病患者初期多为痰湿证,久病不除则易转变为脾肾两虚证。
邓老御膅膏由国医大师邓铁涛教授师承团队在充分凝炼邓老学术思想和治疗糖尿病临症验方[3-4]基础上加减化裁而成,基于“治未病”理念对糖尿病高危人群和2 型糖尿病轻症患者进行早期干预。邓老御膅方由玉米须、葛根、黄精、桑叶、茯苓、山药、枸杞子7 味中药组成,具有健脾益肾、生津止渴的功效。研究[5-9]表明,方中玉米须、黄精、茯苓、山药、枸杞子均具有降血糖和降血脂的作用,其中玉米须与茯苓、山药更是治疗消渴病的常用配伍。故本研究拟采用高脂饮食联合小剂量链脲佐菌素法制备2 型糖尿病大鼠模型,观察邓老御膅膏对其的影响,以期为邓老御膅膏的推广应用提供实验依据。
1 材料与方法
1.1 动物雄性SD 大鼠120 只,SPF 级,体质量180~220 g,8 周龄,购自南方医科大学实验动物中心,实验动物生产许可证号:SCXK(粤)2021-0041,动物质量合格证号:44002100025348。动物饲养于广州中医药大学科技产业园有限公司屏障环境动物实验室,动物使用许可证号:SYXK(粤)2018-0014,室温:20~25 ℃,相对湿度:40%~70%,12 h/12 h 昼夜明暗交替照明。本动物实验经广州中医药大学科技产业园有限公司实验动物使用及管理委员会批准,动物伦理批文号:PZ20200708。
1.2 药物及试剂邓老御膅膏,邓老金方药业科技集团有限公司,批号:20200601;消渴丸,广州白云山中一药业有限公司,批号:A05050。链脲佐菌素(STZ),美国Sigma 公司,批号:WXBD1402V;胆固醇,广州晶欣生物科技有限公司,批号:1910;葡萄糖,天津大茂化学试剂厂,批号:2020040109;去氧胆酸钠,广东环凯微生物科技有限公司,批号:3209058;丙基硫氧嘧啶片,上海朝晖药业有限公司,批号:2003N09;吐温-80(批号:2020070128)、丙二醇(批号:2019050116),广东广试试剂科技有限公司;柠檬酸(批号:20130122)、柠檬酸三钠(批号:20130305),天津市福晨化学试剂厂;乌来糖,上海国药集团化学试剂有限公司,批号:20160219;血糖试纸,德国罗氏诊断有限公司,批号:26023631;大鼠胰岛素(FINS,批号:2020-08)、糖化血红蛋白(HbA1c,批号:2020-08)、C 肽(C-P,批号:2020-08)、胰岛素样生长因子1(IGF-1,批号:2020-09)检测试剂盒,江苏酶免实业有限公司;总胆固醇(TCHO,批号:ZCDES014)、甘油三酯(TG,批号:ZCDECS003)检测试剂盒,上海执诚生物技术公司。
1.3 主要仪器罗氏Active 活力型血糖仪,德国罗氏公司;Multiskan FC 酶标仪,美国赛默飞世尔科技有限公司;日立7080 型全自动生化分析仪,日本HITACHI 公司;HH-6 型数显恒温水浴箱,江苏金坛市荣华仪器制造有限公司;HVE-50 自动高压灭菌锅,日本HIRAYAMA 公司;LEICA DMLB 型光学正立显微镜,德国徕卡公司。
1.4 模型复制大鼠适应性饲养后随机选择12 只作为正常组,其余108 只作为造模组。造模大鼠灌胃给予高脂乳剂[10](猪油25.0 g、胆固醇10.0 g、葡萄糖10.0 g、吐温20.0 mL、丙二醇30.0 mL、水30.0 mL、去氧胆酸钠2.0 g、丙基硫氧嘧啶1.0 g,配制成200 mL乳剂)4 mL,每日1 次,连续8 周;末次灌胃后大鼠禁食不禁水12 h,然后一次性腹腔注射链脲佐菌素溶液(临用前用0.1 mol·L-1柠檬酸-柠檬酸钠缓冲液配制成2%浓度,调pH 值=4.21,操作均在冰浴中进行)30 mg·kg-1,建立2 型糖尿病大鼠模型[11-14]。正常组大鼠进食普通饲料,腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。注射链脲佐菌素1 周后,大鼠禁食不禁水12 h,用刀片划破大鼠尾部,采血检测空腹血糖(FBG)。大鼠FBG 值≥11.1 mmol·L-1则为造模成功。
1.5 分组及给药选择造模成功的60 只大鼠按血糖值及体质量随机分为模型组、消渴丸组(阳性对照药,0.78 g·kg-1)及邓老御膅膏低、中、高剂量组(5.63、11.25、22.50 g·kg-1),每组12 只。给药组大鼠按设定剂量灌胃给药,每天1 次,连续8 周;正常组及模型组大鼠灌胃等量生理盐水。除正常组外,其余各组大鼠在给药期间同时灌胃给予高脂乳剂2 mL,每日1 次。邓老御膅膏低、中、高剂量分别为临床等效剂量的0.5、1、2 倍;消渴丸给药剂量为临床等效剂量。
1.6 检测指标①给药期间观察大鼠一般状况,每周记录各组大鼠24 h 平均饮水量。②给药第2、4、6、8 周,大鼠禁食不禁水12 h 后,检测大鼠FBG值。③口服糖耐量(OGTT)试验[11]:末次给药后,大鼠禁食12 h,测定0 h 血糖值后,立即按2 g·kg-1灌服葡萄糖溶液,并测定灌服葡萄糖后0.5、1、2 h 的血糖值(BG0.5、BG1、BG2);计算时间-血糖曲线下面积(AUC)=(BG0+BG0.5)×0.5÷2 +(BG0.5+BG1)×0.5÷2+(BG1+BG2)×1÷2。④OGTT 试验后,大鼠腹主动脉取血,采用ELISA 法测定血清FINS,计算胰岛素抵抗指数(HOMA-IR)与胰岛素敏感性指数(IAI)[15],HOMA- IR =(FBG × FINS)/22.5,IAI=Ln[1/(FBG ×FINS)]。⑤采用ELISA 法测定全血HbA1c 及血清IGF-1、C-P 水平。⑥采用全自动生化分析仪测定血清TCHO、TG 水平。⑦处死大鼠,剖取胰腺组织,用10%中性福尔马林溶液固定后,制备石蜡切片(厚度3 ~4 μm);经常规苏木精-伊红(HE)染色后,在显微镜下观察大鼠胰腺组织病理变化,并记录胰岛组织结构规则度、胰岛数量及细胞空泡变等情况;进行胰腺组织病理学半定量评分,评分标准见表1。

表1 大鼠胰腺组织病理学半定量评分标准Table 1 Histopathological semi-quantitative scoring criteria of rat pancreas
1.7 统计学处理方法采用SPSS 17.0 统计软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD 检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 邓老御膏对2 型糖尿病大鼠一般情况的影响结果见表2。与正常组比较,模型组大鼠出现多饮、多食、多尿现象,大便较稀软,进行性消瘦,反应迟钝,拱背蜷卧,第1~8 周的饮水量均显著升高(P<0.01)。与模型组大鼠比较,邓老御膅膏给药组大鼠“三多一少”症状及精神状态得到一定改善,第1~7 周的饮水量有不同程度降低(P<0.05,P<0.01)。结果表明,邓老御膅膏能一定程度改善2 型糖尿病大鼠的多饮症状。
表2 邓老御膅膏对2 型糖尿病大鼠饮水量的影响(±s,n=12)Table 2 Effect of DENG Tietao’s Yu Tang Soft Extract on water intake of type 2 diabetic rats(±s,n=12)
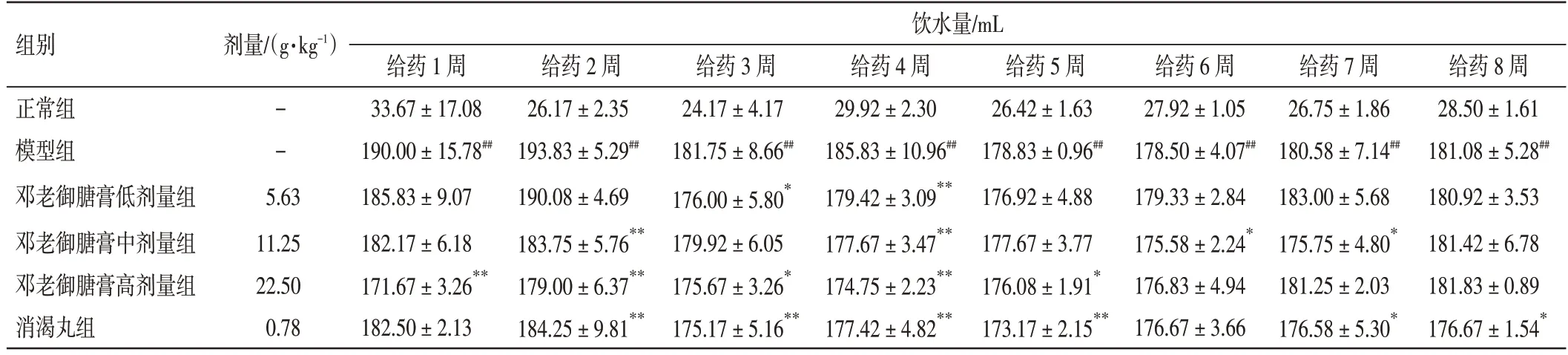
表2 邓老御膅膏对2 型糖尿病大鼠饮水量的影响(±s,n=12)Table 2 Effect of DENG Tietao’s Yu Tang Soft Extract on water intake of type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别剂量/(g·kg-1)饮水量/mL给药8 周28.50±1.61 181.08±5.28##180.92±3.53 181.42±6.78 181.83±0.89 176.67±1.54*正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组--5.63 11.25 22.50 0.78给药1 周33.67±17.08 190.00±15.78##185.83±9.07 182.17±6.18 171.67±3.26**182.50±2.13给药2 周26.17±2.35 193.83±5.29##190.08±4.69 183.75±5.76**179.00±6.37**184.25±9.81**给药3 周24.17±4.17 181.75±8.66##176.00±5.80*179.92±6.05 175.67±3.26*175.17±5.16**给药4 周29.92±2.30 185.83±10.96##179.42±3.09**177.67±3.47**174.75±2.23**177.42±4.82**给药5 周26.42±1.63 178.83±0.96##176.92±4.88 177.67±3.77 176.08±1.91*173.17±2.15**给药6 周27.92±1.05 178.50±4.07##179.33±2.84 175.58±2.24*176.83±4.94 176.67±3.66给药7 周26.75±1.86 180.58±7.14##183.00±5.68 175.75±4.80*181.25±2.03 176.58±5.30*
2.2 邓老御膏对2 型糖尿病大鼠FBG 水平的影响结果见表3。与正常组比较,模型组大鼠在给药后第2 ~8 周期间的FBG 水平显著升高(P<0.01),表明2 型糖尿病模型造模成功;与模型组比较,邓老御膅膏给药组大鼠在给药后第2 ~8 周期间的FBG 水平有不同程度降低(P<0.05,P<0.01)。结果表明,邓老御膅膏能改善2 型糖尿病大鼠的FBG 水平。
表3 邓老御膅膏对2 型糖尿病大鼠空腹血糖(FBG)水平的影响(±s,n=12)Table 3 Effect of DENG Tietao’s Yu Tang Soft Extract on fasting blood glucose level in type 2 diabetic rats(±s,n=12)

表3 邓老御膅膏对2 型糖尿病大鼠空腹血糖(FBG)水平的影响(±s,n=12)Table 3 Effect of DENG Tietao’s Yu Tang Soft Extract on fasting blood glucose level in type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)FBG/(mmol·L-1)给药8 周4.67±0.51 30.72±2.59##26.53±6.21**26.99±2.22*27.08±2.69*24.69±4.06**--5.63 11.25 22.50 0.78给药前4.88±0.64 19.45±4.83##20.10±4.02##19.55±4.49##19.97±4.66##19.74±4.38##给药2 周5.08±0.54 30.09±3.66##22.24±8.70**21.18±8.03**21.57±6.10**23.08±2.98**给药4 周5.28±0.32 28.56±2.45##24.12±6.63**24.81±5.22*25.48±3.28 24.57±2.33*给药6 周5.67±0.67 30.22±3.71##26.35±7.04*28.38±3.05 27.98±4.21 25.68±3.37**
2.3 邓老御膏对2 型糖尿病大鼠糖耐量的影响结果见表4。与正常组比较,模型组大鼠口服葡萄糖后不同时间点的血糖水平及AUC 值显著升高(P<0.01);与模型组比较,邓老御膅膏给药组大鼠口服葡萄糖后不同时间点的血糖水平及AUC 值有一定程度降低,但差异无统计学意义(P>0.05)。
表4 邓老御膅膏对2 型糖尿病大鼠糖耐量的影响(±s,n=12)Table 4 Effect of DENG Tietao’s Yu Tang Soft Extract on glucose tolerance in type 2 diabetic rats(±s,n=12)
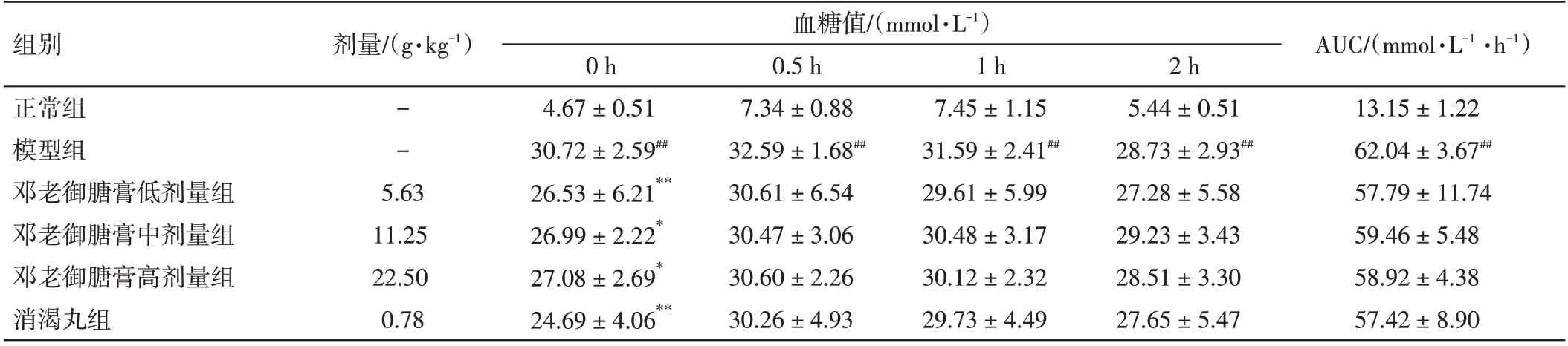
表4 邓老御膅膏对2 型糖尿病大鼠糖耐量的影响(±s,n=12)Table 4 Effect of DENG Tietao’s Yu Tang Soft Extract on glucose tolerance in type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
AUC/(mmol·L-1·h-1)13.15±1.22 62.04±3.67##57.79±11.74 59.46±5.48 58.92±4.38 57.42±8.90组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)血糖值/(mmol·L-1)--5.63 11.25 22.50 0.78 0 h 4.67±0.51 30.72±2.59##26.53±6.21**26.99±2.22*27.08±2.69*24.69±4.06**0.5 h 7.34±0.88 32.59±1.68##30.61±6.54 30.47±3.06 30.60±2.26 30.26±4.93 1 h 7.45±1.15 31.59±2.41##29.61±5.99 30.48±3.17 30.12±2.32 29.73±4.49 2 h 5.44±0.51 28.73±2.93##27.28±5.58 29.23±3.43 28.51±3.30 27.65±5.47
2.4 邓老御膏对2 型糖尿病大鼠HbA1c 水平的影响结果见表5。与正常组比较,模型组大鼠血液中的HbA1c 含量显著升高(P<0.01);与模型组比较,邓老御膅膏高剂量组及消渴丸组大鼠血液中的HbA1c 含量显著降低(P<0.01)。结果表明,邓老御膅膏能降低2 型糖尿病大鼠的HbA1c 水平。
表5 邓老御膅膏对2 型糖尿病大鼠HbA1c 水平的影响(±s,n=12)Table 5 Effect of DENG Tietao’s Yu Tang Soft Extract on HbA1c level in type 2 diabetic rats(±s,n=12)
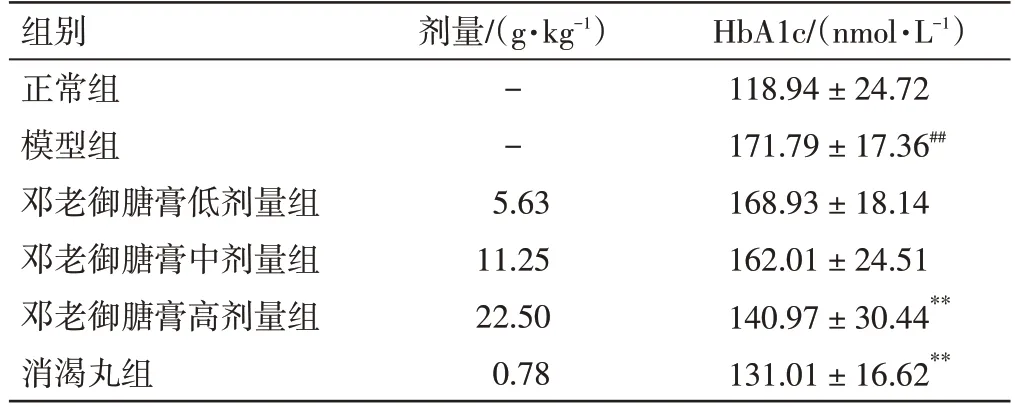
表5 邓老御膅膏对2 型糖尿病大鼠HbA1c 水平的影响(±s,n=12)Table 5 Effect of DENG Tietao’s Yu Tang Soft Extract on HbA1c level in type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
HbA1c/(nmol·L-1)118.94±24.72 171.79±17.36##168.93±18.14 162.01±24.51 140.97±30.44**131.01±16.62**组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)--5.63 11.25 22.50 0.78
2.5 邓老御膏对2 型糖尿病大鼠胰岛素相关指标的影响结果见表6。各组大鼠的血清FINS 含量无明显差异(P>0.05)。与正常组比较,模型组大鼠的HOMA-IR 显著升高(P<0.01),IAI 显著降低(P<0.01);与模型组比较,邓老御膅膏给药组大鼠的HOMA-IR 有一定程度降低,但差异无统计学意义(P>0.05)。
表6 邓老御膅膏对2 型糖尿病大鼠胰岛素相关指标的影响(±s,n=12)Table 6 Effect of DENG Tietao’s Yu Tang Soft Extract on insulin-related indexes in type 2 diabetic rats(±s,n=12)
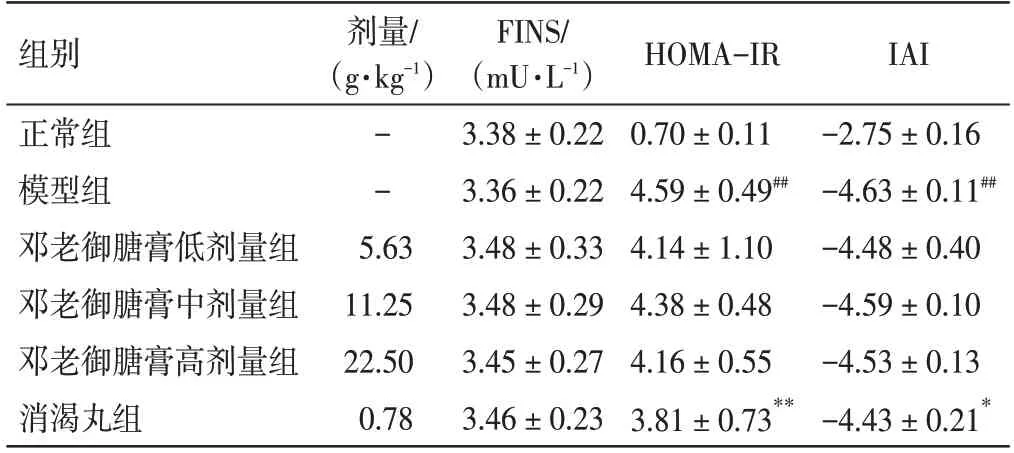
表6 邓老御膅膏对2 型糖尿病大鼠胰岛素相关指标的影响(±s,n=12)Table 6 Effect of DENG Tietao’s Yu Tang Soft Extract on insulin-related indexes in type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01
IAI-2.75±0.16-4.63±0.11##-4.48±0.40-4.59±0.10-4.53±0.13-4.43±0.21*组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)--5.63 11.25 22.50 0.78 FINS/(mU·L-1)3.38±0.22 3.36±0.22 3.48±0.33 3.48±0.29 3.45±0.27 3.46±0.23 HOMA-IR 0.70±0.11 4.59±0.49##4.14±1.10 4.38±0.48 4.16±0.55 3.81±0.73**
2.6 邓老御膏对2 型糖尿病大鼠血清IGF-1、C-P水平的影响结果见表7。与正常组比较,模型组大鼠的血清IGF-1 水平明显降低(P<0.05),C-P 水平显著升高(P<0.01);与模型组比较,邓老御膅膏给药组大鼠的血清C-P 水平明显降低(P<0.05,P<0.01),IGF-1 水平有升高趋势,但差异无统计学意义(P>0.05)。
表7 邓老御膅膏对2 型糖尿病大鼠血清IGF-1、C-P 水平的影响(±s,n=12)Table 7 Effects of DENG Tietao’s Yu Tang Soft Extract on serum leves of IGF-1 and C-P in type 2 diabetic rats(±s,n=12)

表7 邓老御膅膏对2 型糖尿病大鼠血清IGF-1、C-P 水平的影响(±s,n=12)Table 7 Effects of DENG Tietao’s Yu Tang Soft Extract on serum leves of IGF-1 and C-P in type 2 diabetic rats(±s,n=12)
注:与正常组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01
C-P/(pg·mL-1)59.27±3.78 81.94±3.24##77.96±6.53*72.37±4.09**69.51±5.40**62.39±4.65**组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)--5.63 11.25 22.50 0.78 IGF-1/(ng·mL-1)6.76±2.12 5.14±1.15#6.19±1.73 6.34±2.04 6.63±2.24 6.64±1.59
2.7 邓老御膏对2 型糖尿病大鼠血脂水平的影响结果见表8。与正常组比较,模型组大鼠的血清TCHO、TG 水平明显升高(P<0.05);与模型组比较,邓老御膅膏高剂量组大鼠的血清TG 水平明显降低(P<0.05),TCHO 水平有下降趋势,但差异无统计学意义(P>0.05)。结果表明,邓老御膅膏能一定程度改善2 型糖尿病大鼠的血脂水平。
表8 邓老御膅膏对2 型糖尿病大鼠血脂水平的影响(±s,n=12)Table 8 Effect of DENG Tietao’s Yu Tang Soft Extract on level of blood lipid in type 2 diabetic rats(±s,n=12)

表8 邓老御膅膏对2 型糖尿病大鼠血脂水平的影响(±s,n=12)Table 8 Effect of DENG Tietao’s Yu Tang Soft Extract on level of blood lipid in type 2 diabetic rats(±s,n=12)
注:与正常组比较,#P<0.05;与模型组比较,*P<0.05
TG/(mmol·L-1)0.64±0.11 0.89±0.39#0.71±0.23 0.88±0.35 0.61±0.18*0.73±0.22组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)--5.63 11.25 22.50 0.78 TCHO/(mmol·L-1)1.30±0.36 1.72±0.40#1.45±0.37 1.68±0.69 1.50±0.34 1.46±0.28
2.8 邓老御膏对2 型糖尿病大鼠胰腺组织病理变化的影响结果见图1、表9。与正常组比较,模型组大鼠的胰岛腺泡形态不规则,体积缩小,腺泡细胞核增多,胰岛数量减少,部分胰岛见少量空泡变和胰腺淋巴细胞局灶性浸润,胰腺组织病理评分显著升高(P<0.01);与模型组比较,邓老御膅膏给药组大鼠的胰岛腺泡形态不规则情况有所改善,胰岛数量有所增加,胰岛空泡变和淋巴细胞浸润减少,胰腺组织病理评分显著降低(P<0.01)。结果表明,邓老御膅膏能够改善2 型糖尿病大鼠的胰岛组织病理损伤。

图1 邓老御膅膏对2 型糖尿病大鼠胰腺组织病理变化的影响(HE 染色,×100)Figure 1 Effects of DENG Tietao’s Yu Tang Soft Extract on pathological changes of pancreatic tissue in type 2 diabetic rats(HE staining,×100)
表9 邓老御膅膏对2 型糖尿病大鼠胰腺组织病理评分的影响(±s,n=12)Table 9 Effect of DENG Tietao’s Yu Tang Soft Extract on pancreatic histopathological score in type 2 diabetic rats(±s,n=12)
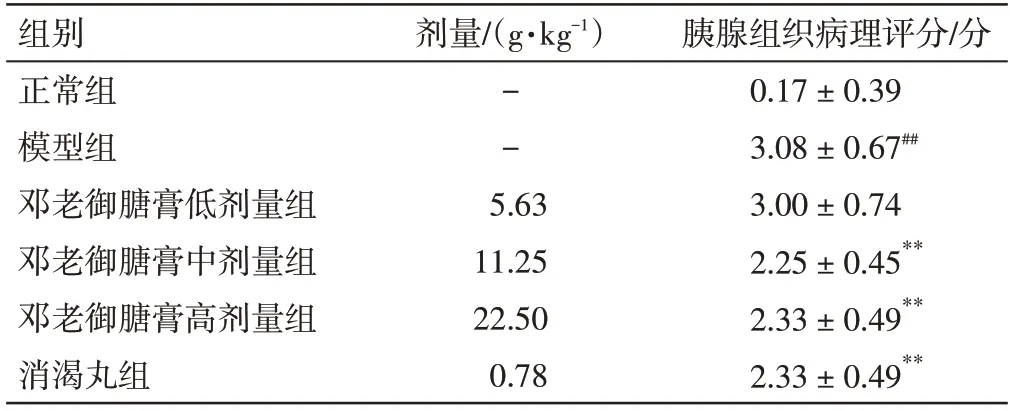
表9 邓老御膅膏对2 型糖尿病大鼠胰腺组织病理评分的影响(±s,n=12)Table 9 Effect of DENG Tietao’s Yu Tang Soft Extract on pancreatic histopathological score in type 2 diabetic rats(±s,n=12)
注:与正常组比较,##P<0.01;与模型组比较,**P<0.01
胰腺组织病理评分/分0.17±0.39 3.08±0.67##3.00±0.74 2.25±0.45**2.33±0.49**2.33±0.49**组别正常组模型组邓老御膅膏低剂量组邓老御膅膏中剂量组邓老御膅膏高剂量组消渴丸组剂量/(g·kg-1)--5.63 11.25 22.50 0.78
3 讨论
2 型糖尿病是由遗传和环境因素相互作用共同导致的慢性代谢紊乱性疾病,是从胰岛素抵抗为主伴胰岛素相对不足,到胰岛素分泌不足为主伴胰岛素抵抗的病理过程,而胰岛素分泌相对不足导致糖、蛋白和脂质代谢紊乱,并以慢性高血糖为主要特征。胰岛素抵抗是指胰岛素生物学效应低于正常作用效果,可使脂蛋白数量及组成发生变化,导致血脂异常[16],是2 型糖尿病、血脂代谢紊乱、心血管病等多种疾病的病理基础。由于胰岛素抵抗导致胰岛素作用不足会导致血脂水平升高,脂蛋白糖基化和脂质过氧化作用增强,造成脂质堆积和清除障碍,脂代谢紊乱与胰岛素抵抗互为因果,导致恶性循环[17]。2 型糖尿病病因复杂,其机制除了涉及胰岛素抵抗外,还与胰岛β 细胞功能受损、基因、氧化应激、炎症反应以及肠道菌群失衡等有关[18]。本研究采用高脂饮食联合小剂量链脲佐菌素法制备2 型糖尿病大鼠模型,模型组大鼠出现饮水量、FBG、糖耐量、HbA1c、HOMA-IR 及血清C-P、TCHO、TG 水平显著升高,血清IGF-1 水平及IAI 显著降低,胰岛组织出现明显病理损伤,表明2 型糖尿病模型复制成功。经过邓老御膅膏干预后,2 型糖尿病大鼠的饮水量、FBG、HbA1c 以及血清C-P、TG 水平均有较明显降低,胰岛组织病理损伤得到明显改善。
胰岛β 细胞功能障碍是2 型糖尿病发生的重要机制,胰岛β 细胞功能减弱或丧失,是导致胰岛素分泌相对不足或绝对不足的根本原因,因此保护胰岛组织是治疗糖尿病的有效途径之一[19]。胰岛β 细胞功能也是影响降糖方案选择的最主要因素[20]。组织病理学结果显示,模型组大鼠胰腺组织出现胰岛腺泡形态不规则、体积缩小、腺泡细胞核增多、胰岛数量减少,胰岛细胞空泡变和胰腺淋巴细胞局灶性浸润等变化;邓老御膅膏能一定程度修复受损的胰岛细胞,增加胰岛数量,改善胰岛腺泡形态不规则、胰岛空泡变及淋巴细胞浸润。
血清C-P 是胰岛β 细胞的分泌产物,胰岛素原是其与胰岛素的共同前体,C-P 极少被肝脏摄取,在血液中代谢缓慢,且C-P 不与胰岛素抗体发生交叉免疫反应,通过对血清C-P 水平的检测,可以及时了解胰岛素β 细胞释放状况,同时能够体现合成胰岛素的能力[21-22]。临床上常通过检测C-P 释放来评估胰岛β 细胞功能[20]。HbA1c 是血红蛋白与血糖结合糖基化部分,可反映患者近3 个月的血糖水平,且不受血糖波动影响,具有持续、缓慢、不可逆的特点,与血糖水平正相关[23-24]。临床上常通过联合检测血清C-P、HbA1c 水平来反映胰岛β 细胞功能和糖尿病病情程度,是制定糖尿病临床治疗方案的重要参考指标[23]。本研究结果显示,邓老御膅膏能明显降低2 型糖尿病大鼠的血清C-P 及HbA1c 水平,可能与改善胰腺组织病理损伤、修复受损胰岛细胞有关。
综上所述,邓老御膅膏对2 型糖尿病大鼠具有一定降糖作用,可能与调节脂质代谢、修复胰岛损伤有关。邓老御膅膏可能有助于对糖尿病高危人群和2 型糖尿病轻症患者进行早期干预,但还需要更多临床观察及动物实验加以验证。

