朱顶红曼谷玫瑰-愈伤组织途径再生体系的建立
杨维 刘心怡 曾晶珏 吴坤林 房林 吴沙沙 翟俊文 曾宋君

关键词:朱顶红;试管苗叶片;植物生长调节剂;组织培养
中图分类号:S682.31 文献标识码:A
朱顶红为石蒜科(Amaryllidaceae)朱頂红属(Hippeastrum Herb.)多年生球根花卉的总称,原产南美洲。其品种繁多,花朵硕大,5~6 朵喇叭状花着生在一个直径3~4 cm 的中空花葶上,花色艳丽且丰富,常被用于园林绿化或盆栽于室内,也可应用于切花观赏[1]。此外,朱顶红属植物含有大量的生物碱,药用价值高,可应用于多种医药产品[2-3]。近年来,我国从国外大量引种并进行了市场销售,但引种的朱顶红种苗昂贵,严重地影响其产业化推广。
朱顶红鳞茎的自然繁殖率较低,特别是引种的品种极少长出仔球,难以进行分球繁殖。朱顶红的传统繁殖方式可采用播种和扦插等[4],但由于商品朱顶红品种多为杂交种,自交后性状会发生分离,不能保持母株的优良性状,只应用于新品种的培育;特别是重瓣型的品种多没有子房,不能获得种子。而采用鳞片扦插进行规模化繁殖,需要大量的种球且所需时间长、受季节影响大,繁殖效率相对较低[5-6]。组织培养技术是植物快繁最有效的方法之一,繁殖过程不受病虫和环境胁迫的危害[7-8]。目前国内外对朱顶红的组织培养研究已有一些报道[9-11],大多以鳞茎为外植体进行不定芽的诱导,增殖效率普遍较低,本研究对100多个品种的以芽繁芽的组织培养实验中,大部分品种均存在这个问题,难以进行规模化快速繁殖。有关愈伤组织途径再生体系的研究较少。植物愈伤组织再生体系的建立不仅可以达到快速繁殖的目的,还可获得良好的基因转化受体材料,具有高效转化率、嵌合体少及无性系变异小等优点[12]。张慧等[13]和于波等[14]分别以无菌苗小鳞茎和幼嫩花梗为外植体建立了胚性愈伤组织途径的再生体系,DE ALMEIDA 等[15]以内花被片为外植体进行愈伤组织诱导,诱导率为48%。但是,以这些器官作为外植体不可避免地存在资源和时间受限的问题。
本研究以白肋品种朱顶红曼谷玫瑰鳞茎来源的无菌苗叶片基部为外植体,进行愈伤组织诱导、增殖、分化、生根及移栽研究,以期建立一种高效的愈伤组织途径再生体系,为朱顶红工厂化繁殖提供技术支撑,同时为其后续的分子育种提供优良的受体材料。
1 材料与方法
1.1 材料
朱顶红曼谷玫瑰的鳞片作为外植体在MS+6-BA 5.00 mg/L 培养基上经不定芽途径诱导出的不定芽,再经二次继代以上的无菌苗叶片基部为外植体。
1.2 方法
基本培养基均为MS 固体培养基,并添加蔗糖30 g/L、琼脂4.8 g/L,灭菌前pH 调为5.80,在121 ℃、104 kPa 条件下灭菌20 min。接种后培养于(25±2)℃、光照周期为12 h/d、光照强度为2500~3000 Lux 的培养室中。
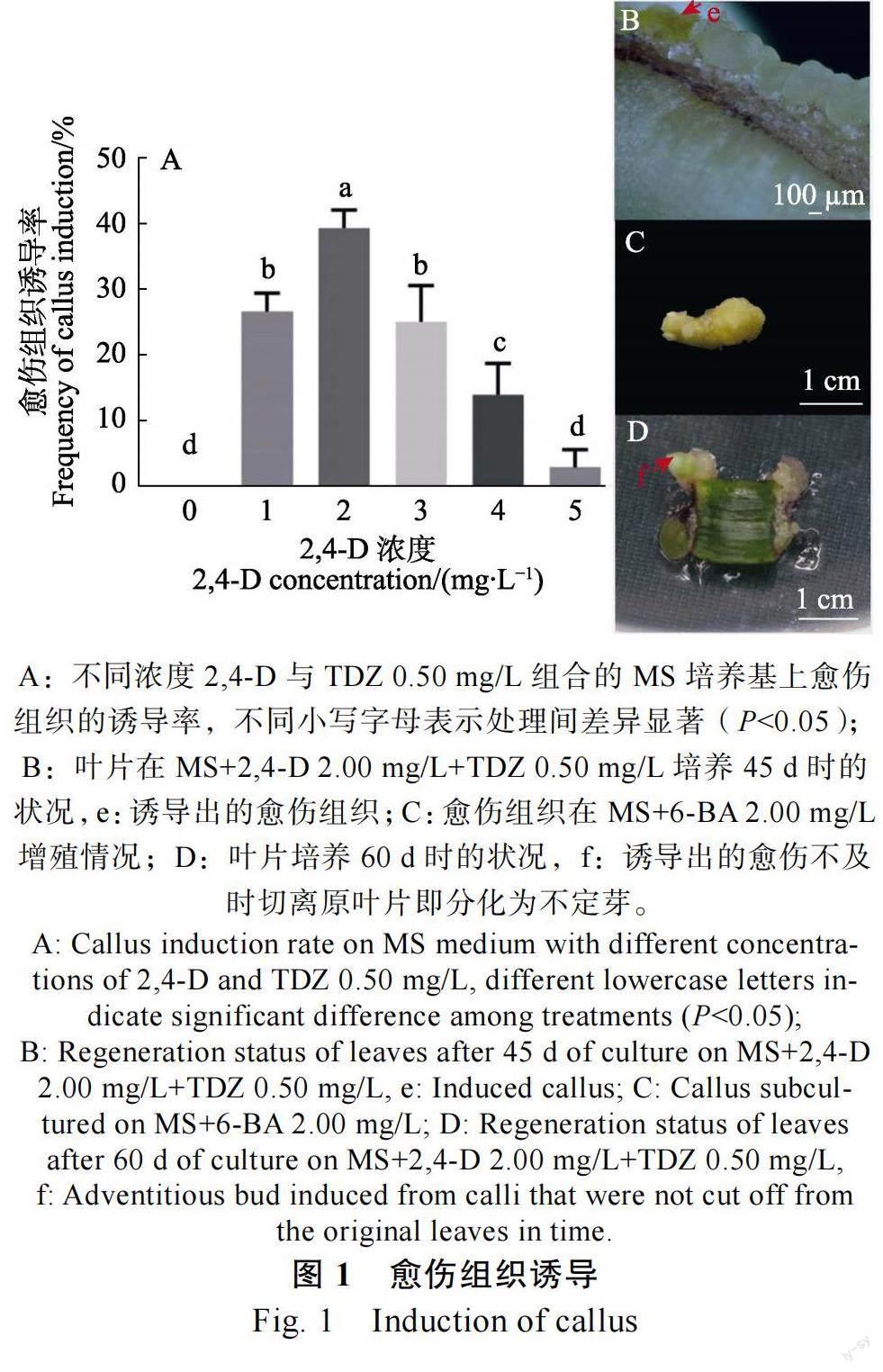
1.2.1 愈伤组织的诱导 将继代培养的生长健壮、长势一致的试管苗取出置于无菌操作台上,然后将叶片基部白色部分切成0.5 cm×0.5 cm 左右的方形小块,置于添加不同浓度的2,4-D(0、1.00、2.00、3.00、4.00、5.00 mg/L)和TDZ(0.50 mg/L)的MS 培养基上,每个处理10 瓶,每瓶10 个外植体,重复3 次。45 d 后统计愈伤组织诱导率。愈伤组织诱导率=(每瓶诱导出愈伤组织的叶片数/每瓶接种的叶片数)×100%。
1.2.2 愈伤组织的增殖 将生长状态一致的愈伤组织切成0.5 cm×0.5 cm 小块,转接在添加不同浓度的6-BA(0、1.00、2.00、4.00、6.00 mg/L)的MS 培养基上进行培养,每周观察1 次其生长情况,培养20 d 时统计愈伤组织增殖指数及芽分化系数。生物增重倍数=培养20 d 时每瓶愈伤组织团的重量/接种时每瓶愈伤组织的重量,愈伤组织增殖倍数=培养20 d 后每瓶愈伤组织的重量(去除不定芽后的愈伤组织重量)/接种时每瓶愈伤组织的重量,不定芽分化率=(每瓶分化出芽的愈伤组织数/每瓶接种的愈伤组织数)×100%。
1.2.3 愈伤组织的分化 将经增殖后的愈伤组织切成0.5 cm×0.5 cm 小块,接种在添加不同浓度6-BA(0.25、0.50、0.75、1.00 mg/L)、KT(0.25、0.50、0.75、1.00 mg/L)、NAA(0、0.10、0.20、0.50、1.00 mg/L)及其组合的MS 培养基上。每个处理接种10 瓶,每个瓶5 个外植体,重复3 次。培养30 d 后,将愈伤组织对半切成2 份,转接在相同培养基上继续培养。再培养30 d 时统计愈伤组织分化系数。分化系数=每瓶分化出的不定芽的愈伤组织数/接种的愈伤组织数,成苗系数=每瓶长出的具有独立小鳞茎并有2 片以上叶片的植株数/每瓶接种的愈伤组织数。
1.2.4 不定芽的生根与移栽 将经分化后得到的株高约3~4 cm 的小苗去除植株上部分叶片,分别接种在不同浓度NAA(0、0.10、0.20 mg/L)和IBA(0、0.50、1.00、1.50 mg/L)组合的MS 培养基上培养。每个处理10 瓶,每瓶接种8 株小苗,重复3 次。30 d 后统计生根数、根长及株高。生根率=(每瓶生根的小鳞茎数/每瓶接种的小鳞茎数)×100%。平均根数=每瓶小鳞茎根总数/每瓶小鳞茎数。
将经生根后的小植株从培养瓶中取出,用自来水洗净根部的培养基,移栽至椰糠∶泥炭土∶蛭石=1∶1∶1 的基质中培养。移栽苗数300 株,移栽后60 d 时观察植株生长状况并统计成活率。
1.3 数据处理
使用Excel 和SPSS 20.0 软件对数据进行统计分析。采用邓肯新复极差法对实验数据进行差异显著性分析。
2 结果与分析
2.1 愈伤组织的诱导
无菌苗叶片在愈伤组织诱导培养基上,1 周后,部分叶片逐渐膨大变厚,呈肉质,2 周后,叶片切口处出现白毛状愈伤组织,30~40 d 时,器官开始发生,部分叶片切口处开始分化出芽和淡黄色愈伤组织(图1B),1 周内将其愈伤组织与叶片切离,置于新鲜的相同培养基上,愈伤组织可膨大增殖(图1C),如未及时与叶片分离,愈伤组织会随后分化,60 d 时愈伤组织大部发会转化为芽(图1D)。由图1A 可知,在培养基中加入0.50 mg/L TDZ,再添加2,4-D 时,愈伤组织诱导率随2,4-D 浓度的提高出现先增加后递减的趋势,且各处理之间呈现显著性差异,在不添加2,4-D 的培养上未能诱导出愈伤组织,叶片一直呈现初始状态未启动。当2,4-D 浓度达到2.00 mg/L时,愈伤组织的诱导率最高,达39.67%。当2,4-D5.00 mg/L 时,愈伤组织诱导率仅为3.17%,大部分叶片黑化死亡。因此,朱顶红曼谷玫瑰无菌苗叶片愈伤组织诱导最佳培养基为MS+2,4-D 2.00 mg/L+TDZ 0.50 mg/L。
2.2 愈伤组织的增殖
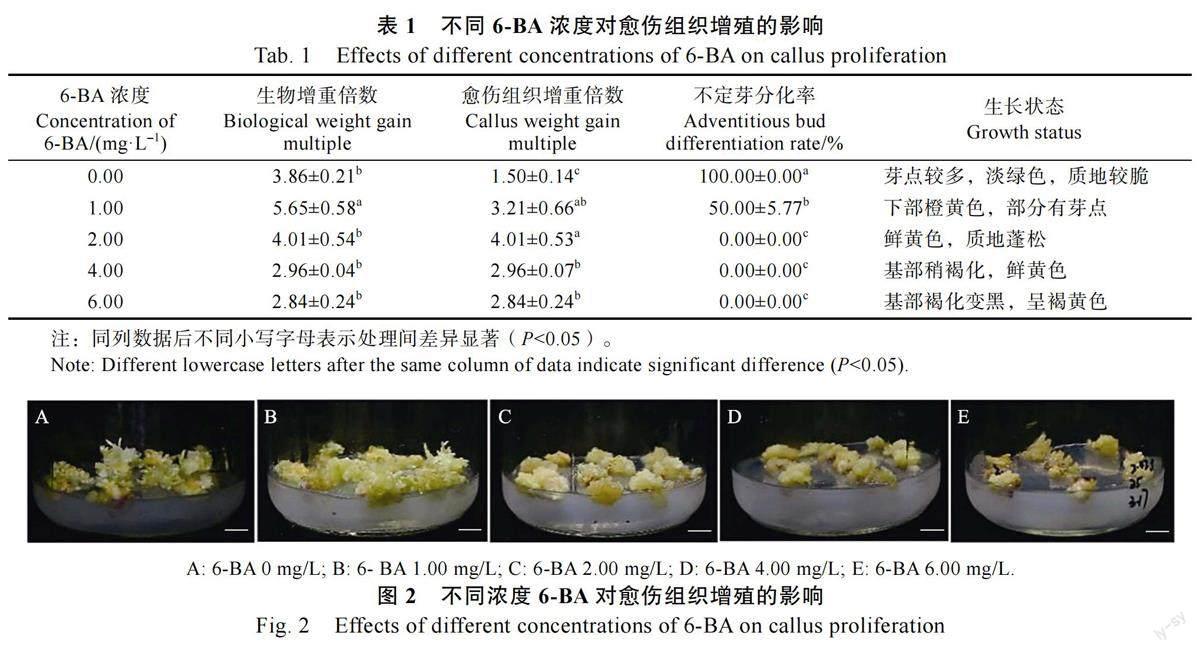
为了保持愈伤组织曼谷玫瑰材料,设置不同6-BA 浓度的培养基对诱导出的愈伤組织增殖进行培养,每7 d 观察统计愈伤组织的增殖状态。前1 周愈伤组织处于受伤恢复期,表面稍褐化,增殖不明显,第2 周时愈伤组织处于生长高峰期,体积迅速扩大,质地变得蓬松,第3 周愈伤组织增殖缓慢。15~20 d 时的体积没有太大差别。由表1 可知,5 种处理下,愈伤组织均能增殖,增殖效果随6-BA 浓度递增呈现先增加后减少的趋势,当6-BA 浓度为2.00 mg/L 时,愈伤组织增殖倍数最大,达4.01 倍,未分化出芽,与其他浓度存在显著性差异。当6-BA 浓度在2.00 mg/L 以下时,愈伤组织的生物增重和不定芽分化率较高,尤其是没有添加6-BA 时,愈伤组织分化率100%,只有极少一部分继续保持为愈伤组织状态。由此得出,6-BA 浓度过高过低都不利于愈伤组织增殖,低浓度6-BA 下,愈伤组织易分化,曼谷玫瑰愈伤组织增殖的最佳培养基为MS+6-BA 2.00 mg/L(图2)。
2.3 愈伤组织分化
愈伤组织接入到不同浓度KT 和不同浓度KT+NAA 的MS 培养基上培养20 d 时,大部分愈伤组织颜色由鲜黄色转变为翠绿色,开始分化出芽点,30 d 时长成肉眼可见的不定芽,45 d 时不定芽明显茁壮,60 d 时部分不定芽形成独立的小植株,叶片健壮。而在不同浓度6-BA 和不同浓度6-BA+NAA 培养基上的愈伤组织,20 d 后,大部分愈伤组织依旧保持鲜黄色,与KT 处理组相比,只有少数有绿色小芽点,30 d 后有少数芽体出现,60 d 时形成小植株极少(图3)。
由表2 可知,KT 处理组愈伤组织分化率显著高于6-BA 处理组,当KT 0.50 mg/L 时愈伤组织分化系数最高,达10.59,平均每团愈伤组织出苗数为5.67,平均株高为6.83 cm;其次为KT0.75 mg/L 时,愈伤组织分化系数为8.33,平均每团愈伤组织出苗数为2.58,平均株高为4.83 cm;当6-BA 浓度为1.00 mg/L,NAA 浓度为1.00 mg/L时,愈伤组织分化系数最低,为1.30,平均每团愈伤组织出苗数为0.17,平均株高2.07 cm。因此,本研究得出,NAA 对曼谷玫瑰愈伤组织的分化没有显著影响,KT 有利于愈伤组织分化,6-BA 对愈伤组织分化效果不显著,最佳愈伤组织分化培养基为MS+KT 0.50 mg/L。
2.4 不定芽的生根培养和试管苗移栽
由表3 可知,在不同浓度IBA 和NAA 组合的MS 培养基上,朱顶红的绝大部分不定芽能生根,但是不同处理间存在差异。NAA 浓度为0 时,不定芽生根率、平均根数、平均株高随IBA 浓度增加呈现先上升后递减趋势,而后,在培养基中添加不同浓度NAA,不定芽生根效果不显著。在本研究中,虽然对照组生根率100%,平均根数4.3,平均根长最长2.63 cm,但是该处理下根细长,平均株高也只有3.89 cm,植株整体表现较为瘦弱矮小。当愈伤组织在IBA 0.50 mg/L 和IBA1.00 mg/L+NAA 0.10 mg/L 时出根效果最佳,二者生根率均为100%,前者平均根数为4.85,平均根长为1.48,平均株高为6 cm,后者平均根数为6.57,平均根长1.28,平均株高4.38(图4)。考虑到节约成本,推荐以MS+IBA 0.50 mg/L 作为曼谷玫瑰的最佳生根培养基。后将生根后植株转入温室,移栽至椰糠∶泥炭土∶蛭石=1∶1∶1 的基质中培养,存活率达93.33%。
3 讨论
朱顶红愈伤组织离体再生体系的建立对其种苗的快繁和分子育种遗传转化体系的建立具有重要价值。目前,朱顶红的组织培养研究中,多以鳞茎为外植体建立再生体系,以不定芽进行增殖难以获得愈伤组织,繁殖周期长、繁殖率较低[16-18],而以花蕾、子房[19]、幼嫩蒴果[20]、花梗[14]和花瓣[15]等进行朱顶红离体再生研究时,虽然可以获得愈伤组织,但受取材时间、数量等的限制。本研究以朱顶红曼谷玫瑰鳞茎来源继代2 次以上的无菌苗叶片基部为外植体,不受取材数量和取材时间的限制,成本低且效率高[21]。本研究的预实验中,由朱顶红曼谷玫瑰温室中栽培的幼嫩叶片或鳞茎来源的初代组培或第一次继代的小植株叶片基部为材料难以诱导出愈伤组织,说明朱顶红叶片直接诱导愈伤组织的难度大,需要在培养基上多次继代幼化后才能诱导出愈伤组织。
植物生长调节剂种类和浓度是影响植物组织培养的关键因素[22-23]。人工合成的TDZ 作为一种新型植物生长调节剂,能够诱导外植体从愈伤组织形成到体细胞胚胎发生的一些反应[24]。近年来,TDZ 已被广泛应用于植物形态发生研究,在朱顶红属植物中常与6-BA和NAA搭配使用[25-26]。张慧等[13]认为2,4-D 浓度变化对胚性愈伤组织的诱导具有显著影响。AMANI 等[6]认为2,4-D 2.00 mg/L时朱顶红鳞片愈伤组织诱导率最高。本研究中,叶片在2,4-D 2.00 mg/L 和TDZ 0.50 mg/L 激素浓度组合下愈伤组织诱导率最佳,与于波等[14]的研究结果基本一致,但是诱导率要低,其原因可能是基因型和外植类型不同所导致。
诱导出的愈伤组织具有胚性能进行快速继代增殖和分化是建立高效愈伤组织再生体系的关键,朱顶红的愈伤组织可直接分化出芽或形成体细胞胚。已知2,4-D 或TDZ 可诱导体细胞胚,但是对体胚的发育有抑制作用[27],HUANG 等[28]研究认为2,4-D 与TDZ 组合使用会抑制朱顶红体细胞胚进一步发育形成完整植株,我们在预备实验中也获得了这样的结论。6-BA 在朱顶红再生体系建立中使用频率很高,很多研究表明,6-BA 是朱顶红不定芽增殖的主要因子[29]。而2,4-D、TDZ常应用于愈伤组织的诱导和增殖。本研究中,2,4-D 和TDZ 有利于愈伤组织的诱导,但在添加2,4-D、TDZ 或其组合的培养上,大部分愈伤组织会生长停滞或死亡,而将愈伤组织置于合适的6-BA 浓度的培养基上进行愈伤组织的有效增殖。本研究筛选得到6-BA 浓度为2.00 mg/L 时,愈伤组织的增殖效果最好,增殖倍数可达到4.01 倍,在20 d 的继代周期内,愈伤组织不会分化,但如果不及时转接培养,愈伤组织会分化。
6-BA 和KT 同属嘌呤型细胞分裂素[30],以往研究表明,6-BA 在朱顶红不定芽诱导方面也具有较优表现[10, 31],AMIR 等[32]研究认为6-BA 对朱顶红不定芽的诱导效果明显优于KT,且诱导所需时间更短,当6-BA 浓度为4.00 mg/L 时,分生组织不定芽诱导率达84%。此外,不少学者将6-BA与NAA 结合进行朱顶红不定芽诱导均取得较好的结果[23, 33-35]。但是,鲁娇娇等[25]研究表明,在6-BA 和NAA 两种植物生长调节剂配合下,朱顶红花孔雀和黑天鹅的鳞片启动率很低。当培养基中含有合适浓度的细胞分裂素KT 时,可以提高分蘖的不定芽和不定根数[36]。本研究中,在不同浓度6-BA、KT 的MS 培养基中添加NAA,愈伤组织的分化效果并不明显,使用单一的植物生长调节剂时,KT 的分化效果显著优于6-BA,最佳愈伤组织分化培养基为MS+KT 0.50 mg/L 时,分化率可达100%,分化系数达10.59。由此可推断,不同种或属的植物对细胞分裂素及与NAA 结合的分化效果不同。
本研究以朱顶红曼谷玫瑰叶片为外植体,建立了愈伤组织途径的高效再生体系,获得的愈伤组织能够快速增殖,每15~20 d 時间内增殖倍数可达4.01,多次继代后依旧能保持原始状态,即质地蓬松,颜色金黄,具有较强的分化能力。平均每0.5 cm×0.5 cm 的愈伤组织团60 d 就可分化出5.67 株可直接生根的小苗。以朱顶红曼谷玫瑰试管苗叶片为外植体建立的愈伤组织再生体系,不仅可以增加增殖倍数,缩短增殖周期,满足种苗工厂化育苗生产的需求,还能为有效的转基因体系的建立提供基础并应用于分子育种。

