油莎豆生长素受体TIR1基因家族鉴定及响应盐胁迫和外源IBA的表达分析
李昕儒 高宇 苗淑楠 李腾 董书言 史先飞 薛金爱 季春丽 李润植

关键词:油莎豆;运输抑制剂响应蛋白1(TIR1);吲哚丁酸(IBA);盐胁迫;基因表达
中图分类号:S565.9 文献标识码:A
油莎豆(Cyperus esculentus L.)又称油莎草、老虎豆等,是莎草科莎草属多年生草本植物[1],其块茎富含油脂、蛋白质、淀粉、糖等营养成分[2]。油莎豆是目前发现的唯一已知地下部分营养器官积累大量油脂的作物[3],油脂中油酸含量高达68%~75%,品质和营养成分可媲美橄榄油、榛子油等优质食用油,且优于菜籽油及芝麻油等[4]。油莎豆块茎还可制作其他食品或药品,地上部分亦可用作优质牧草饲料,是一种集油、粮、草、饲、药于一体的多用途经济作物[4-5]。油莎豆种植范围广,具有适应性强、高抗逆性等特点[6-7],也是植物抗逆性研究的理想作物材料。
在农业生产中,作物生长常受到非生物胁迫的危害。干旱、洪涝、高温、低温、盐碱和重金属等非生物胁迫直接影响植物新陈代谢、生长和发育,不仅会降低作物产量,甚至在极端情况下会导致植物死亡[8]。盐胁迫是最普遍的非生物胁迫之一,严重影响全球农业生产[9]。盐胁迫破坏植物渗透平衡系统,导致植物膜脂过氧化,抑制营养物质的吸收,影响植物正常生长发育[10]。植物进化出各种机制抵御盐胁迫的侵害,包括调节离子稳态、激活渗透胁迫途径、介导植物激素信号传导以及调节细胞骨架动力学和细胞壁组成等[11]。其中,植物激素在细胞间的信号转导,不仅调节植物生长和发育,还可以调节植物非生物胁迫响应,在植物抵御非生物胁迫的应答中起着至关重要的作用[12]。生长素作为一类生长促进激素,参与植物对盐胁迫信号的感知和防御,可以通过调节气孔闭合来调节水分平衡和渗透性稳态,进而提高植物对盐胁迫的耐性[10]。
运输抑制剂响应蛋白1(transport inhibitorresponse protein 1,TIR1)是植物响应生长素信号的一类重要蛋白[13]。TIR1 蛋白N 端有引起蛋白水解的SCF 蛋白复合物成分之一F-box 结构域,C 端有富集多个亮氨酸序列(LRR)的AMN1 超结构域[14]。生长素与受体TIR1 蛋白结合后,TIR1编码F-box 蛋白可以与S 期激酶相关蛋白1(SKPI)类似物ASK1 和ASK2 及Cullin 形成SCF(SKPI/cullin/F-box)型26S 泛素蛋白酶复合体,该复合体与生长素以及Aux/IAA 转录因子相互作用[15],促使Aux/IAA 蛋白经泛素化修饰后进入26S 蛋白酶体途径降解,进而激活与生长素反应相关的基因[16]。在拟南芥(Arabidopsis thaliana)中过表达MiR393–TIR1(mTIR1)基因,生长素信号传导增加可能触发生长素介导的下游途径,通过渗透调节和增加Na+排出来增强植物盐胁迫抗性,从而显著增强转基因拟南芥抗盐能力[17]。大白菜(Brassica rapa)BrTIR1 启动子上存在响应盐胁迫的顺式作用元件,BrTIR1 在大白菜响应盐胁迫中发挥重要作用[18]。鹽胁迫信号对植物生长素受体基因TIR1 的表达也起着调控作用,如NaCl 胁迫处理能够调控灰绿藜(Chenopodium glaucum L.)CgTIR1 基因的表达[19]等。油莎豆作为一种抗逆性强、综合利用价值高的粮油兼用新型经济作物,关于CeTIR1 基因的生物学特性、响应盐胁迫和生长素信号的调控等鲜有报道。
本研究基于实验室的油莎豆转录组数据鉴定获得油莎豆CeTIR1 基因家族的编码序列并对其进行克隆;通过生物信息学分析其编码蛋白的序列特征、理化性质、高级结构和生物进化关系;测定盐胁迫及添加生长素处理后油莎豆幼苗POD、SOD 酶活性和MDA 含量;通过qRT-PCR分析油莎豆CeTIR1 基因组织表达特性及其在盐胁迫和添加生长素处理后的表达谱。本文旨在为后续深入研究CeTIR1 功能和CeTIR1 参与外源生长素介导植物盐胁迫抗逆性奠定基础。
1 材料与方法
1.1 材料
油莎豆种质材料为山西农业大学分子农业与生物能源研究所保存的晋农1 号,2021 年4 月22日种植于山西农业大学农学院农作站。取晋农1号萌发时期(80 d)的油莎豆根、叶及块茎样品,液氮速冻后保存于?80 ℃备用。另选取大小均匀、饱满、无虫眼的油莎豆块茎,发芽预处理后,置于人工气候培养箱中培养,设置培养条件为温度(252)℃、光暗比16/8。选取生长25 d,长势良好且基本均匀一致的油莎豆幼苗分别用Hoagland营养液添加250 mmol/L NaCl , 250 mmol/LNaCl+1 mg/L IBA 处理,并以不添加NaCl 和IBA的幼苗为对照(CK),取处理0、3、12、24、48、72 h 时的油莎豆幼苗,经液氮冷冻后,存于?80 ℃冰箱备用。
1.2 方法
1.2.1 油莎豆CeTIR1 基因克隆 基于本实验室油莎豆转录组数据库筛选鉴定出4 个油莎豆TIR1基因( CeTIR1-1 、CeTIR1-2 、CeTIR1-3 和CeTIR1-4)。根据4 个基因的CDS 序列,设计PCR 引物(表1)用于基因编码序列的克隆。以油莎豆萌发时期块茎的cDNA 作为模板, 用TOBOYO 的KOD-Plus-Neo 高保真酶扩增目的基因CDS 序列。取PCR 产物在1.2%的琼脂糖凝胶上进行电泳检测。用EasyPure? Quick Gel ExtractionKit(TRANs)试剂盒对正确的目的片段进行回收纯化。使用核酸仪测量产物浓度,将PCR 产物连接到pMD18-T 载体上,转入到大肠杆菌DH5α 感受态细胞中,转化产物涂板后挑取单克隆菌落,菌检为阳性后送至北京擎科生物科技有限公司测序。
1.2.2 生物信息学分析 利用NCBI 数据库在线工具CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对从本实验室油莎豆转录组数据鉴定获得的CeTIR1 基因编码的氨基酸序列的保守结构域进行分析。使用MEME(https://memesuite.org/meme/tools/meme)在线软件预测CeTIR1基因家族编码蛋白的Motif;利用Expasy 网站提供的Protparam(https://web.expasy.org/protparam/)工具分析CeTIR1 基因家族编码蛋白的氨基酸组成、理论等电点、相对分子质量和原子组成等理化性质;使用在线分析网站TMHMM Server 2.0(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)对CeTIR1 蛋白跨膜区进行预测分析;运用Expasy 网站提供的Protscale 工具(https://web.expasy.org/protscale/)对蛋白疏水区域进行预测分析;使用在线分析网站PSORT II(https://psort.hgc.jp/form2.html)预测CeTIR1 基因家族编码蛋白的亚细胞定位;使用SOPMA 网站(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白二级结构的预测分析;通过在线软件Phyre2(http://www. sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)进行蛋白三级结构建模分析。使用Genedoc 软件对CeTIR1 基因家族编码蛋白和其他物种TIR1 蛋白的氨基酸序列进行多序列比对; 利用邻接法(neighbor-joining,NJ)通过MEGA 7.0 软件构建所测物种TIR1 蛋白(表2)的系统发育树,参数设置bootstrap 1000,其余参数默认。
1.2.3 抗氧化相关酶活性测定 超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法测定,过氧化物酶(POD)活性采用愈创木酚法测定,丙二醛(MDA)含量采用硫代巴比妥酸法测定[20]。
1.2.4 油莎豆CeTIR1 基因表达实时荧光定量PCR 分析 利用Primer 6.0 设计检测CeTIR1 基因表达的qRT-PCR 引物,以Ce18S RNA 为内参基因(表1)。采用北京全式金公司的TransZol Plant试剂盒提取总RNA 。使用Genstar 公司的StarScript Ⅱ cDNA 第一链合成试剂盒进行反转录。使用TaKaRa 公司的TB Green? Premix ExTaqTM Ⅱ试剂盒,进行实时荧光定量PCR 分析。反应程序为:95 ℃ 30 s,95 ℃ 5 s,62 ℃ 1 min,39 个循环,设置3 次生物学重复和3 次技术重复。采用2?ΔΔCT 法[21]计算基因相对表达量。
1.3 数据处理
使用SPSS Statistics 26.0 软件进行数据分析。
2 结果与分析
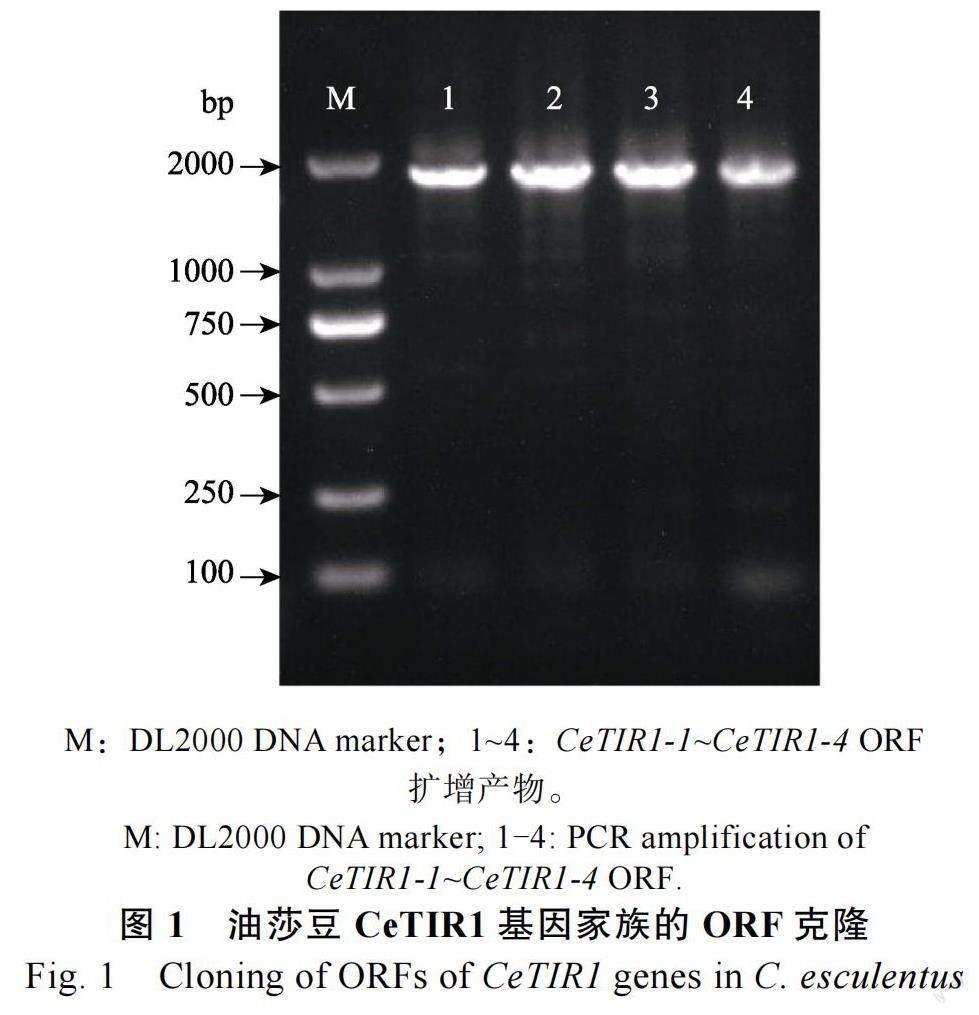
2.1 油莎豆CeTIR1 基因的ORF克隆
用晋农1 号块茎cDNA 作为模板进行PCR 扩增,扩增产物电泳分离鉴定结果如图1 所示,PCR反应扩增得到的目的基因条带与预期相符。经测序验证,油莎豆CeTIR1 基因家族成员CeTIR1-1、CeTIR1-2、CeTIR1-3 和CeTIR1-4 基因的ORFs 分别为1770、1875、1836、1800 bp。经测序鉴定,扩增到各CeTIR1 基因的ORF 序列与前期测得的转录组数据一致。
2.2 油莎豆CeTIR1 蛋白的理化性质分析
对CeTIR1 基因家族编码蛋白保守结构域进行分析,结果显示(图2),CeTIR1 家族蛋白与拟南芥AtTIR1 都含有典型的3 个结构域:富集多个亮氨酸序列(LRR)的AMN1 超结构域、F-box_5结构域(为SCF 型泛素E3 连接酶复合体中的一个组分引起蛋白水解)和Transp_inhibit 结构域(是LRR 区域的特定单位)。Motif 预测结果显示(图3),CeTIR1 家族蛋白有6 个Motif,与AtTIR1 结构相似。CeTIR1 家族蛋白与拟南芥AtTIR1 类似,有典型的TIR1 蛋白保守结构域和保守Motif,预示着油莎豆CeTIR1 可能與拟南芥AtTIR1 有相似的生物学功能。
4 个CeTIR1 蛋白之间理化性质差异不明显(表3)。蛋白序列最长为CeTIR1-2(624 aa),最短为CeTIR1-1(589 aa)。CeTIR1 理论等电点在5.13~6.72 之间,不稳定系数在42.64~46.33 之间,均为酸性不稳定蛋白。除CeTIR1-3 蛋白为疏水性蛋白,其余CeTIR1 蛋白均为亲水性蛋白。CeTIR1 蛋白均无跨膜区域。亚细胞定位分析显示CeTIR1 蛋白均位于细胞核内。CeTIR1 蛋白理化性质相似,预示着它们可能发挥类似的功能。
2.3 油莎豆CeTIR1 蛋白的高级结构预测分析
CeTIR1 蛋白二级结构预测结果显示(表4),4 个CeTIR1 蛋白主要是由α-螺旋、延伸链、β-转角和无规则卷曲组成,其中α-螺旋和无规则卷曲占比较高。CeTIR1 蛋白预测三级结构结果显示(图4),以膜蛋白c2p1nE 为模版,CeTIR1 家族蛋白和AtTIR1 蛋白都为螺旋环状结构。AtTIR1蛋白与模版的相似性为96%。CeTIR1 家族蛋白中,CeTIR1-1、CeTIR1-2、CeTIR1-3 和CeTIR1-4蛋白与模版的相似性分别为96%、91%、93%和95%。通过以上分析预测4 个CeTIR1 家族蛋白可能发挥与AtTIR1 蛋白相似的生物学功能。
2.4 油莎豆CeTIR1 蛋白多序列比对和系统进化树
多序列比对结果显示(图5),4 个CeTIR1蛋白和拟南芥AtTIR1 蛋白具有较高的相似度,都含有典型的F-box 蛋白结构域、AMN1 超结构域和Transp_inhibit 结构域。通过MEGA 7.0 软件构建油莎豆CeTIR1 蛋白与其他物种TIR1 蛋白的系统发育树,结果显示(图6),4 个油莎豆CeTIR1的进化关系有明显的差异。从多序列比对和进化关系上来看,油莎豆CeTIR1-1 和CeTIR1-2 在同一分支与禾本目莎草科的康藏嵩草ClTIR1 关系较近,序列一致性值分别为78.68%和69.12%;CeTIR1-3 与木犀科油橄榄OeTIR1 关系较近,序列一致性值为39.02%;油莎豆CeTIR1-4 与十字花科油菜BnTIR1 关系较近,序列一致性值为51.31%。进化关系上的差异,预示着它们可能差异化行使功能。
2.5 油莎豆CeTIR1 基因家族组织表达特性分析
为进一步探究油莎豆CeTIR1 基因家族在不同组织器官中的表达特性,以晋农1 号的根、叶、块茎的cDNA 为材料,以Ce18S rRNA 作为内参基因,qRT-PCR 检测各CeTIR1 基因的表达量。结果如图7 所示,油莎豆CeTIR1 基因家族的表达特性呈多样性。油莎豆CeTIR1 基因家族在各组织中均有表达,其中,在根中CeTIR1-2 表达量最高,在叶中CeTIR1-4 表达量最高,在块茎中CeTIR1-2 表达量最高。相比较而言, 油莎豆CeTIR1 基因家族均在块茎组织中高表达,在根和叶组织中表达量较低。
2.6 外源IBA 可缓解盐胁迫对油莎豆幼苗生长的损害
盐胁迫处理下,油莎豆中SOD 和POD 活性随处理时间的延长呈先增加后下降的趋势,在48 h 时均达到最大值后开始下降。对盐胁迫下的油莎豆幼苗外源添加IBA 处理12、24 h 时,油莎豆幼苗SOD 活性升高趋势明显,处理48 h 时幼苗SOD 活性下降。添加IBA 处理的SOD 活性仍高于仅盐胁迫处理的SOD 活性(图8)。外源IBA处理下,POD 活性相比仅盐胁迫处理的POD 活性升高。在IBA 处理48 h 时,幼苗POD 活性达到峰值(图8)。盐胁迫处理对油莎豆幼苗产生一定的损伤,对盐胁迫下的油莎豆幼苗外源添加IBA 处理显著提升油莎豆幼苗抵御盐胁迫的抗性。因此,IBA 处理可以缓解盐胁迫对于油莎豆幼苗的伤害。
盐胁迫处理下,MDA 的含量缓慢升高且在处理72 h 时达到最高,油莎豆幼苗细胞膜过氧化程度愈加严重。对盐胁迫下的油莎豆幼苗外源添加IBA 处理后,幼苗MDA 含量降低(图8)。幼苗细胞膜过氧化程度随盐胁迫处理时间增加而加剧,外源IBA 减轻了盐胁迫下油莎豆幼苗细胞膜的损伤。
2.7 油莎豆CeTIR1 基因在盐胁迫及外源IBA处理后的表达谱分析
油莎豆CeTIR1 基因在盐胁迫下的表达分析如图9 所示,随着盐胁迫处理时间延长,CeTIR1-1和CeTIR1-3 表达量逐渐升高,在24 h 时达到最高后下降。CeTIR1-4 表达量随处理时间延长逐渐升高。CeTIR1-2 表达量在3 h 时升高,在12 h 时降低,而后又在72 h 时显著升高。盐胁迫下油莎豆幼苗外源添加IBA 处理,CeTIR1-1,CeTIR1-3和CeTIR1-4 表达量在24、48、72 h 时相比盐胁迫处理条件下这3 个基因表达量显著降低。然而,CeTIR1-2 表达量在3、12、48、72 h 时相比盐脅迫处理显著升高,且在不同时间相对表达量均高于盐胁迫处理。以上结果表明CeTIR1-1 、CeTIR1-2、CeTIR1-3 和CeTIR1-4 可能都参与盐胁迫抗逆反应。尤其是CeTIR1-2 基因在外源IBA处理时高表达。可见,外源IBA 处理显著上调了CeTIR1-2 基因表达,CeTIR1-2 可能进一步激活相关信号通路及其相关生理生化反应,从而缓解了盐胁迫对油莎豆幼苗的损伤。由此推测CeTIR1-2基因可能是参与调控油莎豆幼苗盐胁迫抗性的重要基因。
3 讨论
土壤盐渍化会严重阻碍植物生长发育,降低作物产量,给全球农业生产和粮食安全带来严重威胁[22-23]。在植物抵御非生物胁迫过程中,生长素起到了提高植物对非生物胁迫适应性的关键作用[24]。生长素信号通路离不开上游的调控因子生长素受体的参与,生长素受体是控制生长素信号通路的开关[25]。TIR1 是一种被广泛研究的生长素受体,可介导Aux/IAA 蛋白的快速降解,进而导致生长素调控基因表达的变化[26]。因此,研究油莎豆生长素受体CeTIR1 基因是否参与生长素响应和盐胁迫应答及其作用机制,对于油莎豆抗逆性改良和提高油莎豆在盐碱地等逆境种植管理有重要科学参考价值。
本研究通过生物信息学分析在油莎豆转录组数据库中鉴定出油莎豆4 条TIR1 序列。通过功能结构域分析,4 条CeTIR1 基因和拟南芥AtTIR1基因高度相似,编码蛋白都含有F-box 结构域。预测其有TIR1 蛋白功能,可响应生长素信号且在非生物胁迫应答中起作用。通过蛋白高级结构分析和多序列比对显示,油莎豆CeTIR1 蛋白与拟南芥AtTIR1 结构类似。预示其亦可与生长素、Aux/IAA 转录因子相互作用,这与百子莲ApTIR1蛋白的功能类似[27]。通过系统进化树分析,油莎豆CeTIR1 蛋白与来自禾本目莎草科的康藏嵩草、木犀科的油橄榄和十字花科的油菜的TIR1 蛋白等同源性较高。
在不同物种中TIR1 发挥的功能亦有不同,可能与物种本身特性有关。有报道表明,TIR1 可能调控龙眼体胚发生[28],与茶树越冬芽休眠密切相关[29],可能与红麻花药败育有关[30]。亦有研究表明TIR1 基因可以增强植物对盐胁迫的抗逆性。例如,盐穗木HcTIR1 响应高盐胁迫且其表达量与盐胁迫浓度呈现负相关性[19]。拟南芥过表达MiR393–TIR1(mTIR1)基因的植株抗盐能力显著增强[17] 。本研究发现, 油莎豆CeTIR1-1 、CeTIR1-2、CeTIR1-3 和CeTIR1-4 均响应盐胁迫信号,在NaCl 处理时表达量显著增加。盐胁迫处理下油莎豆幼苗抗氧化酶活性升高,在48 h 时达到峰值后下降,MDA 的含量也有所升高,说明盐胁迫对油莎豆幼苗生长造成了一定程度的损害。外源IBA 处理盐胁迫下油莎豆幼苗的SOD、POD酶活性提高,MDA 含量降低,说明外源添加IBA使盐胁迫下油莎豆幼苗的盐毒害有所缓解。特别是,油莎豆CeTIR1-2 在外源添加IBA 处理后表达量显著增加, 预示着外源IBA 显著上调CeTIR1-2 基因表达。有研究表明,外源添加一定浓度的IBA 处理沙冬青幼苗能够促进盐胁迫下幼苗的生长,提高幼苗的耐盐性[31]。外源生长素能够缓解盐胁迫对小麦幼苗伤害,强化小麦幼苗的抗盐能力[32]等。但关于TIR1 响应盐胁迫和生长素信号的详尽分子机制的研究还未见报道。外源添加IBA 对盐胁迫下的油莎豆幼苗起到一定程度的缓解作用,可提高盐胁迫下油莎豆幼苗的抗氧化性,还可能调控油莎豆生长素信号的转导途径。这对于提高植物耐盐性和改善盐碱地有重要意义。综合分析显示,CeTIR1-2 是通过生长素调控来响应盐胁迫的一个重要靶标基因。后期将对CeTIR1-2 基因生物学功能等进行进一步深入研究,以阐明CeTIR1-2 介导的抗逆性调控作用机制。
4 结论
本研究基于油莎豆转录组数据鉴定到4 条油莎豆CeTIR1 基因并对其进行克隆,4 个CeTIR1s都含有典型的F-box 蛋白结构域、AMN1 超结构域和Transp_inhibit 结构域,均为定位于细胞核的无跨膜区域的不稳定蛋白。油莎豆CeTIR 基因均在块茎组织中高表达,在根和叶组织中表达量较低。油莎豆幼苗在盐胁迫下抗氧化酶活性和MDA含量升高,添加外源IBA 可缓解盐胁迫对油莎豆幼苗生长的不利影响。盐胁迫可诱导CeTIR1 基因的表达,尤其是外源IBA 可显著上调CeTIR1-2基因表达,进而激活相关信号通路和胁迫应答体系,提高油莎豆幼苗抗逆性。CeTIR1-2 可能是介导生长素信号通路和油莎豆胁迫应答反应的一个重要调节因子。

