人脐带间充质干细胞源外泌体减缓衣霉素诱导的肾小管上皮细胞凋亡的研究
雷艳?詹世淮?施晓华?杨兰?王佳伟 王水良?张胜行
【摘要】目的 研究人臍带间充质干细胞源外泌体(hUC-MSC-Exo)对衣霉素诱导的肾小管上皮细胞(HKC)凋亡的作用。方法 利用衣霉素诱导HKC产生内质网应激,CCK-8法检测细胞增殖活性;蛋白免疫印迹法检测内质网应激相关分子抗体葡萄糖调节蛋白78(GRP78)、GRP94和C/EBP同源蛋白(CHOP)的表达,流式细胞术检测细胞凋亡;hUC-MSC-Exo经分离与流式细胞术表面标志物鉴定后,检测不同浓度外泌体(0、40、60、80、100、150、200 μg/mL)对细胞活性的影响;resazurin法与流式细胞术分别检测外泌体与衣霉素共处理组的细胞增殖活性及细胞凋亡水平。结果 1、2、4 μg/mL衣霉素均能抑制HKC的细胞增殖活性并呈浓度依赖性;不同浓度衣霉素均可诱导HKC细胞内质网应激,并明显诱导细胞凋亡。100、150、200 μg/mL外泌体能增强细胞增殖活性;与衣霉素2 μg/mL组相比,衣霉素2 μg/mL+外泌体150 μg/mL组细胞增殖活性明显增强;此外,衣霉素2 μg/mL组细胞凋亡率为(14.16±1.58)%,衣霉素2 μg/mL+外泌体150 μg/mL组细胞凋亡率为(8.18±0.58)%,组间比较差异有统计学意义(P<0.05)。结论 间充质干细胞源外泌体能明显减缓衣霉素诱导的HKC细胞凋亡。
【关键词】内质网应激;间充质干细胞源外泌体;细胞凋亡;衣霉素;肾小管上皮细胞
Human umbilical cord mesenchymal stem cell-derived exosomes protect renal tubular epithelial cells against tunicamycin-induced apoptosis Lei Yan△, Zhan Shihuai, Shi Xiaohua, Yang Lan, Wang Jiawei, Wang Shuiliang, Zhang Shenghang. △Fujian Key Laboratory of Aptamers Technology, the 900th Hospital of Joint Logistics Support Force, Fuzhou 350025, China
Corresponding author, Zhang Shenghang, E-mail: fzzyyzsh@126.com
【Abstract】Objective To investigate the role of human umbilical cord mesenchymal stem cell-derived exosomes (hUC-MSC-Exo) in the tunicamycin-induced apoptosis of renal tubular epithelial cells (HKC). Methods Endoplasmic reticulum stress (ERS) was induced by tunicamycin in HKC cells. Cell proliferation was detected by CCK-8 assay. The expression levels of ERS-related proteins of glucose-regulated protein 78 (GRP78), GRP94 and C/EBP homologous protein (CHOP) were determined by Western blot. Cell apoptosis was assessed by flow cytometry. hUC-MSC-Exo were isolated and identified by flow cytometry. The effects of different concentrations of hUC-MSC-Exo (0, 40, 60, 80, 100, 150 and 200 μg/mL) upon cell activity were evaluated. Cell proliferation and apoptosis after co-treatment with hUC-MSC-Exo and tunicamycin were assessed by resazurin assay and flow cytometry. Results Treatment with 1, 2 and 4 μg/mL tunicamycin could inhibit the proliferation of HKC in a concentration-dependent manner. Different concentrations of tunicamycin could induce ERS and cell apoptosis in HKC. Treatment with 100, 150 and 200 μg/mL hUC-MSC-Exo could enhance cell proliferation. Compared with the 2 μg/mL tunicamycin group, cell proliferation was significantly increased in the 2 μg/mL tunicamycin and 150 μg/mL hUC-MSC-Exo co-treatment group (P < 0.05). The apoptosis rate in the 2 μg/mL tunicamycin group was (14.16±1.58)%, and (8.18±0.58)% in the 2 μg/mL tunicamycin and 150 μg/mL hUC-MSC-Exo co-treatment group, and the difference was statistically significant (P<0.05). Conclusion hUC-MSC-Exo can significantly alleviate HKC apoptosis induced by ERS.
【Key words】Endoplasmic reticulum stress; Mesenchymal stem cell-derived exosome; Apoptosis; Tunicamycin;
Renal tubular epithelial cell
内质网应激(ERS)是细胞应激的一种重要方式,内质网腔中未折叠或错误折叠的蛋白蓄积过多会导致ERS发生[1]。ERS参与了缺氧、肾缺血再灌注损伤(IRI)、肾毒性和炎症等引起的急性肾损伤(AKI)发病机制,这些病理状态均能诱导肾小管上皮细胞产生ERS,并诱导细胞凋亡[2-3]。衣霉素作为ERS的常用诱导剂,通过抑制N-糖基化并阻断N-乙酰葡糖胺磷酸转移酶,引起细胞内质网中未折叠蛋白的积累而诱导ERS[4-5]。人脐带间充质干细胞源外泌体(hUC-MSC-Exo)携带着蛋白分子、mRNA、微RNA及长链非编码RNA等作为细胞与细胞通信之间的联系[6]。研究表明,hUC-MSC-Exo通过抑制丝裂原活化蛋白激酶/细胞外调节蛋白激酶(MAPK/ERK)信号通路的激活而抑制肾小管上皮细胞的凋亡[7]。MSC-Exo通过上调miR-146b的水平从而抑制NF-κB活性和减轻炎症反应,降低脓毒症相关的AKI小鼠的血清肌酐和血尿素氮水平,抑制了肾小管细胞凋亡[8]。尽管MSC-Exo显示出肾脏保护作用,但MSC-Exo对ERS状态下肾小管上皮细胞的作用机制尚未阐明。本研究旨在研究ERS状态下MSC-Exo对肾小管上皮细胞凋亡的调控,现报道如下。
材料与方法
一、材 料
1. 试 剂
衣霉素购自瑞士Enzo Life Sciences公司。DMEM购自美国Hyclone公司。胎牛血清、 抗体葡萄糖调节蛋白78(GRP78)、GRP94、C/EBP同源蛋白(CHOP)、裂解的核糖聚合酶(c-PARP)、CD9、CD81、脂筏结构蛋白1(Flotin1)、 β-肌动蛋白(β-actin)、兔抗IgG、鼠抗IgG均购自美国Cell Signaling Technology公司。流式抗体CD63、CD9、CD81购自Biolenged公司。二辛可宁酸(BCA) 蛋白定量试剂盒购自美国Thermo公司。基于Luminol 的增强化学发光(ECL)底物试剂蛋白显色液购自德国Advansta公司。异硫氰酸荧光素(FITC)标记的Annexin Ⅴ凋亡检测试剂盒购自美国Biolenged公司。细胞计数试剂盒-8(CCK-8)细胞增殖检测试剂盒购自美国MedChem公司。Adamas life刃天青(resazurin)细胞活性检测染料购自上海泰坦科技股份有限公司。ExoQuick-TC外泌体提取试剂盒购自美国SBI公司。
2. 细 胞
人肾小管上皮细胞(HKC)细胞由中国科学院上海细胞生物学研究所提供;hUC-MSC由福建省干细胞应用工程技术研究中心提供,取P3代细胞进行研究。
二、方 法
1. 细胞培养
hUC-MSC培养于含10%胎牛血清、100 kU/L青霉素、100 kU/L链霉素的低糖培养基中;肾小管上皮细胞HKC培养于10%胎牛血清的DF12培养基中,细胞均置于含体积分数为5%CO2、饱和湿度的37 ℃培养箱中。
2. 脐带间充质干细胞源外泌体的分离
按文献[9]方法操作:取P3代的hUC-MSC,無血清纯DMEM低糖培养基中培养48 h后收集上清,经3 000×g 15 min离心去除细胞碎片,按照ExoQuick-TC外泌体提取试剂盒的说明书,将10 mL上清液与2 mL ExoQuick-TC试剂轻轻混合,于4℃过夜(至少12 h),在孵育期间离心管保持直立且不能摇动。经1 500×g离心30 min吸弃上清液,1 500×g离心5 min后,轻轻吸弃所有的液体,避免干扰到底部的外泌体沉淀。最后经100~500 μL无菌的磷酸盐缓冲液(PBS)重悬即可得到外泌体溶液。
3. 不同浓度衣霉素对细胞存活的影响
采用CCK-8法:HKC正常传代培养,胰酶消化后镜下计数细胞,5 000个/孔接种于96孔板,次日用含0.5%胎牛血清DMEM高糖培养基将衣霉素稀释成不同的浓度(0、1、2、4 μg/mL),每孔100 μL,培养24 h,每孔加入10 μL的CCK-8溶液,将培养板置于培养箱内温育2 h,将96孔板置于酶标仪上,测定450 nm处吸光度值,以对照组为100%,则细胞存活率=(实验组吸光度值/对照组吸光度值)×100%。
4. 不同浓度外泌体对细胞增殖的影响
每孔5 000个HKC接种于96孔板中,次日加入不同浓度[0(Con)、40、60、80、100、150、200 μg/mL]外泌体或2 μg/mL衣霉素作用24 h后,按照上述CCK-8法测定450 nm吸光度。
5. resazurin法检测细胞增殖活性
每孔5 000个HKC接种于24孔板中,次日实验分组为对照组、衣霉素2 μg/mL组、衣霉素2 μg/mL +外泌体150 μg组,作用24 h后,每孔加入30 μL的resazurin溶液,在CO2培养箱中孵育4 h后,在590 nm处测定荧光强度。
6. 蛋白免疫印迹法检测蛋白表达
各组收集的总蛋白用BCA法检测总蛋白浓度,随后取30 μg蛋白样品进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移至聚偏二氟乙烯膜(PVDF)上。室温下4%牛血清白蛋白BSA摇床上封闭1 h后,与1∶1 000稀释的一抗4 ℃孵育过夜。三羟甲基氨基甲烷盐酸盐-吐温20(TBST)洗膜3次,加入不同比例稀释的辣根过氧化物酶(HRP)标记的二抗,室温孵育1 h,经TBST、PBS各洗膜3次后,加入ECL发光液孵育3 min后进行曝光显影。各蛋白表达量均以 β-actin为内参。
7. 流式荧光激活细胞分选术检测细胞凋亡
HKC经不同浓度衣霉素或与外泌体联合处理24 h,胰酶消化后收集细胞沉淀,经预冷的细胞染色液洗涤2次,加入试剂盒中的结合液重悬至细胞浓度为1×107/mL。每管吸取100 μL的细胞悬液,加入5 μL FITC Annexin Ⅴ和10 μL碘化丙啶(PI)混匀后避光染色15 min。每管加入400 μL 结合液重悬后即上机检测。同时设置正常组细胞不染色调电压,经FITC Annexin Ⅴ和PI分别单染的细胞调补偿。
8. 流式细胞术检测外泌体表面标志物
将提取的40 μL外泌体与5 μL硫酸盐微珠室温共孵育15 min,加入5 μL 100 μmol/L的BSA溶液,室温孵育15 min。加入1 mL PBS孵育75 min,580×g离心5 min,弃上清液。将外泌体微珠(beads)的结合体中加入1 mL 100 mmol/L的甘氨酸溶液室温孵育30 min,经离心PBS洗涤2次后,重悬在350 μL PBS中,每管50 μL分装于流式管中,加入CD9、CD63、CD81的一抗(1∶200)避光孵育45 min,离心重悬后立即上机检测。
三、统计学处理
采用SPSS 16.0分析结果,CCK-8法检测细胞增殖活性,每个浓度5个复孔,取各浓度的平均值进行分析;荧光强度检测重复3次,每次3个复孔;流式细胞术分析3次重复实验的数据,取各次实验的均值为最后结果。连续变量以表示,多组间比较使用单因素方差分析,多重比较使用Dunnett-t检验。P < 0.05为差异有统计学意义。
结果
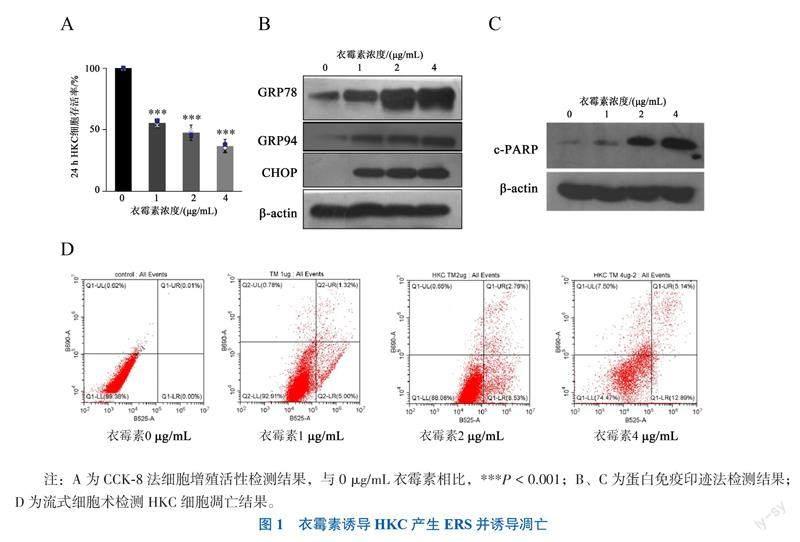
一、衣霉素诱导HKC细胞产生ERS并诱导凋亡
不同浓度衣霉素(0、1、2、4 μg/mL)作用HKC 24 h的细胞存活率总体比较差异有统计学意义 (F = 26.650,P = 0.001),随后使用Dunnett-t检验显示,1、2、4 μg/mL衣霉素均能抑制细胞增殖(P均< 0.05),且细胞存活率随着衣霉素浓度增加呈下降趋势(图1A)。1、2、4 μg/mL衣霉素均能诱导ERS相关蛋白GRP78、GRP94和CHOP表达上调(图1B),2、4 μg/mL衣霉素诱导下的细胞凋亡早期标志物c-PARP蛋白表达增强(图1C);流式细胞术显示,不同浓度衣霉素(0、1、2、4 μg/mL)作用HKC 24 h的细胞凋亡率总体比较差异有统计学意义(F = 59.960,P < 0.001),且1、2、4 μg/mL衣霉素作用下HKC凋亡加重(P均< 0.05),其中1、2、4 μg/mL衣霉素作用于HKC 24 h的细胞凋亡率分别为(6.32±0.23)%、(11.29±2.89)% 和(18.03±0.21)%(图1D)。
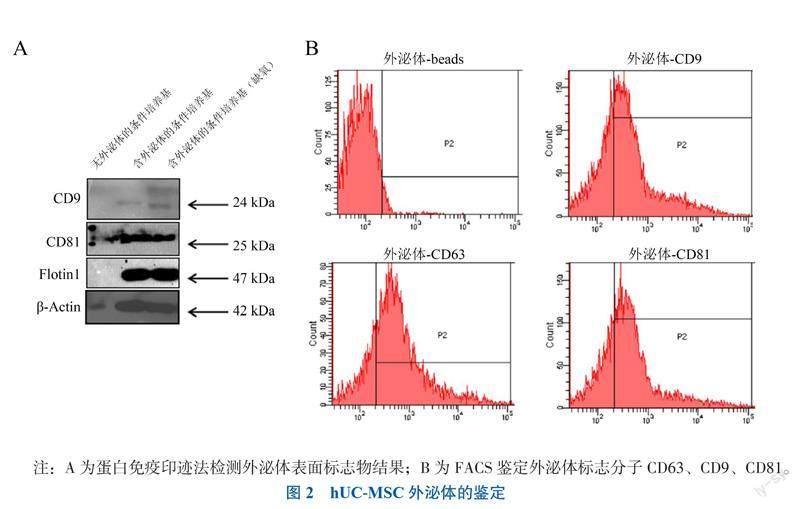
二、hUC-MSC外泌体的鉴定
蛋白免疫印迹分析显示,常氧及缺氧培养条件下hUC-MSC外泌体均共表达CD9、CD81和Flotin1这些外泌体的代表性标志物。流式细胞术检测进一步证实来源于hUC-MSC外泌体中CD9(59.2%)、CD63(73.4%)和CD81(63.5%)均呈阳性表达。见图2。
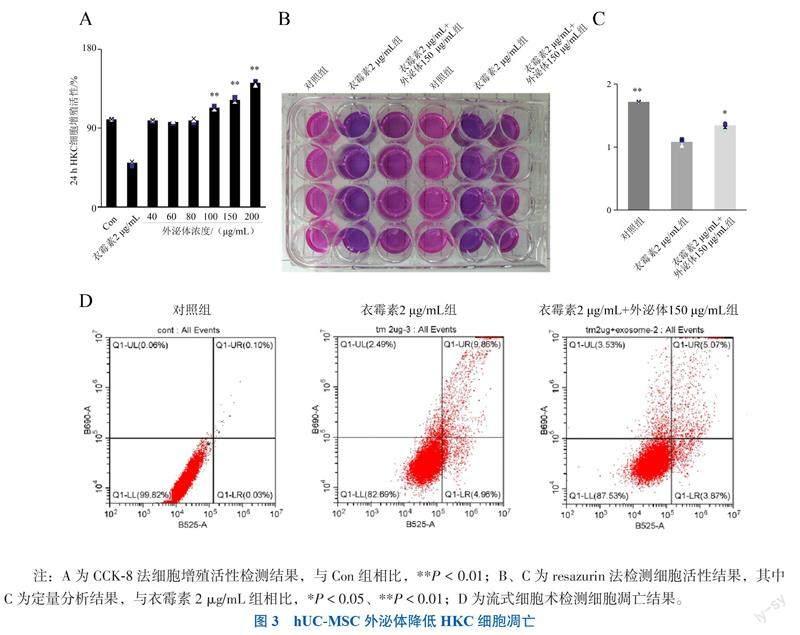
三、hUC-MSC-Exo对HKC细胞增殖和凋亡的影响
不同组别作用HKC 24 h的细胞增殖活性总体比较差异有统计学意义 (F = 449.200,P < 0.001),随后使用Dunnett-t检验发现与对照组相比,加入40、60、80 μg/mL外泌体未明显促进HKC的细胞增殖活性,而加入100 μg/mL 外泌体处理的HKC细胞增殖活性為113.41%(P = 0.006);经150 μg/mL和200 μg/mL 外泌体处理HKC细胞增殖活性分别为122.51%(P = 0.004)和141.68%(P = 0.001),见图3A。resazurin法检测细胞活性结果表明,衣霉素2 μg/mL组的荧光强度低于对照组(P = 0.002),而衣霉素2 μg/mL +外泌体150 μg组的荧光强度高于衣霉素组(P =0.012),见图3B、C。对照组、衣霉素2 μg/mL组、衣霉素2 μg/mL +外泌体150 μg组的细胞凋亡率分别为(0.18±0.01)%、(14.16±1.58)%、(8.18%±0.58)%,总体比较差异有统计学意义(F = 152.000,P < 0.001),对照组与衣霉素2 μg/mL组、衣霉素2 μg/mL组与衣霉素2 μg/mL +外泌体150 μg组比较差异均有统计学意义(P均< 0.05),见图3D。
讨论
肾脏缺氧/缺血、重金属毒性、抗癌免疫抑制药及急慢性炎症反应等多种因素均是AKI的诱因,最终都会导致肾小管上皮细胞损伤,严重的损伤诱导肾小管上皮细胞凋亡[10-11]。ERS和AKI之间的关系已被体外和体内实验所证实,AKI患者的肾活检中,ERS标志分子物表达与AKI的严重程度密切相关[12]。肾脏缺血再灌注后近端小管细胞Grp78蛋白表达快速增加,诱导未折叠蛋白反应(UPR)启动,在缺血损伤初期发挥保护作用,在严重ERS的状态下通过CHOP促进caspase的级联反应凋亡信号通路,促进细胞凋亡[1]。
MSC-Exo在治疗AKI中起重要作用,然而,MSC-Exo对ERS诱导的肾小管上皮细胞凋亡的分子机制研究还很局限,因此研究MSC-Exo对ERS诱导的肾损伤的分子机制具有重要的现实意义。本研究中不同浓度的衣霉素(1、2、4 μg/mL)均能诱导HKC细胞产生ERS,相关的分子GRP78、GRP94和CHOP表达上调,并呈浓度依赖性;流式细胞术检测结果也表明ERS状态下能诱导HKC细胞凋亡。hUC-MSC-Exo处理组能明显增强细胞增殖活性;衣霉素诱导组细胞凋亡率为(14.16±1.58)%,而外泌体与衣霉素共处理组细胞凋亡率为(8.18±0.58)%,组间比较差异有统计学意义。笔者所在课题组的前期研究表明,hUC-MSC-Exo能通过携带的miR-21抑制ERS和p38 MAPK的磷酸化,从而减缓ERS并明显降低了胰岛内皮细胞的凋亡率[13]。本研究结果进一步表明,hUC-MSC-Exo能明显减缓衣霉素诱导的肾小管上皮细胞凋亡,从而在AKI中发挥保护作用。
已有研究发现,MSC-Exo可通过激活AKT和ERK信号通路,减轻髓核细胞ERS诱导的细胞凋亡[14]。Buono等[15]以衣霉素诱导角膜内皮细胞ERS为模型,MSC释放的细胞外囊泡(EV)能够诱导人角膜内皮细胞中ERS相关基因ATF4、GRP78、XBP1、CHOP显著下调,并抑制caspase-3蛋白的表达,其机制是通过MSC-EV中与ERS靶向性的微RNA分子,如miR-222-3p、miR-125b-5p、miR-21-5p转移至角膜内皮细胞而发挥潜在的治疗作用。Xie等[16]的研究表明MSC-Exo中miR-31-5p负调节ERS分子ATF6,通过miR-31-5p/ATF6/ER应激通路调节抑制椎体终板软骨细胞凋亡和钙化,这表明MSC-Exo在不同的ERS模型中均发挥一定的抗凋亡作用。本研究中,在ERS状态下,MSC-Exo可以减缓衣霉素诱导的肾小管上皮细胞凋亡,但外泌体发挥作用的信号通路及外泌体中的何种成分参与了ERS的调控将是我们下一步研究中要关注的重点。
综上所述,本研究表明hUC-MSC-Exo能明显抑制ERS状态下肾小管上皮细胞凋亡。
参 考 文 献
[1] Shu S, Zhu J, Liu Z, et al. Endoplasmic reticulum stress is activated in post-ischemic kidneys to promote chronic kidney disease. EBioMedicine, 2018, 37: 269-280.
[2] Sicari D, Delaunay-Moisan A, Combettes L, et al. A guide to assessing endoplasmic reticulum homeostasis and stress in mammalian systems. FEBS J, 2020, 287(1): 27-42.
[3] Maekawa H, Inagi R. Pathophysiological role of organelle stress/crosstalk in AKI-to-CKD transition. Semin Nephrol, 2019, 39(6): 581-588.
[4] Jackisch L, Murphy A M, Kumar S, et al. Tunicamycin-induced endoplasmic reticulum stress mediates mitochondrial dysfunction in human adipocytes. J Clin Endocrinol Metab, 2020, 105(9): dgaa258.
[5] Carlisle R E, Farooqi S, Zhang M C, et al. Inhibition of histone deacetylation with vorinostat does not prevent tunicamycin-mediated acute kidney injury. PLoS One, 2021, 16(11): e0260519.
[6] Phinney D G, Pittenger M F. Concise review: MSC-derived exosomes for cell-free therapy. Stem Cells, 2017, 35(4): 851-858.
[7] Liu B, Hu D, Zhou Y, et al. Erratum: Exosomes released by human umbilical cord mesenchymal stem cells protect against renal interstitial fibrosis through ROS-mediated P38MAPK/ERK signaling pathway. Am J Transl Res, 2021, 13(4): 3921-3922.
[8] Zhang R, Zhu Y, Li Y, et al. Human umbilical cord mesenchymal stem cell exosomes alleviate sepsis-associated acute kidney injury via regulating microRNA-146b expression. Biotechnol Lett, 2020, 42(4): 669-679.
[9] Shahir M, Mahmoud Hashemi S, Asadirad A, et al. Effect of mesenchymal stem cell-derived exosomes on the induction of mouse tolerogenic dendritic cells. J Cell Physiol, 2020, 235(10): 7043-7055.
[10] Yan M, Shu S, Guo C, et al. Endoplasmic reticulum stress in ischemic and nephrotoxic acute kidney injury. Ann Med, 2018, 50(5): 381-390.
[11] 梁日英, 符暢, 梁华, 等. 利拉鲁肽抑制ERS改善高脂饮食诱导的DN肾损害. 新医学, 2019, 50(11): 826-831.
[12] Rojas-Franco P, Franco-Colín M, Torres-Manzo A P, et al. Endoplasmic reticulum stress participates in the pathophysiology of mercury-caused acute kidney injury. Ren Fail, 2019, 41(1): 1001-1010.
[13] Chen J, Chen J, Cheng Y, et al. Mesenchymal stem cell-derived exosomes protect beta cells against hypoxia-induced apoptosis via miR-21 by alleviating ER stress and inhibiting p38 MAPK phosphorylation. Stem Cell Res Ther, 2020, 11(1): 97.
[14] Liao Z, Luo R, Li G, et al. Exosomes from mesenchymal stem cells modulate endoplasmic reticulum stress to protect against nucleus pulposus cell death and ameliorate intervertebral disc degeneration in vivo. Theranostics, 2019, 9(14): 4084-4100.
[15] Buono L, Scalabrin S, De Iuliis M, et al. Mesenchymal stem cell-derived extracellular vesicles protect human corneal endothelial cells from endoplasmic reticulum stress-mediated apoptosis. Int J Mol Sci, 2021, 22(9): 4930.
[16] Xie L, Chen Z, Liu M, et al. MSC-derived exosomes protect vertebral endplate chondrocytes against apoptosis and calcification via the miR-31-5p/ATF6 axis. Mol Ther Nucleic Acids, 2020, 22: 601-614.
(收稿日期:2022-09-30)
(本文編辑:林燕薇)

