子宫体中肾样腺癌累及子宫颈一例
杨欢?牟燕琳?李涛
【摘要】中肾样腺癌(MLA)是一种罕见的发生于子宫体和卵巢的恶性肿瘤。子宫体MLA与子宫颈中肾腺癌具有相似的组织学、免疫表型和分子病理特征;而且子宫体MLA可出现多种生长模式,易被误诊为低级别子宫内膜样腺癌、透明细胞癌和浆液性腺癌,故诊断该病极具挑战。该文报道了一例58岁子宫体MLA的病例,由于疾病罕见,诊断困难,且该病累及子宫颈,与子宫颈中肾腺癌的鉴别更是增加了该病例的诊断难度。该文通过分析该病例的特点,对子宫体MLA的病理、临床症状、诊断、治疗和预后进行文献复习,以期提高临床医师和病理医师对该病的认识,从而避免误诊和误治。
【关键词】中肾样腺癌;中肾腺癌;子宫内膜;诊断
Mesonephric-like adenocarcinoma of the uterine corpus involving cervix: a case report Yang Huan, Mou Yanlin, Li Tao. Department of Obstetrics and Gyncology, Chengdu Third People s Hospital/Affiliated Hospital of Southwest Jiaotong University, Chengdu 610014, China
Corresponding author, Li Tao, E-mail: 313866804@qq.com
【Abstract】Mesonephric-like adenocarcinoma (MLA) is a rare malignant tumor occurring in the uterine corpus and ovary. MLA of the uterine corpus shows similar histological, immunophenotypic and molecular pathological features with mesonephric adenocarcinoma (MA) of the cervix. In addition, MLA of the uterine corpus can present with a variety of growth patterns, which is likely to be misinterpreted and misdiagnosed as low-grade endometrioid adenocarcinoma, clear cell carcinoma and serous carcinoma. Hence, the diagnosis of MLA of the uterine corpus is rather challenging. Here, we reported a 58-year-old woman diagnosed with MLA of the uterine corpus. It was difficult to make the diagnosis of this extremely rare disease. Moreover, MLA was involved with the cervix, which increased the difficulty of differential diagnosis from MA of the cervix. In this article, clinical characteristics of this rare case were analyzed and literature review was conducted on the pathology, clinical symptoms, diagnosis, treatment and prognosis of MLA of the uterine corpus, aiming to increase the awareness of this disease among clinicians and pathologists, thus avoiding the misdiagnosis and ineffective treatment.
【Key words】Mesonephric-like adenocarcinoma; Mesonephric adenocarcinoma; Endometrium; Diagnosis
中肾腺癌(MA)是一种起源于胚胎残余的中肾小管和中肾管的女性生殖道恶性肿瘤,好发于宫颈及阴道外侧壁。由于目前研究还未完全证实起源于女性上生殖道(子宫体、卵巢)的MA与中肾残体之间的关系,故称为中肾样腺癌(MLA)。MLA于2016年由McFarland等[1]首次提出,于2020年被世界卫生组织纳入女性生殖系統肿瘤分类。目前,对该疾病临床行为知之甚少,大部分的研究都是病例报告,相关报告显示疾病发病年龄42~70岁,平均年龄60岁,该病难以诊断,临床进展较快,确诊时常处于晚期,远处复发风险较高,复发常见部位为肺部,预后较差[2]。由于该病极其罕见,临床特征、预后和最佳治疗方法尚不清楚。本文报道我院收治的一例累及子宫颈的子宫体MLA患者临床病例资料和诊疗经过,并复习相关文献,以提高临床医师对该病的认识。
病例资料
一、病史及体格检查
患者女,58岁。因绝经后阴道少量流液2月余于2021年5月24日收入院。2月余前,患者无明显诱因出现阴道少量流液,伴血丝,于外院予以中药(具体不详)治疗后无明显好转,遂就诊于我院。我院门诊经阴道子宫附件彩色多普勒超声(彩超)提示:子宫大小约7.5 cm×4.2 cm×4.0 cm,子宫腔下段至子宫颈处探及大小约5.3 cm×3.9 cm×3.9 cm不均质低回声团,宫内膜显示不清。门诊以“阴道流液待查:子宫内膜癌?”收入院。患者于53岁绝经,既往行剖宫产2次。
入院体格检查:体温36.5 ℃,脉搏76次/分,呼吸20次/分,血压132/80 mmHg(1 mmHg=0.133 kPa),BMI 27.4 kg/m2。心、肺、腹查体未见明显异常。妇科检查:阴道内少量血性分泌物;子宫颈光滑,子宫下段扪及一4 cm×5 cm包块,质硬,与子宫分界不清;子宫前位,约孕40+ d大小,活动度可,无压痛及反跳痛;双侧附件区未扪及明显异常。
二、入院后辅助检查
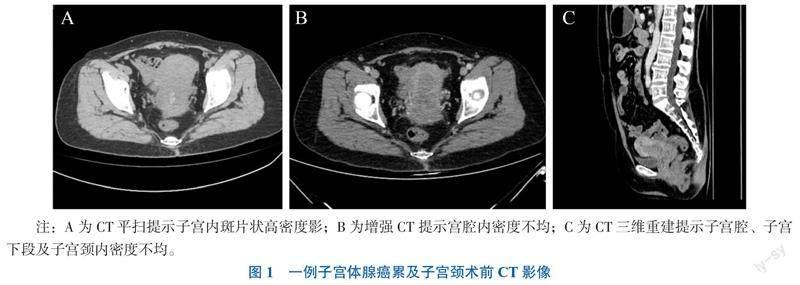
血常规:血红蛋白143 g/L,白细胞4.49×109/L,血小板163×109/L。肿瘤标志物糖类抗原125(CA125)34.36 kU/L,糖类抗原199(CA199)28.48 kU/L。凝血功能、生化检验、宫颈液基细胞学均未见明显异常。胸部CT:右肺上叶实性结节,肉芽肿可能;右肺中叶亚段不张;右肺中叶及左肺上叶舌段少许条索灶;左肺上叶及右肺中叶钙化灶。腹部及盆腔CT:子宫腔及子宫颈内密度不均,强化不均,子宫体右侧局部外凸,与局部肠道分界不清,性质不明;盆腔淋巴结多发显示,右侧盆腔淋巴结增大;盆腔少量积液(图1)。
三、诊疗经过
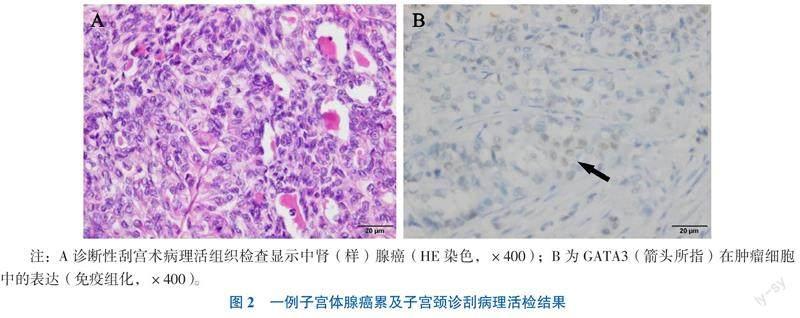
入院后行“宫腔镜诊断性刮宫术”,术中见近宫颈外口处子宫颈管黏膜光滑,子宫颈内口、子宫腔失去正常形态,子宫内膜呈棉絮状增厚,子宫下段及宫颈内口处见血凝块及广泛渗血,双侧宫角及输卵管开口遮挡。术后病理活组织检查(活检)提示(图2):“宫内组织”查见癌,结合免疫组织化学染色检查(免疫组化)结果符合中肾(样)腺癌(注:该肿瘤在子宫颈及子宫体均可见)。免疫组化结果:磷酸烯醇式丙酮酸羧激酶(PCK,+),波形蛋白(Vim,+),雌激素受体(ER,-),孕激素受体(PR,-),肾母细胞瘤基因(WT1,-),癌胚抗原(CEA,-),P16(局灶+、斑驳状),细胞角蛋白7(CK7,+),P63(-),天冬氨酸蛋白酶A(NapsinA,-),配对盒基因8(PAX8,+),CD10(+,局灶),P53(局灶+,未提示突变),小核特异组蛋白1(MLH1,+),MutS同源蛋白2(MSH2,+),错配修复基因6(MSH6,+),丹皮多糖2(PMS2,+),人类表皮生长因子受体-2(HER-2,-),增殖指数Ki-67 (20%~30%,+),GATA结合蛋白3 (GATA3,+),雄激素受体(AR,-),CR(-),甲状腺转录因子-1(TTF-1,-)。特殊染色:过碘酸希夫染色(PAS,+)。
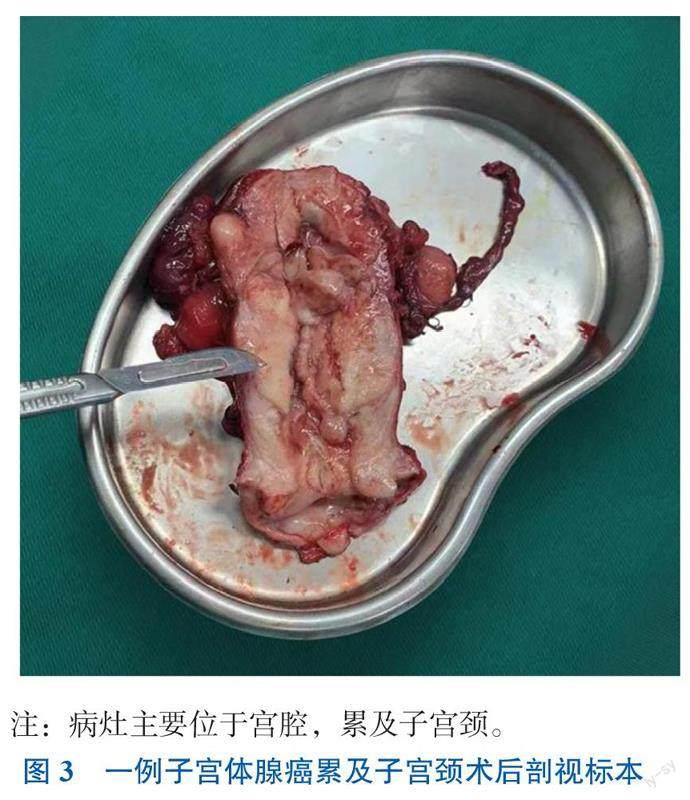
依靠辅助检查、宫腔镜术中所见及诊刮术后病理活检无法明确判断肿瘤系子宫颈中肾管腺癌累及子宫内膜或子宫体MLA累及子宫颈,故与患者及家属充分沟通病情后,行经腹根治性子宫切除术、双侧附件切除术及盆腔淋巴结切除术。术中剖视标本:子宫颈增厚,子宫体及子宫颈交界处肌壁间有一5 cm×3 cm×2.5 cm实性包块突出于子宫颈管及子宫腔下段,突出子宫腔内组织为鱼肉样赘生物;包块边界清楚,深肌层浸润(图3)。术后活检:(子宫及双附件)子宫体MLA累及子宫颈内口,肿瘤最大直径约6 cm,浸润最深处约1.4 cm(此處肌壁厚1.6 cm), > 1/2肌壁全层。脉管内查见癌栓,子宫体肌壁间及浆膜外平滑肌瘤,子宫颈内口炎性息肉。双侧附件及宫旁组织、阴道断端未见癌累及。免疫组化结果:CD34(血管内皮+),D2-40(淋巴管内皮+),P53(局灶+,未提示突变),GATA3(+),PCK(+),ER(-)。左侧盆腔淋巴结:3/13查见癌,癌灶最大径约1.5 mm。右侧盆腔淋巴结:查见淋巴结18枚,未见癌。术后诊断:子宫体MLA(ⅢC1期),子宫平滑肌瘤,子宫颈息肉。术后2周患者由于肺部感染、脓毒血症于呼吸内科住院抗感染治疗;术后40 d开始行紫杉醇+卡铂化学治疗,疗程6次,术后3个月开始局部放射治疗(子宫颈+盆腔淋巴结1.8 Gy×25 f)。目前已结束放射及化学治疗(放化疗)10个月,患者规律随访中,2022年10月于我院行胸部CT平扫、盆腹腔增强CT及肿瘤标志物检查,未见肿瘤复发。
讨论
虽然目前关于MLA的报道较少,但相关报道已对该肿瘤的解剖病理、组织病理、免疫表型和分子病理学特征有较深入的研究。子宫体MLA的大体形态学主要表现为单个的实性或实性和囊性混合肿块,通常位于子宫侧壁及后壁,目前已报道的病例均显示子宫内膜受侵,部分病例表现为息肉样改变[3]。子宫体MLA典型的组织形态特征包括:①多种形式的结构异型性:组织结构可能呈导管状、乳头状、筛状、实性、纺锤状、网状等;②管状生长模式,小管紧密排列,小管由立方细胞排列形成,偶见小导管或管腔内含有嗜酸性物质;③核特征为低级别,不大于中度的细胞异型性;④未见鳞状或黏液样分化,中肾残体或增生[1, 3-4]。
目前,尚未发现MLA特异性的免疫组化指标,但免疫组化对疾病的诊断意义巨大,相关研究推荐GATA3和TTF-1作为一线的标志物,ER和PR与CD10和钙视网膜蛋白(Calretinin)作为补充免疫过氧化物酶染色[4]。子宫体MLA多表现为GATA3、TTF-1阳性;CD10局灶性表达,染色主要局限于上皮腔表面;ER和PR表达缺失[5]。目前关于该病的分子学研究中,大多数均发现了MLA具有激活的KRAS突变,另外ARID1A和PIK3CA突变也比较常见[3,6-7]。MLA最常见的拷贝数偏差是1q的增益,其中的一部分同时合并1p的缺失[3,8-9]。
子宫体MLA常见的临床症状是阴道流液及流血,大部分表现为绝经后阴道出血,部分表现为异常子宫出血,本例患者的临床症状也是绝经后阴道少量血性液体。该病临床症状、体征不典型,疾病发病隐匿,早期诊断较为困难。确诊主要依靠病理学检查,但是由于该肿瘤的组织学上模仿其他肿瘤的各种结构模式,以及MLA是一种最近几年才提出的肿瘤,病理医师对其并不熟悉,所以仅有少数的MLA被准确诊断[2]。子宫体MLA的常见鉴别诊断包括子宫颈中肾管腺癌、子宫内膜样腺癌和浆液腺癌。子宫颈中肾管腺癌的瘤体完全或主要位于子宫颈壁或子宫肌层,常伴有中肾增生或残余。子宫体MLA主要发生在子宫内膜,虽然可能侵犯子宫肌层,但肿瘤原发于子宫内膜,随后侵犯子宫肌层,而不是主要发生在子宫肌壁间;在子宫体MLA中无法看到中肾增生或残余[10]。与子宫内膜腺癌,特别是呈管状和腺状生长模式的子宫内膜样腺癌和浆液性腺癌的区别也较困难。镜下发现鳞状、黏液状或纤毛状分化这些子宫内膜样分化的明确证据时,有助于子宫内膜样腺癌的诊断,因为这些均不是MLA的特征。此外,癌前病变(子宫内膜上皮内瘤变/不典型增生)的存在也有利于诊断子宫内膜样腺癌。浆液性癌核异型性明显,常伴有抑癌基因p53突变,而迄今为止报道的MLA中没有发现p53突变[11]。
由于子宮体MLA罕见,目前在治疗方法上尚未形成共识,主要参考子宫内膜腺癌的治疗方案。目前关于该病多为病例报告,且随访时间短,故对疾病的预后知之甚少。一项多中心的临床研究结果显示,58%的子宫体MLA患者确诊时为Ⅱ~Ⅳ期(FIGO分期)[2]。该病复发风险高,59%的患者出现了复发,复发的患者中92%的患者出现远处转移,最常见为肺部转移[2]。疾病的FIGO分期、有丝分裂活性、有无淋巴血管浸润是预测MLA转移的独立因素[3]。MLA的5年无进展生存期为27.5%,5年的总生存期为72%[2]。
本例患者的妇科检查子宫颈光滑,宫颈液基细胞学未见明显异常,宫腔镜下子宫颈内口及子宫腔均受累,CT检查也提示子宫腔及子宫颈密度不均,虽有诊断性刮宫病理学结果,但由于子宫颈MA及子宫体MLA在组织学表现上极其相似,目前也无特异性的免疫组化可区别两者,故术前难以明确肿瘤来源。由于子宫颈MA起源于子宫颈侧壁的中肾残体,而非鳞柱交界处,故难以通过宫颈癌筛查发现,即使宫颈癌筛查阴性,也不能完全排除宫颈MA[12]。若为子宫颈MA,根据术前的影像学检查,淋巴结受累不排除,按照相关指南,可选择手术分期,即腹主动脉旁淋巴结±盆腔淋巴结切除术,也可直接根据影像学分期,行同步放化疗;若手术分期淋巴结阳性,则行同步放化疗;若淋巴结阴性,由于患者病灶未累及阴道,则为I期,可行全面分期手术[13]。若系子宫体MLA,病变即使超过子宫,但也局限于盆腹腔,根据相关指南,可行子宫+双附件切除+手术分期/减瘤术[14]。根据患者临床症状、查体、影像学检查及诊断性刮宫病理学结果,确实无法明确肿瘤的来源;但影像学检查病灶主要还是位于子宫腔,所以即使子宫体MLA较子宫颈MA更加罕见,术前也更倾向于子宫体MLA的诊断。本例在与患者及家属充分知情沟通后选择行分期手术。术后切除子宫可见肿瘤的主体部位主要位于子宫腔内,子宫体MLA发生于子宫内膜,虽然可能侵犯子宫肌层,但肿瘤主要位于子宫内膜;而子宫颈MA完全或主要位于子宫颈侧壁或子宫肌层,所以最终此例诊断为子宫体MLA累及子宫颈。
综上所述,子宫体MLA是一种罕见的子宫内膜腺癌,多种生长模式融合、管腔内嗜酸性物质的分泌和有棱角的细胞核都是该肿瘤典型的组织病理学形态。免疫组化上,一种或多种中肾标志物(GATA3、TTF-1、CD10或PAX8)的表达和激素受体表达的缺失或显著减少有助于诊断。MLA的确诊主要依靠病理诊断,但于术前明确子宫体MLA的诊断非常困难,而且由于该种肿瘤具有多种形态学模式,故术后诊断也极具挑战。子宫体MLA具有很高的复发风险和肺转移的趋势。截至目前,MLA的特异性治疗方案有限,最佳治疗策略尚未确定。
参 考 文 献
[1] McFarland M, Quick C M, McCluggage W G. Hormone receptor-negative, thyroid transcription factor 1-positive uterine and ovarian adenocarcinomas: report of a series of mesonephric-like adenocarcinomas. Histopathology, 2016, 68(7): 1013-1020.
[2] Pors J, Segura S, Chiu D S, et al. Clinicopathologic characteristics of mesonephric adenocarcinomas and mesonephric-like adenocarcinomas in the gynecologic tract: a multi-institutional study. Am J Surg Pathol, 2021, 45(4): 498-506.
[3] Na K, Kim H S. Clinicopathologic and molecular characteristics of mesonephric adenocarcinoma arising from the uterine body. Am J Surg Pathol, 2019, 43(1): 12-25.
[4] Euscher E D, Bassett R, Duose D Y, et al. Mesonephric-like carcinoma of the endometrium: a subset of endometrial carcinoma with an aggressive behavior. Am J Surg Pathol, 2020, 44(4): 429-443.
[5] Deolet E, Van Dorpe J, Van de Vijver K. Mesonephric-like adenocarcinoma of the endometrium: diagnostic advances to spot this wolf in sheeps clothing. A review of the literature. J Clin Med, 2021, 10(4): 698.
[6] Mirkovic J, McFarland M, Garcia E, et al. Targeted genomic profiling reveals recurrent KRAS mutations in mesonephric-like adenocarcinomas of the female genital tract. Am J Surg Pathol, 2018, 42(2): 227-233.
[7] Kim H G, Kim H, Yeo M K, et al. Mesonephric-like adenocarcinoma of the uterine corpus: comprehensive analyses of clinicopathological, molecular, and prognostic characteristics with retrospective review of 237 endometrial carcinoma cases. Cancer Genomics Proteomics, 2022, 19(4): 526-539.
[8] Kolin D L, Costigan D C, Dong F, et al. A combined morphologic and molecular approach to retrospectively identify KRAS-mutated mesonephric-like adenocarcinomas of the endometrium. Am J Surg Pathol, 2019, 43(3): 389-398.
[9] Mirkovic J, Sholl L M, Garcia E, et al. Targeted genomic profiling reveals recurrent KRAS mutations and gain of chromosome 1q in mesonephric carcinomas of the female genital tract. Mod Pathol, 2015, 28(11): 1504-1514.
[10] Howitt B E, Nucci M R. Mesonephric proliferations of the female genital tract. Pathology, 2018, 50(2): 141-150.
[11] Bogani G, Ray-Coquard I, Concin N, et al. Uterine serous carcinoma. Gynecol Oncol, 2021, 162(1): 226-234.
[12] Anagnostopoulos A, Ruthven S, Kingston R. Mesonephric adenocarcinoma of the uterine cervix and literature review. BMJ Case Rep, 2012, 2012: bcr0120125632.
[13] 周暉, 刘昀昀, 罗铭, 等. 《2022 NCCN子宫颈癌临床实践指南(第1版)》解读. 中国实用妇科与产科杂志, 2021, 37(12): 1220-1226.
[14] 谢玲玲, 林荣春, 林仲秋. 《2022 NCCN子宫肿瘤临床实践指南(第1版)》解读. 中国实用妇科与产科杂志, 2021, 37(12): 1227-1233.
(收稿日期:2022-11-22)
(本文编辑:林燕薇)

