长链非编码RNA 在主动脉夹层发病机制中作用的研究进展
李思平 ,刘丽平,周荣
主动脉夹层(aortic dissection,AD)是内膜撕裂引起的具有破坏性的主动脉病变,其是在多种致病因素作用下因血流影响导致的内膜剥离[1]。AD发病迅速、死亡率高,如得不到不及时治疗,约24%的患者会在发病后24 h内死亡,50%的患者会在发病后48 h内死亡[2]。《中国心血管健康与疾病报告2021》指出,近年来我国AD发病率有上升趋势,发病年龄也趋于年轻化[3]。因此,早期准确诊断AD并给予相应治疗对降低患者死亡率及改善患者预后非常重要。然而,AD的发病机制目前尚未完全阐明,且缺乏有效的防治药物。因此,在分子水平上寻找AD的可能生物标志物或治疗靶点非常必要。
非编码RNA(non-coding RNA,ncRNA)是基因表达的关键调节因子,其可通过与DNA、RNA和蛋白质相互作用而调节目标基因的表达[4]。长链非编码RNA(long non-coding RNA,LncRNA)是一类相对较新的ncRNA,其通过调节特定靶基因的表达或蛋白质活性而参与AD的发生、发展[5]。因此,AD患者中异常表达的LncRNA可能成为其生物标志物和治疗靶点。本研究旨在综述AD的发病机制、AD患者差异表达LncRNA及LncRNA在AD发病机制中的作用,以期为寻找AD的可能标志物及治疗靶点提供新思路。
1 AD的发病机制
目前研究认为,导致AD发生发展的因素可大致分为遗传学因素和细胞学因素,其中遗传学因素主要为基因突变,基因突变可影响结缔组织的生长,导致主动脉壁结构薄弱或被破坏,如马方综合征为FBN1突变[6]、Ehlers-Danlos综合征为COL3A1突变[7]、Loeys-Dietz综合征为TGFBR1或TGFBR2突变等[8]导致的,而罹患上述遗传性疾病的患者易发生AD。细胞学因素为AD的主要病理机制(包括主动脉内侧囊性坏死和退行性改变)[9],而这些改变与血管炎症、细胞外基质(extracellular matrix,ECM)降解、血管平滑肌细胞(vascular smooth muscle cells,VSMCs)凋亡和表型转化有关[10]。
2 LncRNA概述
LncRNA的长度超过200个核苷酸,尽管其不能编码蛋白质,但可以广泛参与调控基因转录、表观遗传修饰、蛋白质和RNA稳定性及翻译和翻译后修饰等[11]。在RNA聚合酶Ⅱ的转录作用下,DNA的编码区域通过5'端甲基化帽和3'端多聚腺苷酸尾被剪接形成完全成熟的线性LncRNA[12]。目前,LncRNA根据与邻近蛋白质编码基因的位置关系大致分为以下五类[13]:(1)位于蛋白质编码基因反义链上;(2)位于蛋白质编码基因的内含子区域;(3)位于两个编码蛋白质的基因之间(也称为链间ncRNA);(4)位于蛋白质编码基因的增强子区域;(5)位于同源祖基因序列附近的假基因上。LncRNA可在生物体各发育阶段、不同细胞或疾病中动态表达,且在基因表达和翻译过程中起着重要的调节作用。
LncRNA的调节作用与其细胞内定位密切相关,如定位在细胞核的LncRNA可以调节染色质重塑、诱导组蛋白修饰并调节下游基因表达[14],其作为增强子RNA可调节转录,通过干扰前mRNA加工而调节mRNA的剪接[15];定位在细胞质的LncRNA可以调节特定的转录因子并抑制其功能[16],此外还可以作为海绵竞争性地吸附部分miRNA,进而调节miRNA的稳定性并阻止其与目标基因结合[17]。此外,也有研究发现,LncRNA可与特定蛋白质结合,进而影响蛋白质的翻译和翻译后修饰[18]。近年随着临床对LncRNA生物学功能研究的深入,LncRNA可能有助于AD等疾病的早期诊断和治疗。
3 AD患者差异表达LncRNA
近年随着人类基因组计划的启动和高通量测序等科学技术的进步,LncRNA已成为AD的研究热点。LI等[19]利用微阵列技术分析了AD患者(n=6)和年龄匹配的无主动脉疾病的器官捐献者(n=6)主动脉组织LncRNA表达谱的差异表达情况,结果显示,AD患者存在765种差异表达LncRNA,其中上调LncRNA 289种、下调LncRNA 476种。SUN等[20]采用高通量测序技术分析了AD患者的LncRNA表达谱,结果显示,与正常主动脉组织相比,AD患者主动脉组织中共有269个差异表达LncRNA,其中上调LncRNA 159个、下调LncRNA 110个。
4 LncRNA在AD发病机制中的作用
近年随着研究深入,一些异常表达的LncRNA被证实参与了AD的发生发展过程,如WANG等[21]研究发现,LncRNA OIP5-AS1可以通过海绵吸附miR-143-3p,进而上调miR-143-3p靶基因的表达,从而加重了主动脉内膜、中层和外膜损伤;REN等[22]研究发现,LncRNA H19可通过海绵吸附miR-193b-3p而调节VSMCs的增殖、迁移和表型转化,进而参与AD的发生。目前研究表明,VSMCs的凋亡和表型转化、ECM的成分变化及血管炎症与AD的发病机制有关[23]。LncRNA在AD发病机制中的作用[20,24-38]见表1。
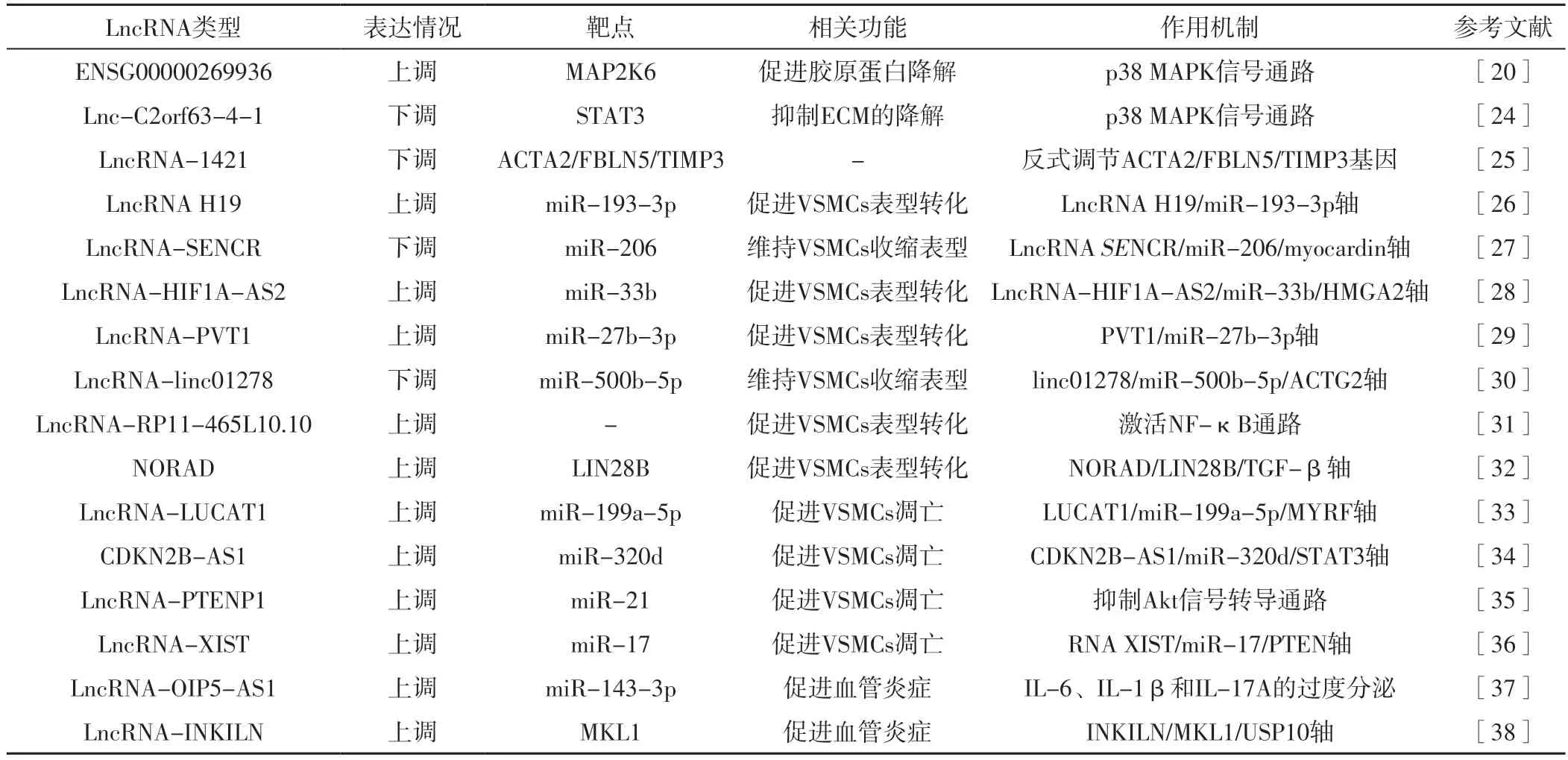
表1 LncRNA在AD发病机制中的作用Table 1 Role of LncRNA in the pathogenesis of AD
4.1 LncRNA调控ECM的合成和降解 ECM是由胶原蛋白、蛋白聚糖/糖胺聚糖、弹性蛋白、纤连蛋白、层粘连蛋白等组成的一种高度动态的结构网络,其能够调节多种细胞功能,如维持细胞形态及活性、促进细胞增殖及凋亡、调控细胞分化及迁移,对维持机体正常生长发育至关重要[39]。基质金属蛋白酶(matrix metalloproteinases,MMP)是一组依赖Zn2+、Ca2+的胶原蛋白酶和弹性蛋白酶,基质金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinases,TIMP)是目前MMP最具特异性的内源性抑制剂[40]。生理条件下,MMP和TIMP的协调作用使主动脉中ECM的合成与分解处于动态平衡;但在炎症、动脉粥样硬化、高血压等情况下,MMP与TIMP间的动态平衡遭到破坏,使结合蛋白(胶原蛋白和弹性蛋白)降解增加、合成减少,进而造成血管壁弹性降低,推动AD发展[41]。研究证实,LncRNA可以通过调控ECM的合成和降解而参与AD的发生发展。
4.1.1 ENSG00000269936 有研究者通过微小RNA(microRNAs,miRNA)和LncRNA建立的竞争性内源性RNA(competing endogenous RNA,ceRNA)网络探索AD的发病机制,结果发现,在AD组织中表达上调的ENSG00000269936可顺式调节其邻近蛋白质编码基因丝裂原活化蛋白激酶激酶6(mitogen-activated protein kinase kinase 6,MAP2K6),进而促进ECM降解[20]。MAP2K6是p38 MAPK信号通路的成员,研究表明,p38 MAPK信号通路是血管紧张素Ⅱ介导的MMP-2上调、拉伸刺激诱导MMP-2高表达的关键机制[20]。
4.1.2 Lnc-C2orf63-4-1 Lnc-C2orf63-4-1也参与了AD的发生。研究发现,在正常主动脉组织中,Lnc-C2orf63-4-1通过负调控STAT3基因表达而降低血管紧张素Ⅱ水平,进而减少p38 MAPK信号通路诱导的MMP-2分泌,从而阻止AD的发生;当Lnc-C2orf63-4-1功能发生障碍时,会加剧血管紧张素Ⅱ诱导的ECM降解,进而促进AD的发生[24]。ACTA2可编码主动脉平滑肌肌动蛋白,而ACTA2突变与AD形成有关[42]。FBLN5基因可编码ECM蛋白,FBLN5基因缺陷通过抑制成熟弹性纤维的组装而使小鼠表现出严重的血管重塑[43]。此外,TIMP3基因可编码TIMP3,导致ECM降解[44]。
4.1.3 LncRNA-1421 SUN等[20]研究发现,LncRNA-1421与FBLN5、TIMP3、ACTA2表达水平呈负相关,推测LncRNA-1421可能通过反向调节FBLN5、TIMP3、ACTA2基因表达而在AD中发挥作用。
上述研究均表明,LncRNA在ECM的合成及降解中发挥了调控作用,进而参与AD的发生。
4.2 LncRNA调控VSMCs表型转化 动脉中的VSMCs通常处于静止状态,无增殖和迁移能力,具有收缩表型并维持特定蛋白质稳定合成的能力,如α-平滑肌激动蛋白(alpha smooth muscle actin,α-SMA)和平滑肌22α(smooth muscle 22 alpha,SM22α),其中SM22α是VSMCs的标志物[45]。α-SMA可诱导VSMCs的运动和收缩[46];SM22α可促进VSMCs收缩和迁移,其活化有助于VSMCs表型平衡。在炎症、高血压和动脉粥样硬化的刺激下,VSMCs的增殖和迁移能力增强,同时产生更丰富的ECM,其被称为合成VSMCs[47]。VSMCs从“收缩表型”变为“合成表型”后,可引起血管收缩功能异常,抗顺应性、张力等降低。近年研究证实,LncRNA通过VSMCs表型转化、增殖、迁移等参与AD的发生[48]。
4.2.1 LncRNA H19 LncRNA H19是一种在正常胸主动脉组织中低表达的LncRNA,miR-193-3p是LncRNA H19的重要下游效应因子。miR-193-3p可以与特定靶点和相关信号通路相互作用而抑制正常细胞增殖和调节细胞周期[26]。研究表明,LncRNA H19在AD中表达上调,其通过海绵吸附miR-193b-3p而下调分化标志物α-SMA和SM22α的表达。有动物实验表明,沉默LncRNA H19的AD小鼠胸主动脉损伤明显减轻,表明LncRNA H19是VSMCs表型转化的重要调节因子和治疗AD的分子靶点[23]。
4.2.2 LncRNA-SENCR 心肌素是一种促VSMCs分化因子,其过表达可明显激活α-SMA和SM22α等SMC分化基因的表达。SONG等[27]研究发现,与健康主动脉组织相比,AD组织中LncRNA-SENCR表达水平明显降低;且生物信息学分析结果显示,LncRNA-SENCR通过海绵吸附miR-206而阻止miR-206抑制心肌素过表达。
2.2.3 LncRNA-HIF1A-AS2 LncRNA-HIF1A-AS2是HIF-1α的反义转录本,研究表明,其可以通过促进VSMCs增殖和抑制VSMCs凋亡而参与动脉粥样硬化的发展[49]。ZHANG等[28]研究发现,与正常组织相比,AD组织中LncRNA-HIF1A-AS2表达上调,同时VSMCs的收缩表型标志物明显降低;而沉默LncRNA-HIF1A-AS2则出现相反结果,表明LncRNA-HIF1AAS2可能在AD表型转化中起到关键调控作用。LncRNAHIF1A-AS2作为ceRNA可通过调控HMGA2基因表达而促进VSMCs表型转化,其可能成为AD治疗的潜在靶点。
4.2.4 LncRNA-PVT1 LncRNA-PVT1被认为在心血管疾病中可以改变内皮细胞增殖和迁移情况。LI等[29]研究发现,LncRNA-PVT1在AD中可以促使VSMCs的表型转化,其发现miR-27b-3p是PVT1的结合位点,AD组织中上调的LncRNAPVT1通过靶向miR-27b-3p而降低α-SMA和SM22α表达,进而促进VSMCs表型转化。
4.2.5 LncRNA-linc01278 既往研究发现,LncRNAlinc01278与许多癌症的生理和病理过程有关,如XI等[50]指出,LncRNA-linc01278通过miR-134-5p/KDM2A轴加速结直肠癌的进展;WANG等[30]研究发现,LncRNA-linc01278在AD发病中发挥着重要作用,其通过富集分析等高级生物信息学分析证实LncRNA-linc01278/miR-500b-5p/ACTG2轴是与AD最相关的靶基因轴。在AD组织中,LncRNA-linc01278、ACTG2及VSMCs表型转化分子标志物α-SMA和SM22α表达下调,miR-5b-22p表达上调,该研究揭示了LncRNA-linc01278调控VSMCs表型转化的可能机制为其通过海绵吸附miR-500b-5p而调控ACTG2,进而控制VSMCs表型转化的“开关”[30]。
4.2.6 LncRNA-RP11-465L10.10 定位于人类20号染色体的LncRNA-RP11-465L10.10是一种天然反义LncRNA,其转录自MMP9基因外显子的下游。有证据表明,NF-κB通路激活可促进VSMCs表型转化[51]。LIN等[31]研究发现,LncRNARP11-465L10.10在AD组织中呈高表达,其通过NF-κB信号通路促进VSMCs表型转化,并加剧VSMCs的增殖和迁移;而NF-κB信号通路阻滞剂可使LncRNA-RP11-465L10.10诱导的VSMCs表型转化明显受损,表明LncRNA-RP11-465L10.10可能对AD具有潜在的治疗价值。
4.2.7 NORAD NORAD是一种在DNA受损后被激活的LncRNA。目前研究表明,NORAD主要参与DNA损伤修复和维持基因组稳定性,且在多种肿瘤中表现出促癌作用[52]。有研究发现,NORAD在AD组织中的表达明显升高,而敲除NORAD则可抑制VSMCs的表型转化;该研究进一步发现,NORAD通过募集LIN28B而与转化生长因子β(transforming growth factor β,TGF-β)mRNA结合,从而促进TGF-β1的表达,进而调节VSMCs中的有氧糖酵解,促进VSMCs表型转化,调控AD的发生[32]。因此,NORAD可能作为VSMCs表型转化和AD治疗的靶点。
4.3 LncRNA促进VSMCs凋亡 研究表明,VSMCs不仅产生ECM,还参与MMP和TIMP的释放和成熟[53]。因此,VSMCs可维持主动脉壁细胞外纤维结构的完整性,其凋亡可导致ECM退化,从而削弱血管壁弹性,并加速AD的形成[46]。
4.3.1 LncRNA-LUCAT1 既往研究证实,低表达的LncRNALUCAT1具有促进VSMCs增殖和抑制VSMCs凋亡的作用,而髓磷脂调节因子升高可以消除该作用[53]。XIA等[33]研究发现,与健康对照者相比,AD患者主动脉组织中LncRNALUCAT1表达上调,而上调的LncRNA-LUCAT1可通过靶向miR-199a-5p上调miR-199a-5p的下游靶标髓磷脂调节因子的表达,从而促进VSMCs的凋亡。
4.3.2 CDKN2B-AS1 ZHAO等[34]研究发现,AD组织中CDKN2B-AS1表达水平明显高于正常主动脉组织;随后进行的动物实验证实,CDKN2B-AS1过表达可有效促进VSMCs凋亡并抑制VSMCs增殖,而沉默CDKN2B-AS1的效果相反;作者还通过AD中CDKN2B-AS1的ceRNA网络探索其机制,结果发现,CDKN2B-AS1为miR-320d的分子海绵,其通过抑制miR-320d而正向调节STAT3基因表达,从而促进VSMCs凋亡。
4.3.3 LncRNA-PTENP1 LncRNA-PTENP1是十号染色体上磷酸酯酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)的假基因,PTENP1和PTEN具有内生的竞争关系[35]。有动物实验表明,PTENP1可以作为miR-21的分子海绵与miR-21结合,进而促进PTEN表达,抑制下游Akt信号转导,抑制细胞周期蛋白D1和细胞周期蛋白E的表达,促进VSMCs凋亡并抑制VSMCs增殖,进而促进AD的形成[54]。
4.3.4 LncRNA-XIST LncRNA-XIST也表现出与LncRNAPTENP1类似的调控作用。LncRNA-XIST作为染色体Xq13.2的转录产物,位于X染色体的非活性中心区域,可影响X染色体相关基因的激活。ZHANG等[36]研究证实,AD患者主动脉壁组织中LncRNA-XIST表达明显升高,且与AD患者预后有关;随后动物实验证实,LncRNA-XIST通过抑制miR-17及其下游PTEN基因而调控AD进展,而敲除LncRNA-XIST基因的AD大鼠的病情明显缓解,这为AD提供了一种新的治疗方法。
综上,明确LncRNA与VSMCs凋亡的关系,为寻找可行的AD诊断及治疗靶点提供了理论依据。
4.4 LncRNA促进血管炎症 VSMCs凋亡和ECM破坏常伴随炎症反应增强[55]。研究表明,AD患者主动脉壁中有大量炎性细胞浸润,如巨噬细胞、T淋巴细胞等,其能引起过度炎症反应,从而刺激MMP的产生,促进VSMCs的凋亡及ECM的降解[56]。而上述过程会促使炎性细胞进一步被招募和浸润,导致炎症反应呈级联放大,进而参与AD的发展。
4.4.1 LncRNA H19 LncRNA H19不仅可以促进VSMCs表型转化,还具有促进血管炎症的作用,表达上调的LncRNA H19能通过解除let-7a对VSMCs和巨噬细胞中IL-6转录的抑制作用,促进血管促炎因子IL-6、单核细胞趋化蛋白1和巨噬细胞的浸润,进而促进AD形成[37]。
4.4.2 LncRNA-OIP5-AS1 DING等[13]研究发现,LncRNAOIP5-AS1可作为ceRNA与miR-143-3p结合,从而促进人主动脉外膜成纤维细胞中IL-6、IL-1β和IL-17A的过度分泌,进而加剧AD的损伤。
4.4.3 其他 既往研究报道,RUNX1可以调节MMP9表达,进而增强AD的炎症反应[57]。SUN等[20]构建了一个ceRNA网络,通过GO功能富集分析发现,LncRNA(ENSG00000248508、ENSG00000226530和EG00000259719)可能与炎症反应的生物途径相关,其上游靶标RUNX1可能参与炎症的调控,加速AD的发生。因此,上述3个新的LncRNA可能是潜在的AD标志物和治疗靶点。MKL1蛋白是血管炎症的主要转录激活剂,而去泛素化酶USP10可抑制MKL1泛素化和蛋白酶体降解。ZHANG等[38]研究发现了一种新的促炎LncRNA,并阐明了一种以前未知的通过调控MKL1蛋白稳定性以增强其促炎作用的途径;该研究发现,炎症会诱导LncRNA-INKILN表达,其通过去泛素化酶USP10抑制MKL1泛素蛋白酶体降解,增强MKL1等的核易位,进而促进促炎基因转录,最终诱导AD等血管疾病的发生。该研究为血管疾病的治疗策略提供了新的见解。
5 小结与展望
LncRNA最初被认为是基因转录的副产物,不具有生物学功能,但随着研究深入,发现其可以通过表观遗传、转录和转录后修饰而调节基因表达。LncRNA通过调控ECM的合成和降解、VSMCs表型转化及促进VSMCs凋亡、血管炎症而参与AD的发生发展。但目前通过建立LncRNA相关实验来解决AD的临床问题仍面对诸多挑战:第一,AD是内外因素共同作用的结果,主动脉病变是内因,血液相关因素是外因。目前对LncRNA的研究主要以主动脉病变为基础,通过与健康主动脉相比筛选出差异表达LncRNA,尚未有研究探索血液中LncRNA与AD之间的关系。第二,目前关于LncRNA在AD中的调节作用主要集中在LncRNA对VSMCs的影响,缺乏对主动脉其他细胞成分,如内皮细胞、成纤维细胞和巨噬细胞的研究。第三,部分LncRNA只完成了细胞实验,还没有建立动物模型进行验证,研究结论值得商榷。第四,miRNA是连接LncRNA和调节基因的重要桥梁,其可通过基因调控调节AD的发生和发展,然而LncRNA研究并未涉及血浆和组织中与miRNA共表达的相同分子。鉴于以上问题,LncRNA作为AD生物标志物的研究仍然缺乏,目前也暂未发现针对该疾病的有效药物治疗靶点。
综上所述,LncRNA与AD的发生发展密切相关,尽管目前对LncRNA的了解有限,但随着研究的深入,其能够加深人们对AD中细胞功能复杂调控网络的理解,可能为开发基于LncRNA的AD生物标志物和AD新型治疗措施提供思路。
作者贡献:李思平进行文章的构思与设计、可行性分析,文献/资料收集、整理,撰写论文;刘丽平、周荣负责文章的质量控制及审校;周荣对文章整体负责、监督管理。
本文无利益冲突。

