IL-37 与慢性阻塞性肺疾病急性加重患者免疫功能及预后的关系研究
黄清平,林芳崇,王日兴,符超
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)好发于老年人群,以持续气流受限为主要特征,气流受限不完全可逆且呈进行性发展[1-2]。全球疾病负担研究报道,截至2022年,COPD分别位列全球致死原因第3位和经济负担第5位,COPD发生机制复杂,普遍认为气道慢性炎症损伤在COPD的发生发展中具有关键作用[3]。慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)指COPD患者短期内出现呼吸困难加重、咳嗽咳痰加剧、胸闷气促以及发热等表现,其是在各种刺激因素作用下,炎症细胞在气道壁与肺泡大量聚集,释放多种炎症因子并造成炎症病理损伤,其病情进展较快,可导致肺功能持续恶化、COPD相关并发症发生率升高、死亡率升高,且患者预后较差[4-5]。IL-37是一种新型的具有抑制炎症作用的细胞因子。研究发现,IL-37可以抑制固有免疫和获得性免疫应答,在多种炎症性疾病中发挥抗炎和免疫抑制等作用,可参与多种疾病的发生发展过程[6];相较于COPD稳定期患者,AECOPD患者血清IL-37表达水平明显升高,且IL-37表达水平与AECOPD患者发生免疫失衡和全身炎症反应综合征存在一定联系[7]。本研究旨在探讨IL-37与AECOPD患者免疫功能及预后的关系,以期为临床工作提供相关依据。
1 对象与方法
1.1 研究对象 选取2020年10月至2022年6月于海南医学院第二附属医院住院的AECOPD患者204例。纳入标准:(1)年龄40~70岁;(2)符合《慢性阻塞性肺疾病诊治指南》[8]中AECOPD的诊断标准,并具有典型临床症状。排除标准:(1)合并支气管哮喘、支气管扩张、肺结核、肺纤维化及哮喘-慢阻肺重叠综合征者;(2)有恶性肿瘤者;(3)有严重心脑血管疾病史者;(4)合并HIV感染或免疫系统疾病者。所有患者入院后给予常规化痰、抗感染、液体复苏、抗凝、扩张支气管及器官功能支持等综合治疗,并给予无创正压通气治疗,同时雾化吸入布地奈德混悬液。按出院时预后情况将患者分为好转组(n=163)和恶化组(n=41)。预后好转判定标准[8]:(1)生命体征平稳;(2)呼吸困难症状消失;(3)血常规、C反应蛋白、降钙素原等炎症指标恢复正常;(4)动脉血气分析指标恢复正常。本研究经海南医学院第二附属医院伦理委员会批准(伦理编号:202010130235),所有患者以及家属签署知情同意书。
1.2 观察指标 (1)临床资料。收集患者入院时的临床资料,包括年龄、性别、BMI、动脉血氧分压(arteria oxygen partial pressure,PaO2)、动脉血二氧化碳分压(arterial partial carbon dioxide pressure,PaCO2)、第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、FEV1/用力肺活量(forced vital capacity,FVC)。(2)IL-37与免疫功能指标。抽取患者入院第1天和第7天清晨空腹外周血5 ml,置于EDTA抗凝管中,立即以3 000 r/min离心25 min(离心半径8 cm),收集血浆于-80 ℃冰箱冻存待测,采用双抗体夹心ABCELISA检测IL-37,试剂由美国Biosouce公司进口分装,严格按照试剂盒说明书进行操作。另抽取患者入院第1天和第7天清晨空腹外周静脉血2 ml,注入真空采血管(肝素钠抗凝,去热原和内毒素),轻摇混匀,应用美国BD公司CD4+/CD8+T三色单克隆抗体、Becton-Dickinson FACS Calibur型流式细胞仪全自动分析软件测定T淋巴细胞亚群(分别测定CD4+T淋巴细胞百分比、CD8+T淋巴细胞百分比、CD4+/CD8+T淋巴细胞比值),采用罗氏Cobasc501生化分析仪测定IgA、IgM及IgG。
1.3 统计学方法 采用SPSS 25.0统计学软件进行数据处理。符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验,组内比较采用配对t检验;计数资料以相对数表示,组间比较采用χ2检验;采用多因素Logistic回归分析探讨AECOPD患者预后的影响因素;绘制ROC曲线以评估入院第1天IL-37对AECOPD患者预后恶化的预测价值;采用Pearson相关分析探讨AECOPD患者入院第1天IL-37与免疫功能指标的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 两组年龄、性别、BMI、PaO2、PaCO2比较,差异无统计学意义(P>0.05);好转组FEV1大于恶化组,FEV1/FVC高于恶化组,差异有统计学意义(P<0.05),见表1。

表1 两组临床资料比较Table 1 Comparison of clinical data between the two groups
2.2 IL-37和免疫功能指标 两组入院第1天和入院第7天CD4+T淋巴细胞百分比、IgA、IgM、IgG比较,差异无统计学意义(P>0.05);恶化组入院第7天IL-37、CD8+T淋巴细胞百分比分别高于本组入院第1天,CD4+/CD8+T淋巴细胞比值低于本组入院第1天,差异有统计学意义(P<0.05);好转组入院第7天IL-37、CD8+T淋巴细胞百分比分别低于本组入院第1天,CD4+/CD8+T淋巴细胞比值高于本组入院第1天,差异有统计学意义(P<0.05);恶化组入院第1天和入院第7天IL-37、CD8+T淋巴细胞百分比高于好转组,CD4+/CD8+T淋巴细胞比值低于好转组,差异有统计学意义(P<0.05),见表2。
表2 两组入院第1天和第7天IL-37和免疫功能指标比较(±s)Table 2 Comparison of IL-37 and immune function indicators between the two groups on the 1st and 7th days of admission
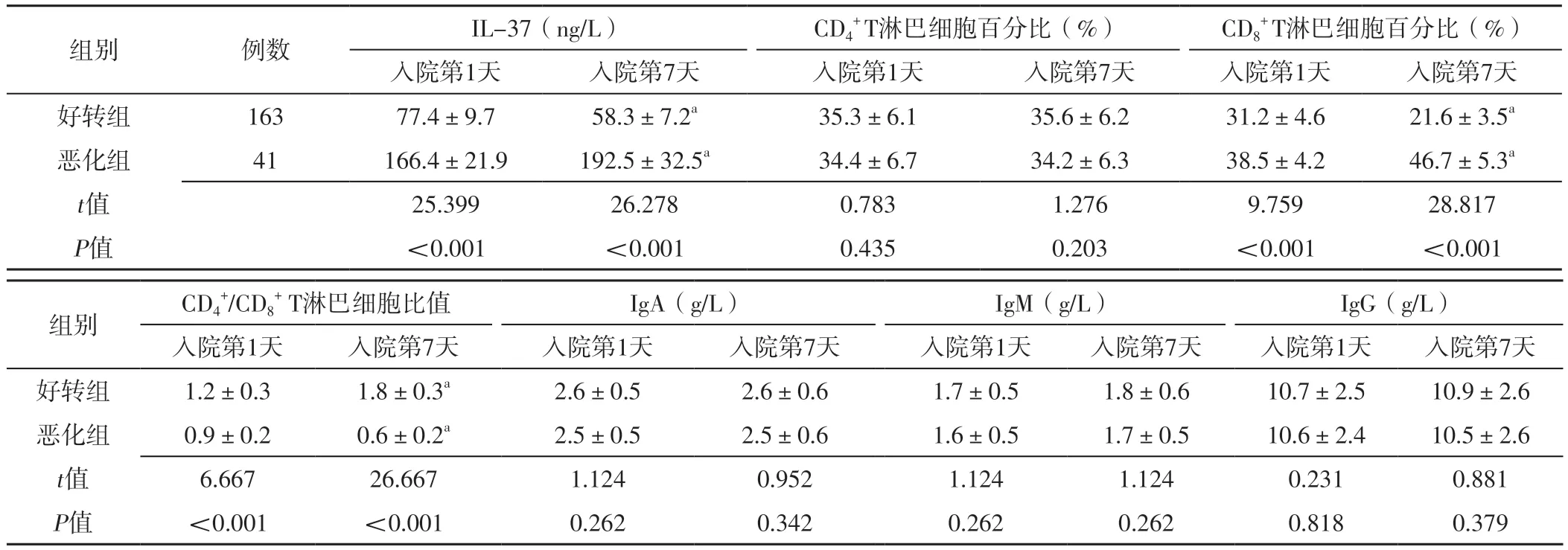
表2 两组入院第1天和第7天IL-37和免疫功能指标比较(±s)Table 2 Comparison of IL-37 and immune function indicators between the two groups on the 1st and 7th days of admission
注:a表示与本组入院第1天比较,P<0.05
组别例数IL-37(ng/L)CD4+ T淋巴细胞百分比(%)CD8+ T淋巴细胞百分比(%)入院第1天入院第7天入院第1天入院第7天入院第1天入院第7天好转组16377.4±9.758.3±7.2a35.3±6.135.6±6.231.2±4.621.6±3.5a恶化组41166.4±21.9192.5±32.5a34.4±6.734.2±6.338.5±4.246.7±5.3a t值25.39926.2780.7831.2769.75928.817 P值<0.001<0.0010.4350.203<0.001<0.001组别CD4+/CD8+ T淋巴细胞比值IgA(g/L)IgM(g/L)IgG(g/L)入院第1天入院第7天入院第1天入院第7天入院第1天入院第7天入院第1天入院第7天好转组1.2±0.31.8±0.3a2.6±0.52.6±0.61.7±0.51.8±0.610.7±2.510.9±2.6恶化组0.9±0.20.6±0.2a2.5±0.52.5±0.61.6±0.51.7±0.510.6±2.410.5±2.6 t值6.66726.6671.1240.9521.1241.1240.2310.881 P值<0.001<0.0010.2620.3420.2620.2620.8180.379
2.3 AECOPD患者IL-37与免疫功能指标的相关性分析Pearson相关分析结果显示,AECOPD患者入院第1天IL-37与入院第1天CD4+T淋巴细胞百分比、IgA、IgM、IgG无直线相关关系(P>0.05),与入院第1天CD8+T淋巴细胞百分比呈正相关(r=0.782,P<0.001),与CD4+/CD8+T淋巴细胞比值呈负相关(r=-0.693,P=0.012)。
2.4 AECOPD患者预后影响因素的多因素Logistic回归分析以FEV1(实测值)、FEV1/FVC(实测值)、入院第1天IL-37(实测值)、入院第1天CD8+T淋巴细胞百分比(实测值)、入院第1天CD4+/CD8+T淋巴细胞比值(实测值)为自变量(因第7天指标与第1天指标存在多重共线性,故排除),以AECOPD患者预后(赋值:恶化=1,好转=0)为因变量,进行多因素Logistic回归分析,结果显示,入院第1天IL-37、CD8+T淋巴细胞百分比、CD4+/CD8+T淋巴细胞比值是AECOPD患者预后恶化的独立影响因素(P<0.05),见表3。
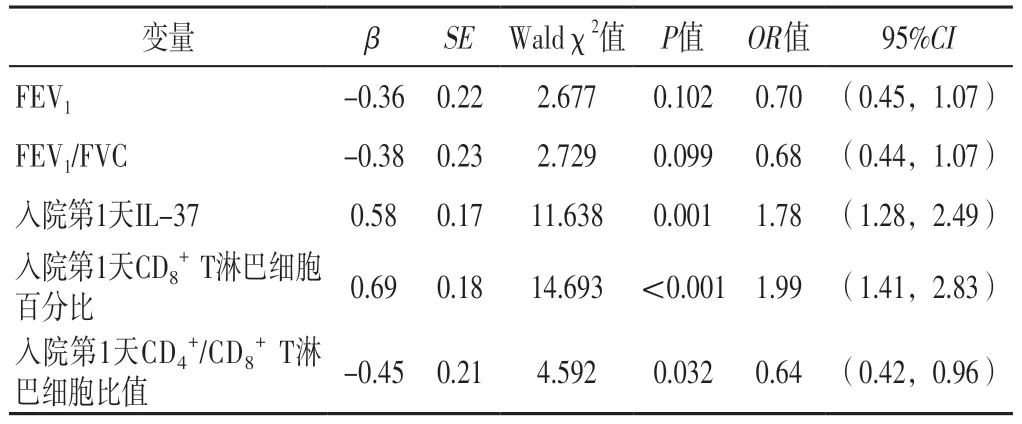
表3 AECOPD患者预后影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic analysis of influencing factors of prognosis in AECOPD patients
2.5 IL-37对AECOPD患者预后恶化的预测价值 ROC曲线分析结果显示,入院第1天IL-37预测AECOPD患者预后恶化的AUC为0.813〔95%CI(0.745,0.881)〕,最佳截断值为121.5 ng/L,灵敏度为84.3%,特异度为78.6%,见图1。
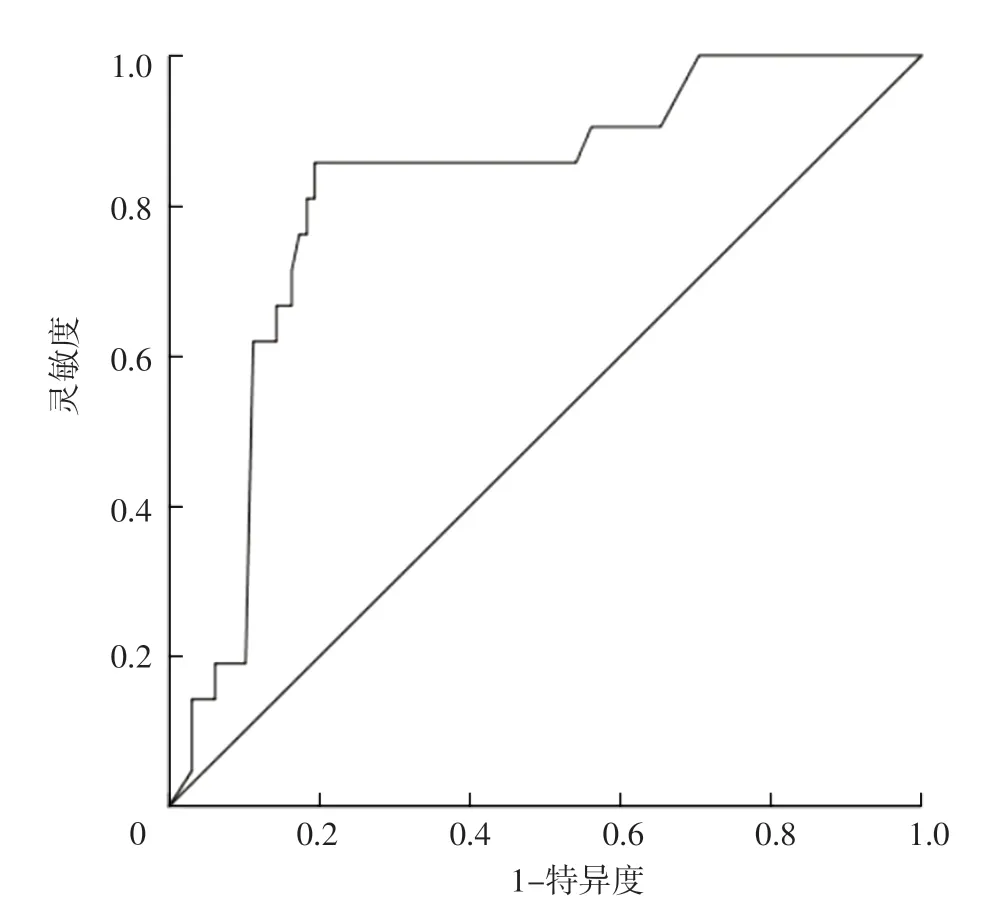
图1 入院第1天IL-37预测AECOPD患者预后恶化的ROC曲线Figure 1 ROC curve of the IL-37 on the 1st day of admission in predicting prognosis deterioration in patients with AECOPD
3 讨论
COPD作为呼吸系统的一种常见病、多发病,可严重影响患者生活质量和生命健康,增加患者的家庭负担及社会负担。相关文献报道,COPD的患病率和死亡率呈逐年上升趋势,AECOPD是COPD死亡率增加的主要原因,也是患者住院治疗费用居高不下的主要原因,AECOPD平均每年发生1~3次,造成患者的肺功能持续降低,致使病情恶化[1-3]。因此,对AECOPD做到早期预防、早期诊断、科学规范治疗具有非常重要的临床意义。
目前,AECOPD的发生机制尚未完全明确,有研究表明,细菌感染引起的特异性免疫反应及炎症细胞浸润加重了气道炎症损伤,降低了机体的免疫功能,导致肺功能进行性恶化且不可逆转,其炎性渗出、肺泡壁破坏、黏液阻塞等导致了肺泡通气/血流比例失调,从而诱发呼吸衰竭,而大量炎症细胞浸润以及气道炎症损伤加重在AECOPD病情进展中起着非常关键的作用[4]。WANG等[5]也报道了AECOPD患者存在异常的气道炎症反应,炎症细胞被激活后将释放IL-8、白三烯B4、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等多种炎症因子,这些炎症因子直接引起气道壁和肺腺泡的炎症病理损伤,进而导致AECOPD病情加重。
IL-37作为新型的炎症抑制因子,可以下调固有免疫和获得性免疫应答,在多种自身免疫性疾病中具有保护作用[9]。相关研究结果显示,IL-37在肿瘤、自身免疫性疾病以及感染性疾病中具有明显免疫抑制和抗炎效应;IL-37可通过调节基因转录,有效结合IL-18结合蛋白,降低IL-18的活性,减少干扰素γ的产生;还可抑制IL-1β、IL-6、IL-8、TNF-α等炎症因子的分泌和释放,且其水平可能随IL-1β、IL-6、IL-8、TNF-α等促炎细胞因子水平的升高而升高[10-12]。ETEHAD ASNAF等[13]研究发现,IL-37在免疫反应过程具有重要的调节作用,其可抑制炎症因子释放及树突细胞的活化,并减少转录活化因子家族成员的表达,从而调控其下游相关炎症因子的表达。上述研究结果均表明,IL-37参与了疾病的炎症反应过程,并与患者免疫失衡存在一定联系。本研究结果显示,恶化组入院第7天IL-37高于本组入院第1天,好转组入院第7天IL-37低于本组入院第1天,且恶化组入院第1天及入院第7天IL-37均高于好转组。提示IL-37作为炎症抑制因子可能参与了AECOPD的发病过程。AECOPD发病时肺部大量炎症细胞浸润,释放大量炎症因子,引起肺部炎症病理损伤,从而反馈性地引起炎症抑制因子IL-37的升高。经临床治疗后好转组患者感染和炎症得到控制,IL-37也随之下降。而恶化组入院时的IL-37水平较高,病情较重,经临床治疗后感染和炎症未得到有效控制,反而更加严重,IL-37也随之上升。上述现象与IL-37的抑炎作用正好相反,笔者认为这是因为恶化组异常升高的IL-37并不足以完全抑制机体的炎症反应,反而是机体对炎症反应的反馈性调节,而炎症因子分泌越多,炎症损伤越重,IL-37升高越明显,同时预示着AECOPD治疗效果和预后越差。提示IL-37水平与AECOPD患者病情严重程度、炎症损伤程度可能呈正相关。
COPD的本质是肺部慢性炎症性疾病,免疫功能紊乱是患者易反复发生感染进而导致AECOPD的直接原因[14-15]。外周血中的T淋巴细胞主要分为CD4+T淋巴细胞和CD8+T淋巴细胞2个亚群,二者是参与细胞免疫反应的主要细胞,健康人群中二者在数量上处于动态平衡和相互协调状态,以保持机体免疫功能稳定。研究表明,COPD患者大小气道、肺腺泡内均存在以CD8+T淋巴细胞浸润为主的炎症反应,表现为CD8+T淋巴细胞升高,CD4+T淋巴细胞下降或不变,CD4+/CD8+T淋巴细胞比值下降[16],而这种炎症反应在AECOPD患者中更加明显[17]。MARK等[18]报道,COPD严重程度与T淋巴细胞和炎症细胞浸润程度密切相关。而本研究结果显示,恶化组入院第7天CD8+T淋巴细胞百分比高于本组入院第1天,CD4+/CD8+T淋巴细胞比值低于本组入院第1天;好转组入院第7天CD8+T淋巴细胞百分比低于本组入院第1天,CD4+/CD8+T淋巴细胞比值高于本组入院第1天;且恶化组入院第1天和入院第7天CD8+T淋巴细胞百分比高于好转组,CD4+/CD8+T淋巴细胞比值低于好转组。多因素Logistic回归分析结果显示,入院第1天CD8+T淋巴细胞百分比、CD4+/CD8+T淋巴细胞比值是AECOPD患者预后恶化的独立影响因素。分析原因可能为,CD8+T淋巴细胞百分比升高,CD4+/CD8+T淋巴细胞比值降低可导致AECOPD患者免疫调节能力失衡,可促进多种炎症细胞激活,并释放大量炎症因子,造成AECOPD患者肺部更为严重的免疫病理损伤,从而导致疾病恶化。而本研究相关性分析结果显示,AECOPD患者入院第1天IL-37与CD8+T淋巴细胞百分比呈正相关,与CD4+/CD8+T淋巴细胞比值呈负相关,分析原因可能为,AECOPD患者IL-37表达水平与免疫功能密切相关,CD8+T淋巴细胞百分比升高、CD4+/CD8+T淋巴细胞比值下降可引起机体免疫功能紊乱和调节能力失衡,诱导炎症细胞活化并释放大量炎症因子,进而反馈性地引起抗炎因子IL-37表达水平升高。
此外,本研究多因素Logistic回归分析结果显示,入院第1天IL-37为AECOPD患者预后恶化的独立影响因素;且ROC曲线分析结果显示,入院第1天IL-37预测AECOPD患者预后恶化的AUC为0.813〔95%CI(0.745,0.881)〕,最佳截断值为121.5 ng/L,提示入院第1天IL-37≥121.5 ng/L的AECOPD患者预后恶化风险较高。DI STEFANO等[19]研究也发现,在炎症性疾病中IL-37与疾病发展呈正相关,慢性肝炎患者IL-37表达增加会加重肝脏损伤,而给予患者减轻肝脏损伤相关治疗后其外周血IL-37亦明显降低。本研究结论与上述研究结果相似,但IL-37在AECOPD发病过程中的具体作用机制仍有待进一步探究。
综上所述,AECOPD患者入院第1天IL-37与免疫功能相关,其是AECOPD患者预后恶化的影响因素,且对AECOPD患者预后恶化有一定预测价值。但本研究为小样本量、单中心研究,未来需要大样本量、多中心研究进一步验证本研究结论。
作者贡献:黄清平进行文章的构思与设计,研究的实施与可行性分析,撰写/修订论文;林芳崇、王日兴进行资料收集、整理;符超进行统计学处理;黄清平、符超负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。

