甘肃地区汉族ACS 患者ApoE及SLCO1B1 基因多态性分布研究
王博雯 谢 萍 李燕玲 闫恒瑜 高奋堂
(甘肃省人民医院,甘肃 兰州 730000)
近年来,急性冠脉综合征(Acute Coronary Syndrome,ACS)发病率呈显著上升趋势,患病人数不断攀升,有着高死亡率和高致残率的特点,已成为我国不可忽视的重大公共健康卫生问题[1]。最新ACS 诊治指南推荐应尽早启动大剂量他汀类药物强化调脂治疗,可显著降低ACS 患者再发心血管事件的风险[2]。但相关文献指出,应用高强度的他汀类药物治疗会增加不良反应的发生,如肝功能异常表现为转氨酶升高,他汀类相关肌肉不良反应,包括肌痛、肌炎、横纹肌溶解等症状[3]。相关临床研究结果显示,对于他汀药物耐受性及反应性不同人群的临床表现存在差异,推测可能与参与药物代谢的酶、受体等基因多态性有着密切关联[4]。SLCO1B1 和ApoE基因作为影响他汀药物药代动力学以及药效动力学的主要影响因素[5],在对他汀降脂药物使用安全性及有效性进行评估时发挥重要作用。此次研究工作的开展初步对甘肃地区汉族ACS 患者ApoE 及SLCO1B1 基因多态性分布特点进行研究讨论,同时探讨其与血脂水平的相关性,以期初步了解该类患者临床应用他汀类药物的安全性,现报道如下。
1 资料与方法
1.1 一般资料
纳入2016 年11 月至2017 年12 月期间在我院心内科入住的243 例ACS 患者作为研究对象,男女比例为179:64,年龄35-81 岁。纳入对象均为甘肃地区汉族人群,均无血缘关系和异族通婚史,并签署知情同意书。本研究通过甘肃省人民医院伦理委员会审批(批件编号:2019-076)。ACS 诊断标准依据《急性冠脉综合征急诊快速诊治指南(2016)》,根据出院诊断分为不稳定型心绞痛、急性ST 段抬高型心肌梗死、急性非ST 段抬高型心肌梗死。纳入标准:(1)均明确诊断为ACS 患者;(2)入院24 h 内完成ApoE 及SLCO1B1 基因多态性检测;(3)入院前2周内未服用他汀类降脂药物。排除标准:(1)肝、肺、肾等其他重要器官严重功能不全者;(2)严重感染、恶性肿瘤以及合并其他自身免疫性疾病患者;(3)其他对血脂代谢有影响的疾病,如甲状腺疾病、结核病等疾病史。
1.2 方 法
1.2.1 基因型检测 选择天根生化(北京,中国)基因组提取盒(TIANamp Blood DNA Kit,DP318)在外周静脉血(4 mL)中提出基因组DNA,DNA 的A260/A280 在1.8-2.0,将其放置在-20℃的环境下保存。将空白对照、弱阳性对照、待检测的DNA 分别加入3 种PCR 反应液管中作扩增处理。SLCO1B1 基因依据服用他汀类药物后发生横纹肌溶解的风险及服用药物的剂量,可分为三种表型,分别为耐受较高型(*1b/*1b,*1a/*1b,*1a/*1a)、耐受中等型(*1a/*15,*1b/*15,*1a/*5)及耐受较低型(*5/*5,*15/*15,*5/*15)[6]。ApoE 基因依据发生冠心病、脑梗死、黄斑变性、老年痴呆等的风险以及服用他汀类药物降脂疗效将其分为三种表型,分别为一般型(E2/E4、E3/E3)、有益型(E2/E2、E2/E3)和有害型(E3/E4、E4/E4)[7]。
1.2.2 血脂水平检测 入院24 h 内完成血脂水平检测。所有243 例研究对象采集血标本前1 d 禁止饮酒或进食油腻食物,且禁食12 h 以上。次日清晨取静脉血2 mL,经3 000 r/min 离心10 min 后,应用自动生化分析仪处理离心静脉血液,并对高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、总胆固醇(TC)及三酰甘油(TG)水平进行检测。
1.2.3 肌痛发生情况收集 利用病案、HIS 系统收集患者服药期间肌痛的发生情况,包括肌肉钝痛、酸痛,四肢及远端压痛,运动时或之后即刻痛性痉挛等不良反应。其中他汀类相关肌病(SAM)诊断标准为:(1)肌痛:肌组织疼痛或者无力,但CK 水平无明显升高。(2)肌炎:肌组织有疼痛症状,CK 水平轻中度升高但小于正常值上限5 倍。(3)横纹肌溶解:肌组织有明显疼痛症状,CK 水平超过正常上限5 倍及以上、褐色尿及肌红蛋白尿合并急性肾功能衰竭。
1.3 观察指标
收集患者一般资料,包括性别、年龄;实验室血脂指标包括HDL-C、LDL-C、TC 及TG,以及ApoE基因型与SLCO1B1 基因型检测结果,并关注患者肌痛发生情况。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析,计量资料采用均数±标准差表示。计数资料采用n(%)表示,两组间比较用χ2检验分析,计量资料采用秩和检验。采用偏回归性分析受试者的ApoE 及SLCO1B1 基因多态性与血脂水平的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 基因型分布
本研究243 例ACS 患者血液样本分别检测到6种ApoE 基因型与6 种SLCO1B1 基因型。SLCO1B1等位基因*1b、*1a、*15 占比分别为55.52% 、32.13%、12.35%,ApoE 等位基因E2、E3、E4 占比分别为6.7%、80.45%及12.85%。详见表1、表2。
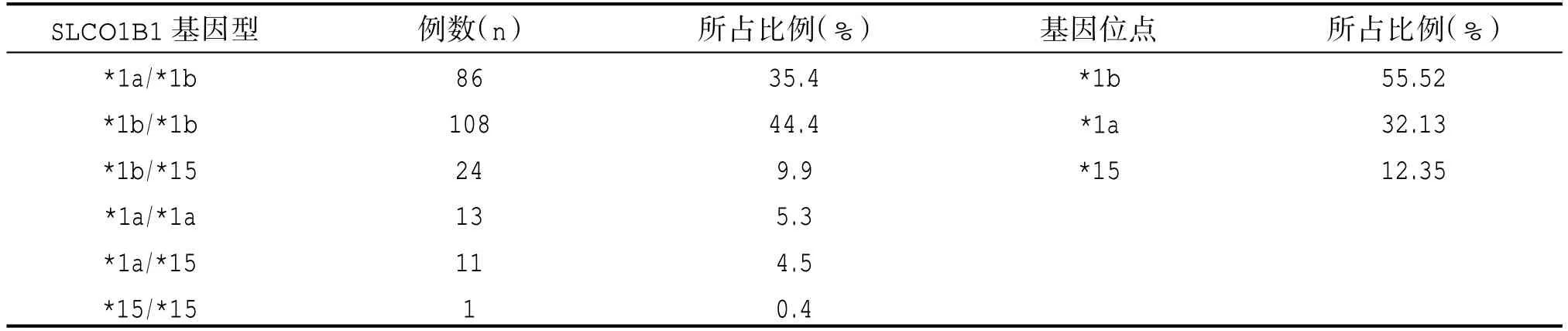
表1 甘肃地区汉族243 例ACS 患者SLCO1B1 基因分布情况
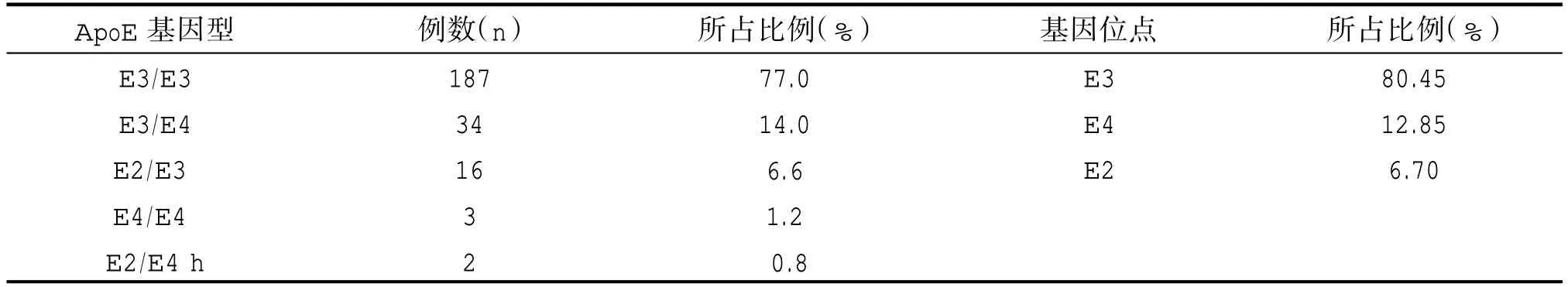
表2 甘肃地区汉族243 例ACS 患者ApoE 基因分布情况
2.2 SLCO1B1 三种基因表型组间一般资料及血脂水平比较
本研究中243 例ACS 患者SLCO1B1 三种基因表型占比为:耐受较高型*1b/*1b、*1a/*1b、*1a/*1a分别占比44.4%、35.4%、5.3%,耐受中等型*1a/*15、*1b/*15、*1a/*5 分别占比4.5%、9.9%、0.49%,耐受较低型只检测出占比0.4%的*15/*15 基因型,未检出*5/*5、*5/*15 型。其中耐受较低型患者肝脏摄取药物能力较弱,发生横纹肌溶解的风险较其他分型患者高,临床上需要关注该类患者,适当减少他汀类药物使用剂量。SLOCO1B1 三组基因表型在血脂水平、性别及年龄分布上差异无统计学意义(P>0.05),见表3。

表3 SLCO1B1 基因表型间一般资料及血脂水平比较
2.3 ApoE 三种基因表型组间一般资料及血脂水平比较
本研究中243 例ACS 患者ApoE 基因表型占比为:一般型E2/E4、E3/E3 占比分别为0.8%、77.00%,有害型[E3/E4(14.0%)、E4/E4(1.2%)],有益型[E2/E2(0.4%)、E2/E3(6.6%)]。同样,ApoE 基因表型与血脂水平均无明显相关性(P>0.05),见表4。
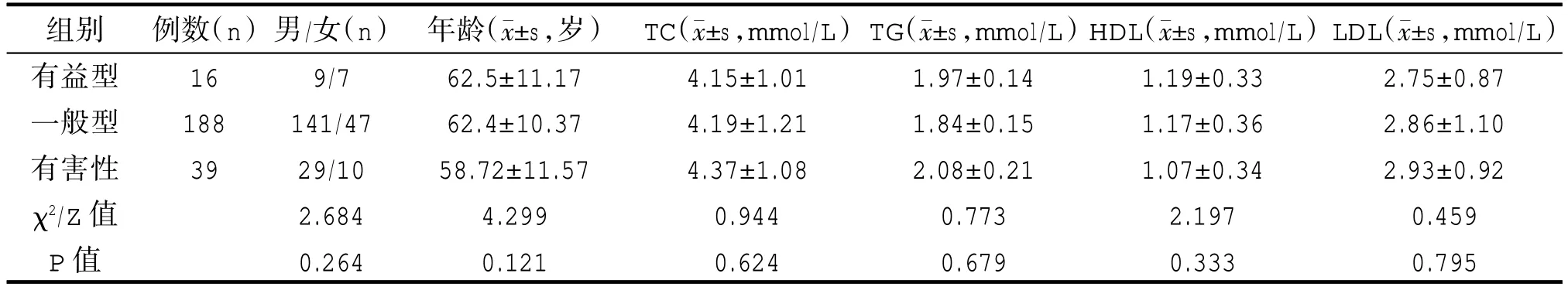
表4 ApoE 三种基因表型间一般资料及血脂水平比较
2.4 ACS 患者SLCO1B1 和ApoE 基因多态性与血脂水平的相关性
偏相关性分析显示:SLCO1B1 基因多态性与各血脂指标水平均无明显相关性(P>0.05),同样,ApoE 基因多态性与各血脂指标水平均无明显相关性(P>0.05),见表5。
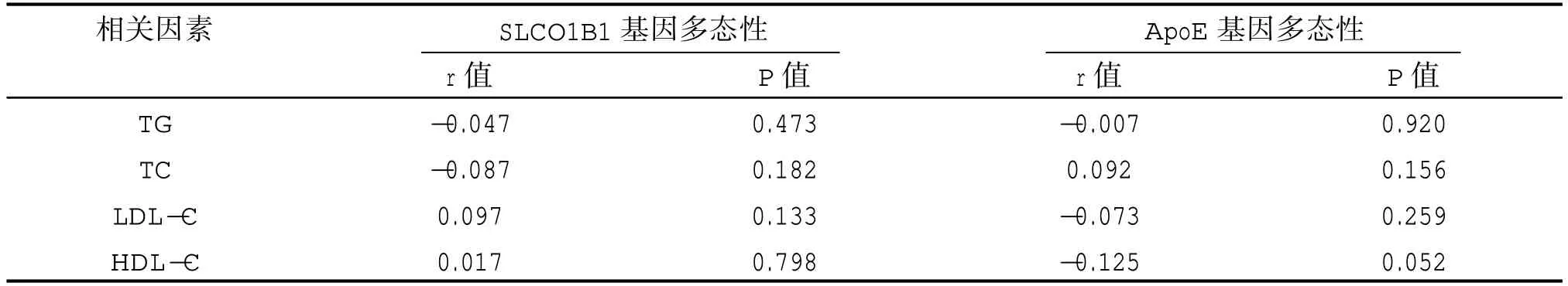
表5 243 例ACS 患者SLCO1B1 和ApoE 基因多态性与血脂水平的相关性(偏相关性分析)
3 讨 论
ACS 是因冠状动脉内不稳定粥样斑块糜烂或破裂导致的急性血栓引发的心脏急性缺血综合症,有关研究结果表明,ACS 是受到遗传环境等诸多因素共同作用而发病的多基因遗传性疾病[8],急性期除抗凝、抗血小板聚集及尽快开通血运重建外,相关危险因素的管理至关重要,尤其需要重视血脂管理[9]。他汀类药物可竞争性抑制3-羟基3-甲基二酰辅酶A 还原酶的活性,是目前公认的安全有效的降脂药物,但部分患者出现肌痛、肝酶升高及中枢神经功能损伤等相关不良反应症状。既往亦有文献报道,长期服用他汀类降脂药物易诱发轻度认知功能障碍,严重者甚至可出现痴呆症状,且中途停用会显著增加再发心血管疾病事件[10]。随着分子生物科技的不断进展,SLCO1B1 和ApoE 基因多态性与冠心病的关系已被多项研究报道[11],但基因多态性分布存在地域差别,因此,首次从分子水平了解SLCO1B1 和ApoE 基因遗传多态性在甘肃地区ACS 患者的分布情况,探讨其与血脂水平的相关性,为他汀类药物的临床应用提供理论依据。
SLCO1B1 基因编码有机阴离子转运多肽(OATP1B1)参与多种药物的转运,并决定药物是否直接发挥药效或代谢转化为有活性的物质[12]。SLCO1B1 基因具有遗传多态性,其中521T>C、388A>G 是两种最常见的单核苷酸多态性,可以形成 4 种单倍型 SLCO1B1*1a (388 A -521T)、SLCO1B1*5(388A-521C)、SLCO1B1*1b(388G-521T)和SLCO1B1*15(388G-521C)。SLCO1B1 基因突变能够减弱编码OATP1B1 转运蛋白活力,降低肝脏摄取药物能力,易导致他汀类药物血药水平上升,明显增加不良反应的发生危险[13-14]。本研究统计分析结果表明,耐受较高型*1b/*1b、*1a/*1b、*1a/*1a 分别占比44.4%、35.4%、5.3%,耐受中等型*1a/*15、*1b/*15、*1a/*5 分别占比4.5%、9.9%、0.49%,耐受较低型只检测出占比0.4%的*15/*15 基因型,未检出*5/*5、*5/*15 型。以上结果表明甘肃地区大多数ACS 患者为SLCO1B1 基因耐受较高型,临床使用他汀类药物风险正常,高风险基因型极少,但对于基因检测发现具有SLCO1B1 高度风险基因型的患者,应高度关注肌病、横纹肌溶解风险,可考虑使用低剂量的他汀类药物。
载脂蛋白E(ApoE)是影响机体血脂代谢的重要内在因素,所编码的载脂蛋白通过多种途径参与机体的脂质代谢,被认为是高脂血症和冠心病的候选易感基因。ApoE 基因同样呈多态性,常见有6 种基因型,不同基因表型的血脂水平不同[15-16]。本研究243 例ACS 患者血液样本中同样检测到6 种ApoE基因型。检测到一般型(E2/E4、E3/E3)占比77.8%,有害型(E3/E4、E4/E4)占比15.2%,有益型(E2/E2、E2/E3)占比7.0%。有研究表明,ApoE 基因有害型占比27.59%,该类患者发生冠心病、阿尔兹海默症和血管性痴呆的风险最高,与本研究有害基因型占比结果相似,因此对该部分患者进行健康生活指导及早期药物干预具有重要临床意义[17]。既往有研究显示,E2 等位基因会降低LDL 水平,E4 等位基因则能够升高LDL[18]。此次研究结果显示:ApoE基因多态性与血脂水平无明确相关性(P>0.05)。这些不同研究结果提示,ApoE 基因多态性与血脂水平之间的相关性仍然不完全明确,推测可能与不同的ApoE 等位基因介导脂蛋白降解的速率不同相关,有待更大样本量和更为严谨的临床设计进一步研究证实。
综上所述,本研究初步了解甘肃地区汉族ACS患者的SLCO1B1 和ApoE 基因型及等位基因频率分布特点,且进一步表明ACS 患者SLCO1B1 和ApoE 基因多态性与血脂水平无相关性。本研究的样本量较少,仍需更大样本量临床数据进一步研究。ApoE 和SLCO1B1 基因测定是精准医疗的缩影之一,通过基因多态性检测,关注SLCO1B1 和ApoE风险类基因患者,以期能为临床他汀类药物应用的有效性与安全性提供重要参考。

