四川牦牛ACOT12基因多态性及其与肉品质性状的相关分析
阮梦茹,王浩铸,谢 涛,陆惠娴,于海滨,姜 平*,赵志辉,2*
(1.广东海洋大学 滨海农业学院,广东 湛江 524000;2.粤西地区畜禽资源与种质创新重点实验室,广东 湛江 524000)
牦牛属于大型反刍动物,体格高大、被毛厚密,心肺功能发达,抗逆性强,是唯一起源于青藏高原且在高海拔地区繁衍至今的珍稀牛种[1]。具有高海拔地区适应能力强、耐粗饲、抗寒耐劳等优良特性。与普通黄牛肉相比,牦牛肉的蛋白质含量高达22.52%,脂肪含量约为3.15%,且矿物质元素含量丰富,氨基酸结构比例与人更相近,有着较高的营养价值与经济价值[2]。截至2019年全世界牦牛总数量约为1 700万头,其中中国牦牛存栏数为1 600多万头,占比90%以上[3],主要分布于青海、四川、西藏等地区。牦牛肉的高经济价值,改善了人们的生活环境与膳食结构,因此推动牦牛产业的发展,对加强经济建设有着重要意义。随着科学技术的进步,人们对分子遗传育种的知识更加完善,有关分子标记的研究日益增多,单核苷酸多态性(single nucleotide polymorphism,SNP)是分子标记最常用的方法之一,SNP是基因组水平上单个核苷酸变异所导致的DNA碱基序列的多态性[4],可用于快速基因型分型,是研究遗传育种相关的分子标记常用的技术之一。
酰基辅酶A硫脂酶(acyl-CoA thioeaterase,ACOT)是一类水解酶,可催化酯酰辅酶A水解成自由脂肪酸和辅酶A,广泛存在于哺乳动物组织中[5]。目前已知的ACOT家族成员有15个[6],根据酶的相对分子质量大致被分为Ⅰ型和Ⅱ型,两种类型的ACOT无结构相似性和序列同源性,因此被称为类似物而非同系物。Ⅰ型和Ⅱ型ACOT均含有保守的催化三联体氨基酸序列,该序列在催化反应和调节酶活性中发挥重要作用。酰基辅酶A硫脂酶12(acyl-CoA thioeaterase 12,ACOT12)是ACOT家族Ⅱ型酶成员之一,主要在肝、肾和小肠中表达[7]。ACOT12基因相关的研究主要集中在小鼠、大鼠和人上。有研究表明,在大鼠中,饥饿和过氧化物酶体增殖等代谢刺激可诱导ACOT12的表达,再次喂食和施加胰岛素可降低ACOT12的表达[8]。ACOT12基因与牦牛相关的研究未见报道,本课题组在前期进行的转录组学分析中发现,ACOT12是影响牛肉质代谢的差异表达基因。因此本试验采用DNA测序技术研究四川牦牛ACOT12基因的多态性,并应用SPSS 23.0软件分析SNPs位点及其单倍型与肉品质性状的相关性,以期为优质肉牛的早期选育提供理论依据,为构建高品质肉质性状的核心牛群奠定基础。
1 材料与方法
1.1 试验样品所选用的102头四川牦牛,在相同的饲养条件下饲养于四川阿坝州某牛场,收集每头牛相同部位的颈静脉血液经抗凝剂处理后,于-80℃ 保存。
1.2 主要试剂血液基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;Green Taq PCR Mix、TAE Buffer购自南京诺唯赞生物科技股份有限公司;DL2000 DNA Marker购自北京宝日医生物技术有限公司;琼脂糖购自北京鼎国生物技术有限公司;DNA Loading Buffer、核酸染色剂购自Meilunbio公司。
1.3 主要仪器PCR扩增仪购自Bio-Rad公司;电子天平购自梅特勒-托利多国际贸易(上海)有限公司;电泳仪购自北京六一生物科技有限公司;凝胶成像分析仪购自广州誉维生物科技仪器有限公司;微量分光光度计购自Thermo公司。
1.4 DNA提取按说明书使用血液基因组DNA提取试剂盒提取四川牦牛血液样本DNA,使用微量分光光度计检测DNA的质量浓度和纯度,通过琼脂糖凝胶电泳检测DNA的质量。
1.5 引物设计根据Ensembl中公布的牛ACO-T12基因序列(ENSBTAT00000014753.6),利用Primer Premier 5.0软件设计1对引物,引物序列为F:5′-ATGGGAGGAGTGATTGC-3′和R:5′-CCTGACTTCTGCCTTACTGA-3′,由生工生物工程(上海)股份有限公司合成。
1.6 PCR扩增及产物测序以四川牦牛血液DNA为模板进行PCR扩增。PCR扩增体系(总体积为20 μL):Taq PCR Mix 10 μL,上、下游引物各 0.5 μL,DNA模板2 μL,ddH2O 7 μL。PCR扩增程序:95℃预变性5 min;95℃变性30 s,52.6℃退火30 s,72℃延伸1 min,共35个循环;72℃再延伸5 min。PCR扩增产物经1.5%琼脂糖凝胶电泳检测并确认目的条带正确后,送生工生物工程(上海)股份有限公司测序。
1.7 数据的统计分析采用SeqMan软件观察重叠峰;使用Popgene 32软件计算等位基因的基因频率、基因型频率、遗传杂合度(H)、有效等位基因数(Ne);使用PIC 0.6软件计算多态信息含量(PIC);使用Haploview 4.2软件进行连锁不平衡分析;使用SPSS 23.0软件的单因素方差中的多重比较对四川牦牛肉品质性状和基因型间的关系进行差异显著性检验,以P<0.05作为差异显著性的判断标准。试验数据用“平均值±标准误”表示。
2 结果
2.1 PCR扩增PCR扩增结果如图1。扩增产物大小为845 bp,电泳条带明亮、清晰,无引物二聚体、抹带和非特异性扩增条带,可用于后续的测序试验。
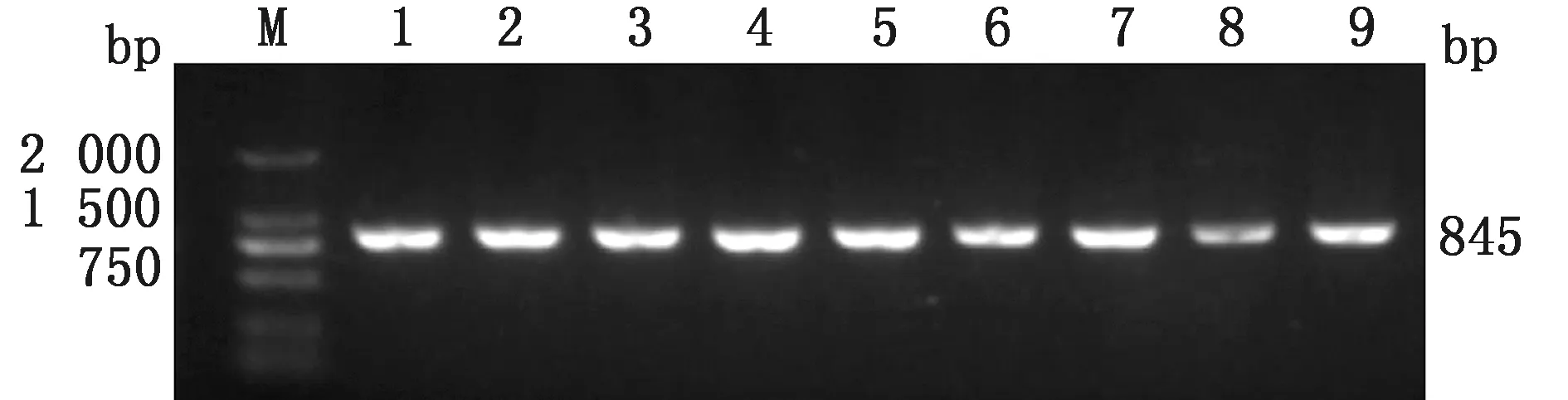
M.DL2000 DNA Marker;1~9.ACOT12基因PCR扩增产物
2.2 PCR扩增产物测序对测序结果进行分析发现,在ACOT12基因的5′UTR和外显子1上共发现3个SNPs位点,分别为E1-285 T>C、E1-603 T>A、E1-675 C>G,不同基因型的测序图谱如图2~4所示。
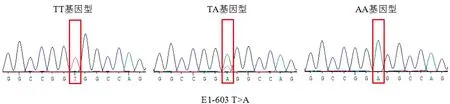
图2 ACOT12基因E1-285 T>C位点3种基因型的测序图谱
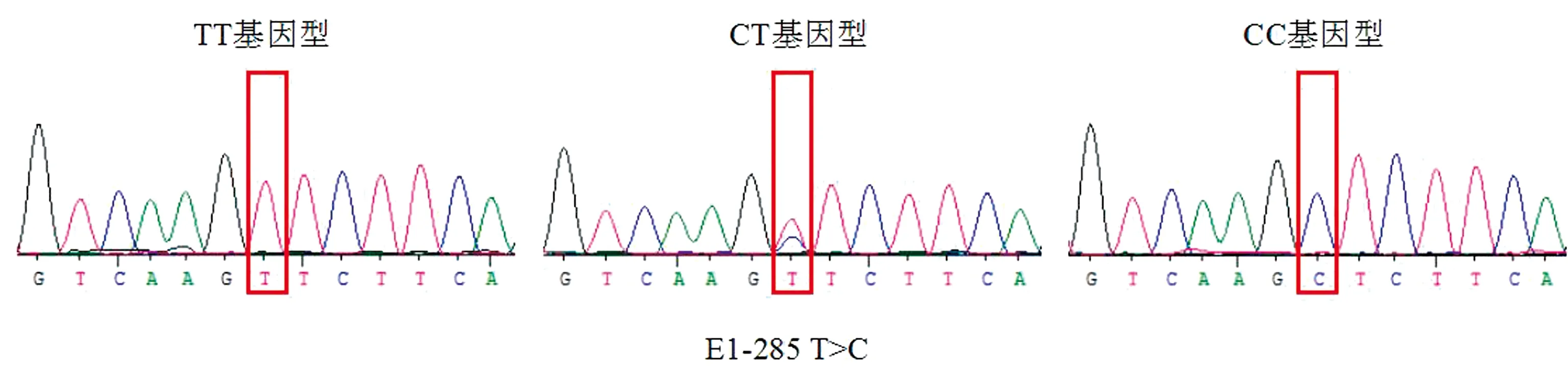
图3 ACOT12基因E1-603 T>A位点3种基因型的测序图谱
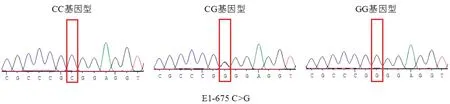
图4 ACOT12基因E1-675 C>G位点3种基因型的测序图谱
2.3 ACOT12基因的3个SNPs位点的群体遗传特性ACOT12基因的3个SNPs位点的群体遗传特性见表1。由表1可以看出,E1-285 T>C、E1-603 T>A、E1-675 C>G中优势基因型分别为TC、TA、CC,优势等位基因分别为T、A、C,频率均大于0.5;E1-285 T>C、E1-603 T>A位点的遗传杂合度(H)和多态信息含量(PIC)均处于0.25~0.50之间,表明以上位点呈现为中度多态。χ2检验说明,3个SNPs位点在四川牦牛群体中均处于Hardy-Weinberg平衡状态(P>0.05)。
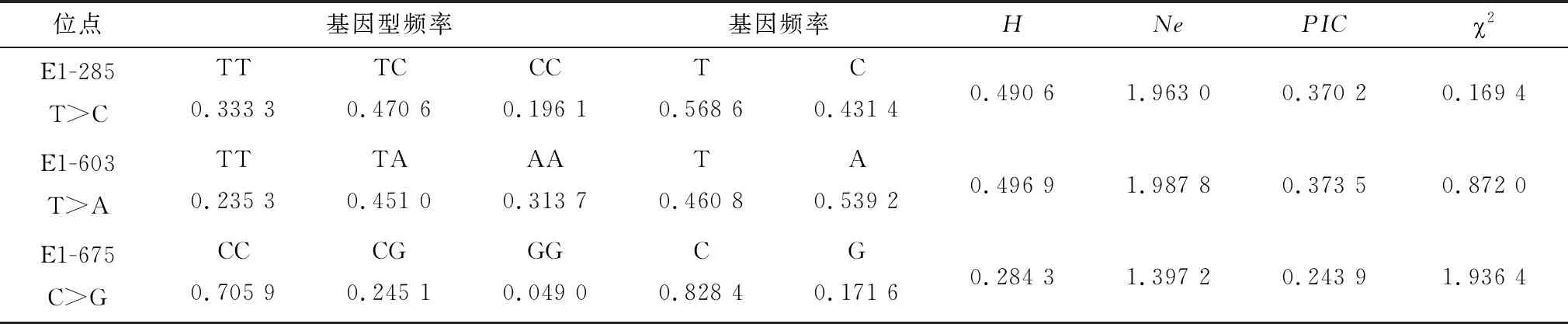
表1 ACOT12基因的3个SNPs的群体遗传特性分析结果
2.4 ACOT12基因的SNPs与四川牦牛肉品质性状的相关分析ACOT12基因的3个SNPs与四川牦牛肉品质性状的相关分析见表2。由表2可以看出,E1-603 T>A位点的TT基因型个体的pH45 min值显著低于TA、AA基因型个体(P<0.05);E1-675 C>G位点的CG基因型个体的背膘厚显著高于CC基因型个体(P<0.05),3个SNPs位点的不同基因型与pH24 h、肉色(L*,a*,b*)均无显著相关性(P>0.05)。
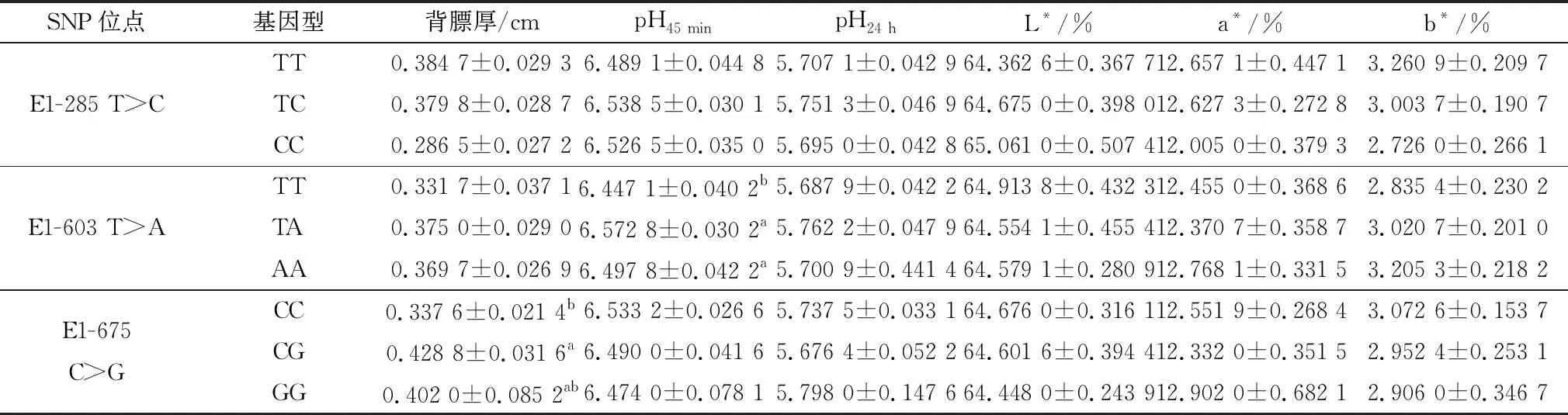
表2 ACOT12基因3个SNPs位点与四川牦牛肉品质性状相关性分析
2.5 ACOT12基因SNPs的单倍型与四川牦牛肉品质的相关性分析由图5可知,3个SNPs位点存在强连锁遗传,并构成了一个结构域,图5A表示SNPs位点之间的连锁程度,数值为D′值,常用来度量连锁不平衡;图5B代表3个位点之间组成的5种单倍型的频率,共组成15种单倍型组合,其中7种单倍型组合具有生物学统计意义(n≥3),分别为H1H1(CC-TT-CC)、H1H2(TC-TA-CC)、H1H3(TC-TA-CG)、H1H4(TC-TT-CC)、H2H2(TT-AA-CC)、H2H3(TT-AA-CG)和H3H3(TT-AA-GG)。由表3可知,H2H2单倍型组合的pH45min值显著高于H1H4(P<0.05),其他单倍型组合与背膘厚、pH24h值和肉色无显著差异(P>0.05)。
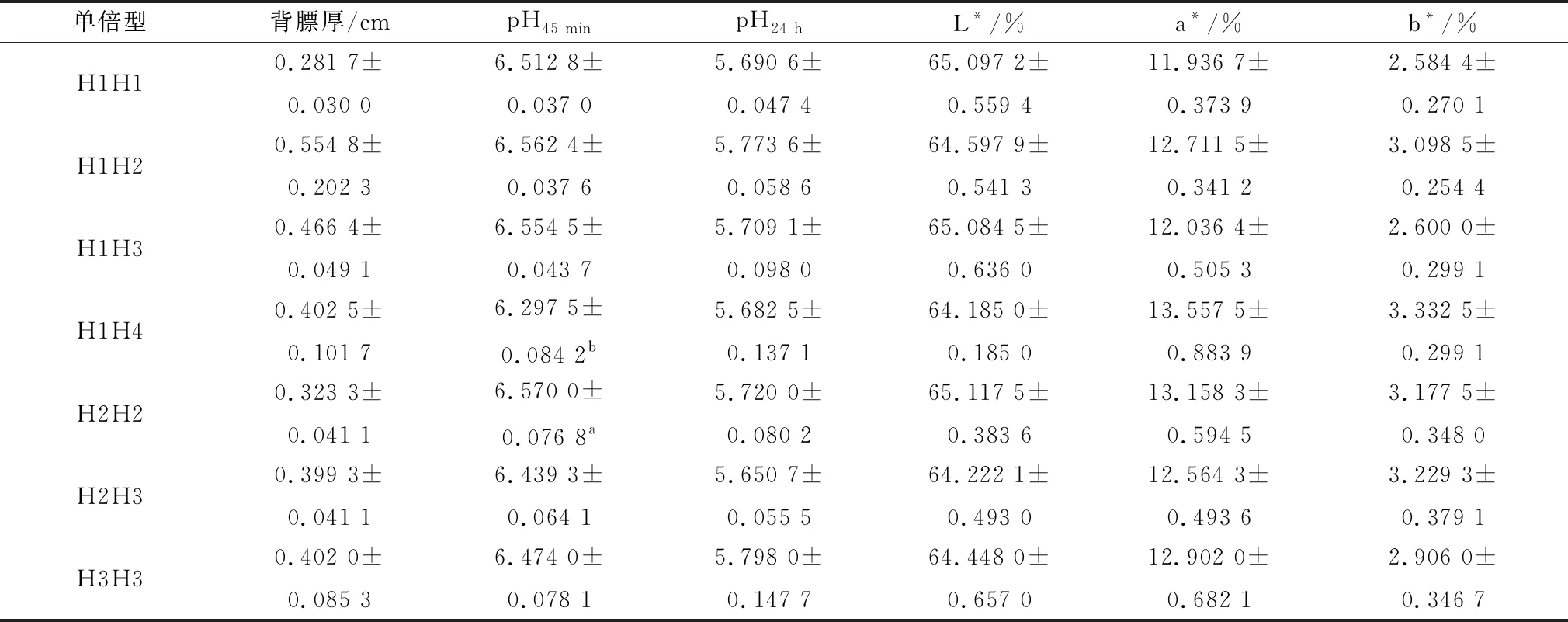
表3 四川牦牛ACOT12基因的单倍型与肉品质的相关性分析结果

A.3个SNPs位点的连锁不平衡的热图(格子中数值为R2值);B.5种单倍型的频率
3 讨论
中国牦牛属肉乳役兼用牛,产乳量高,产肉性能比普通牛品质优异,且能适应高海拔地区的恶劣天气,在提高肉产量及提升肉品质上有着巨大的潜能。如何提高牦牛肉的质量和产量已成为畜牧业生产中不可忽视的问题。近年来,有关ACOT12基因与牛相关的研究较少,其主要研究方向集中于人类医学方面。邢建晓等[9]研究表明,ACOT12的突变频率与皮肤慢性炎症性疾病银屑病显著相关,在1 027个样本中非银屑病个体中的突变频率较高;LU等[10]研究表明,ACOT12调节HCC细胞中的细胞乙酰辅酶A水平和组蛋白乙酰化,并且通过下调ACOT12诱导TWIST2表达和促进上皮-间充质转化从而促进肝细胞癌(HCC)转移,表明ACOT12与肝癌转移和肝癌患者的不良生存密切相关。目前SNP在牛育种的研究中应用广泛,但有关ACOT12基因与四川牦牛肉质性状关联的研究尚未见报道。因此本研究使用直接测序法对102头四川牦牛进行SNP筛选及其与肉品质性状的关联分析。
四川牦牛ACOT12基因的群体遗传特性分析显示,E1-285 T>C、E1-603 T>A位点的遗传杂合度(H)和多态信息含量(PIC)均处于0.25~0.50之间,表明以上位点呈现为中度多态。3个SNPs位点在四川牦牛群体中均处于Hardy-Weinberg平衡状态(P>0.05),表明个体受到人工选择的影响较小,群体遗传性较好。
动物宰后糖酵解速度快,乳酸含量增加,造成肌肉pH值下降,pH值可直接影响嫩度、肉色、蒸煮损失和保存期,是衡量肉质酸化的重要指标[11]。pH值常用简便快捷的pH值计测定,宰前牛肉为中性,随着宰后时间的增加,pH值下降,从而导致肉色变差,持水力下降。背膘厚可客观、科学地评判某一个体的生长发育状况,成为评判个体质量优劣的依据,在畜牧业生产中有着重要意义[12],在评估屠宰加工、检验饲喂成效和生产育种上也有着重要作用。四川牦牛ACOT12基因E1-603 T>A位点的TT基因型个体的pH45 min值显著低于TA、AA基因型个体,一般认为宰后肌肉长时间维持较高的pH值,则说明肌肉持水力强,食用品质好。因此TA、AA基因型个体的pH45 min优于TT基因型个体。突变纯合型AA基因型是该位点的优势基因型,因此可推测ACOT12基因有关pH45 min的优势性状可在日后的基因突变中得到稳定遗传;E1-675 C>G位点的CG基因型个体的背膘厚显著高于CC基因型个体,有研究表明,背膘厚与优质肉重呈负相关[13-14],但对繁殖性能具有一定正向影响[15]。pH45 min值、背膘厚是衡量牛肉质的重要检测指标,可直接用于判断肉质的风味和口感,因此以上2个SNPs位点可作为四川牦牛肉质性状的相关分子标记。
本研究使用Haploview 4.2软件对ACOT12基因的多态性位点进行连锁不平衡分析(linkage disequilibrium,LD),LD又称等位基因关联,可用于评估连锁不平衡的程度[16],随着科学的发展其应用越来越广泛,在疾病的预测和治疗中发挥着重要作用[17]。LD分析发现3个位点存在强连锁遗传,并构成了1个结构域,共有15种单倍型组合,其中7种单倍型组合具有生物学统计意义。单倍型组合与肉品质性状的相关分析发现,H2H2单倍型组合的pH45 min值显著高于H1H4,因此H2H2单倍型组合是pH45 min性状的最优单倍型组合。
综上所述,四川牦牛ACOT12基因的3′UTR和外显子1上共存在3个SNPs位点,分别为E1-285 T>C、E1-603 T>A、E1-675 C>G,其中E1-603 T>A、E1-675 C>G位点分别与pH45 min值、背膘厚性状显著相关,说明以上2个SNPs可作为四川牦牛宰后pH45 min和背膘厚性状的相关分子标记;H2H2单倍型组合的宰后pH45 min值高于其余单倍型组合,因此可作为四川牦牛宰后pH45 min值性状的最优单倍型组合,为未来优质肉牛早期选育提供分子理论依据。

