安石榴苷对脂多糖诱导的鸡腺胃上皮细胞损伤的保护作用机制
王酉馨,彭璐媛,宋 客,黎 江,谭跃荣,李 淼,伊鹏霏
(吉林大学 动物医学学院,吉林 长春 130062)
鸡腺胃炎是一种以家禽生长不良、消瘦、整齐度差,粪便过料等外观症状及腺胃肿大,腺胃黏膜溃疡、脱落,肌胃内金和肌胃黏膜面火山口样溃疡、肌胃糜烂为主要特征的流行病[1]。目前,我国各地均有此病发生的报道,给养殖业造成了严重的威胁。因其致病因素复杂,临床中多采用联合用药对其治疗,疗效并不显著。因此,开发安全有效的药物对于鸡腺胃炎的防治和家禽养殖业的发展都具有重要意义。
胃黏膜具有胃屏障功能,其完整性受多种因素影响。其中,氧化应激在胃肠道黏膜疾病的发病机制中扮演重要角色,ROS和氧化代谢可引起胃黏膜屏障的紊乱和胃损伤的形成[2];胃黏膜保护因子PEG2和NO在维持胃黏膜的完整性方面发挥着重要作用;鸡的TFF2转录遍布整个胃肠道,主要表达位点是腺胃和肌胃,对保护、修复上皮细胞和促进上皮创面愈合具有重要作用[3]。细胞间紧密连接(TJ)是构成肠黏膜机械屏障最重要的结构,由紧密连接蛋白occludin和claudin组成,并通过zona occludens蛋白家族成员ZO-1与相邻上皮细胞的这些蛋白进行连接,通过紧密地封闭细胞与细胞的连接来调节屏障通透性,控制着细胞旁转运途径的通透性,在维持胃黏膜屏障功能方面起关键作用[4-5]。
安石榴苷(punicalagin,Pun)是石榴皮中含量最高的多酚类化合物,具有很强的抗氧化活性[6]。已有研究表明,Pun具有胃保护作用,在热应激诱导的大鼠胃肠道损伤模型中,Pun诱导Nrf2易位和HO-1表达,保护大鼠肠上皮细胞免受氧化应激的影响[7]。基于此,本研究建立LPS刺激鸡腺胃上皮细胞模型,检测鸡腺胃上皮细胞的损伤状态、氧化应激水平、胃黏膜保护因子的表达、紧密连接蛋白的表达以及Nrf2信号通路的激活情况,探究Pun对LPS诱导的鸡腺胃上皮细胞的作用及机制,为鸡腺胃炎的预防和治疗提供新的思路和理论依据,对家禽养殖业的健康发展具有积极的促进意义。
1 材料与方法
1.1 试剂和材料LPS购于Sigma-Aldrich公司;PGE2、SOD、CCK8、ROS、LDH、T-GSH、NO检测试剂盒购于南京建成生物公司;鸡腺胃上皮细胞购于青旗(上海)生物技术发展有限公司;Pun购于成都曼思特生物科技有限公司;DMEM培养基、青霉素/链霉素、胰蛋白酶、胎牛血清购于Gibco公司;0.25% 胰蛋白酶、RIPA裂解液、PMSF、细胞核蛋白与细胞浆蛋白抽提试剂盒、SDS-PAGE蛋白上样缓冲液(5×)、蛋白预染Marker购于碧云天生物技术公司;BCA蛋白定量试剂盒、Power SYBR Green PCR Master Mix购于Thermo公司;ML385购于Saint-Bio公司;ECL试剂盒购于Beyotime公司;PVDF膜购于Millipore公司;Western blot试验中的抗体购于Jackson ImmunoResearch公司。
1.2 仪器设备离心机(Eppendorf);酶标仪(Thermo);切片机(天津天利);二氧化碳培养箱(Thermo);紫外分光光度计(Eppendorf);荧光定量PCR仪(ABI);酶标仪(Thermo);电泳仪(上海天能科技上海天能科技有限公司);流式细胞分析仪(美国BD公司);化学发光仪(上海天能科技有限公司)。
1.3 鸡腺胃上皮细胞的培养使用含10% FBS和1%青霉素/链霉素的DMEM完全培养基将鸡腺胃上皮细胞在37℃、5% CO2条件下培养36 h。当细胞达到80%~90%时传代,用0.25%胰蛋白酶消化细胞2 min,然后将细胞1 000 r/min离心5 min,将细胞沉淀用完全培养基重悬,调整细胞浓度至1×105cell/mL。
1.4 细胞活力、LDH、ROS、SOD、GSH、PGE2和NO的检测将使用细胞96孔板培养24 h后,用4 mg/L的LPS预处理24 h,随后用不同浓度的PUN(4,8,16 μmol/L)处理24 h。根据检测试剂盒说明书进行检测。
1.5 qRT-PCR法检测TFF2、ZO-1、occludin和claudin-3收集细胞,用TRIzol试剂提取样品的总RNA,用分光光度计检测RNA纯度和质量浓度,将RNA反转录为cDNA。以GAPDH为内参基因,采用3步法进行信号采集:95℃预变性10 min;95℃变性15 s,55 ℃退火20 s,60℃延伸30 s,40个循环。用ABI ViiA7荧光定量PCR仪进行qRT-PCR反应。引物信息见表1。

表1 qRT-PCR引物序列
1.6 Western blot法检测总Nrf2、核Nrf2、Keap1和NQO1用预冷的PBS冲洗腺胃上皮细胞3次,每孔加入1 mL RIPA裂解缓冲液。使用BCA试剂盒检测蛋白的质量浓度,取等量样品在12%分离胶上进行 SDS-PAGE。然后取出凝胶在200 mA、4℃下将蛋白质转移到PVDF膜上,室温下用5%牛血清白蛋白封闭90 min。在4℃下与稀释的抗体(1∶1 000)孵育过夜。将HRP标记的二抗按1∶10 000用TBS稀释,被膜与稀释的二抗在室温下孵育 2 h。用化学发光法(ECL)显影,用ImageJ对图像进行定量分析,以β-actin作为内参。
1.7 结果与分析使用GraphPad Prism 8.0软件处理和分析试验数据,并制图。
2 结果
2.1 Pun对LPS诱导的鸡腺胃上皮细胞损伤的影响如图1A所示,当LPS的质量浓度为4 mg/L时,鸡腺胃上皮细胞的活力显著下降(P<0.01)。如图1B所示,当Pun的浓度≤16 μmol/L时,细胞活力变化不显著,当Pun的浓度为32 μmol/L时,细胞活力显著下降(P<0.01)。因此,本研究使用4 mg/L LPS和4,8,16 μmol/L Pun用于后续试验。如图1C,D所示,与空白对照组相比,LPS处理后鸡腺胃上皮细胞的活力显著下降(P<0.01),LDH释放显著增加(P<0.01);而Pun处理后鸡腺胃上皮细胞的活力明显上升(P<0.01),LDH的释放减少(P<0.05)。

A.不同浓度的LPS处理后的细胞活力;B.不同浓度的Pun处理后的细胞活力;C.LPS和Pun先后处理后的细胞活力;D.LPS和Pun先后处理后LDH的释放;*.P<0.05;**.P<0.01;#.P<0.05;##.P<0.01。下同
2.2 Pun对LPS诱导的鸡腺胃上皮细胞胃黏膜保护因子的影响如图2所示,与空白组相比,不同浓度Pun处理的鸡腺胃上皮细胞的PGE2,NO含量,TFF2的mRNA转录水平显著下降(P<0.01);而Pun处理组细胞的PGE2和NO的含量不同程度增加(P<0.05),TFF2的mRNA转录水平显著升高(P<0.05)。

A.鸡腺胃上皮细胞的PGE2分泌水平;B.鸡腺胃上皮细胞TFF2基因的转录表达水平;C.鸡腺胃上皮细胞的NO分泌水平
2.3 Pun对LPS诱导的鸡腺胃上皮细胞紧密连接蛋白的影响如图3所示,与空白组相比,鸡腺胃上皮细胞中ZO-1,claudin-3,occludin的mRNA转录水平显著下调(P<0.01);而Pun处理后其转录水平显著上调(P<0.05)。
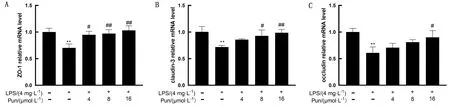
A.鸡腺胃上皮细胞ZO-1基因表达;B.鸡腺胃上皮细胞claudin-3基因表达;C.鸡腺胃上皮细胞occludin基因表达
2.4 Pun对LPS诱导的鸡腺胃上皮细胞氧化应激的影响如图4所示,与空白组相比,鸡腺胃上皮细胞的ROS水平显著上升(P<0.01),总SOD,GSH水平显著下降(P<0.01),而Pun处理后ROS水平下调,总SOD和总GSH水平上升。
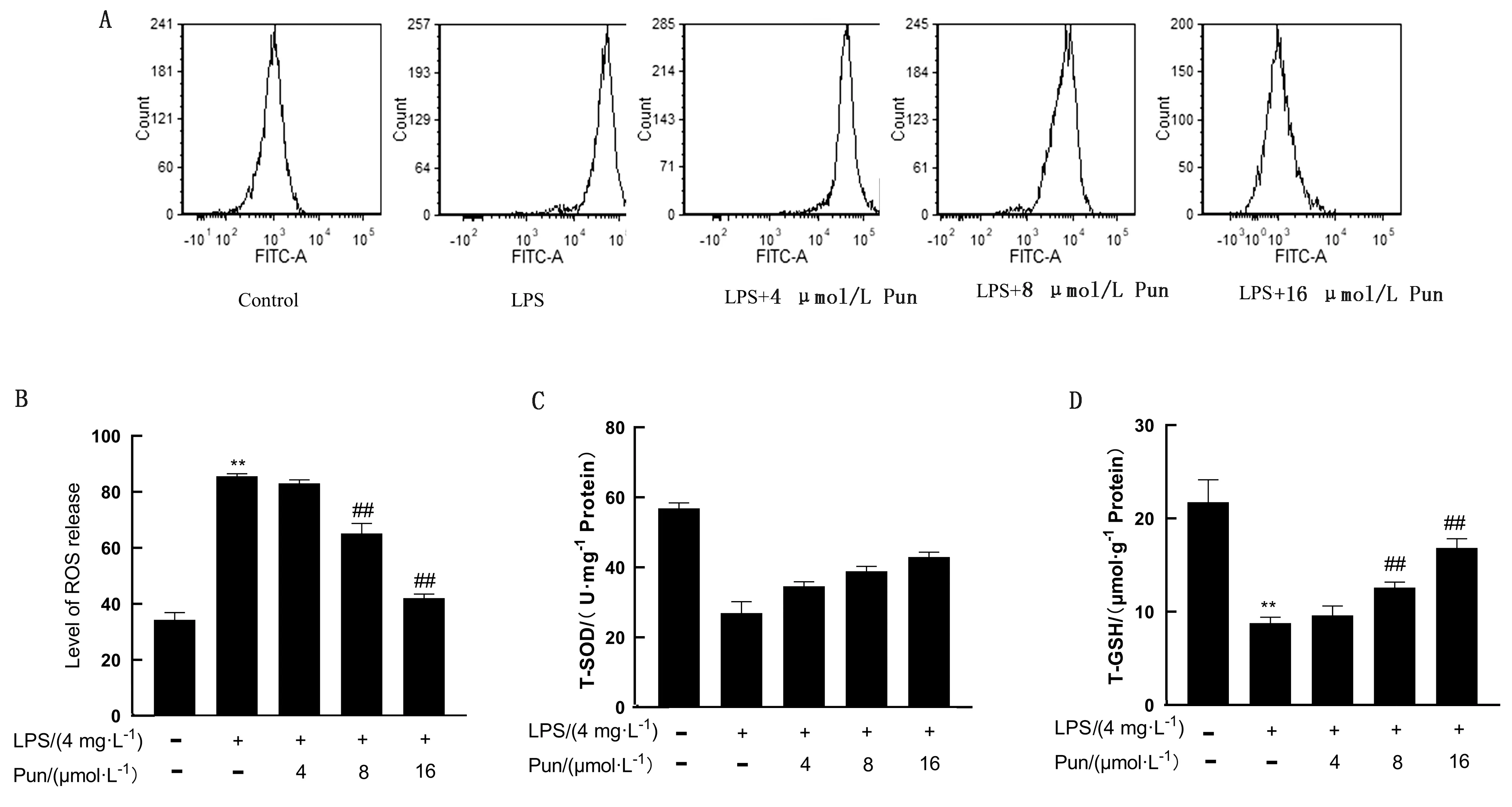
A,B.鸡腺胃上皮细胞的ROS水平;C.T-SOD水平;D.T-GSH水平
2.5 Pun对LPS诱导的鸡腺胃上皮细胞Nrf2信号通路的影响如图5所示,与空白组相比,LPS处理后鸡腺胃上皮细胞中Nrf2、NQO1和Keap1的蛋白水平显著下降(P<0.01);而Pun处理后其蛋白水平显著上升(P<0.05或P<0.01)。
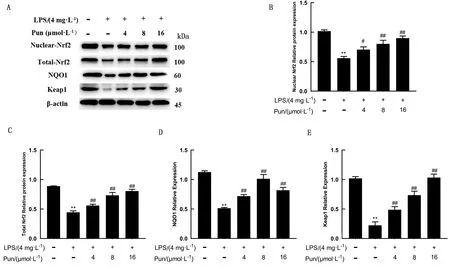
A.鸡腺胃上皮细胞的Nrf2信号通路蛋白的Western blot检测结果;B.核Nrf2相对定量分析;C.总Nrf2相对定量分析;D.NQO1相对定量分析;E.Keap1相对定量分析
采用Nrf2抑制剂ML385进一步探究Pun对LPS诱导的鸡腺胃上皮细胞损伤的保护机制。如图6所示,与空白组相比,LPS处理后鸡腺胃上皮细胞中ROS的生成显著增加(P<0.01),紧密连接蛋白ZO-1、occludin和claudin-3的mRNA表达水平显著下调(P<0.05或P<0.01),而Pun处理后ROS的生成显著减少(P<0.01),紧密连接蛋白的mRNA表达水平显著上调(P<0.05或P<0.01)。当ML385加入后,ROS的量显著增加(P<0.01),紧密连接蛋白的mRNA转录水平显著下降(P<0.05或P<0.01)。
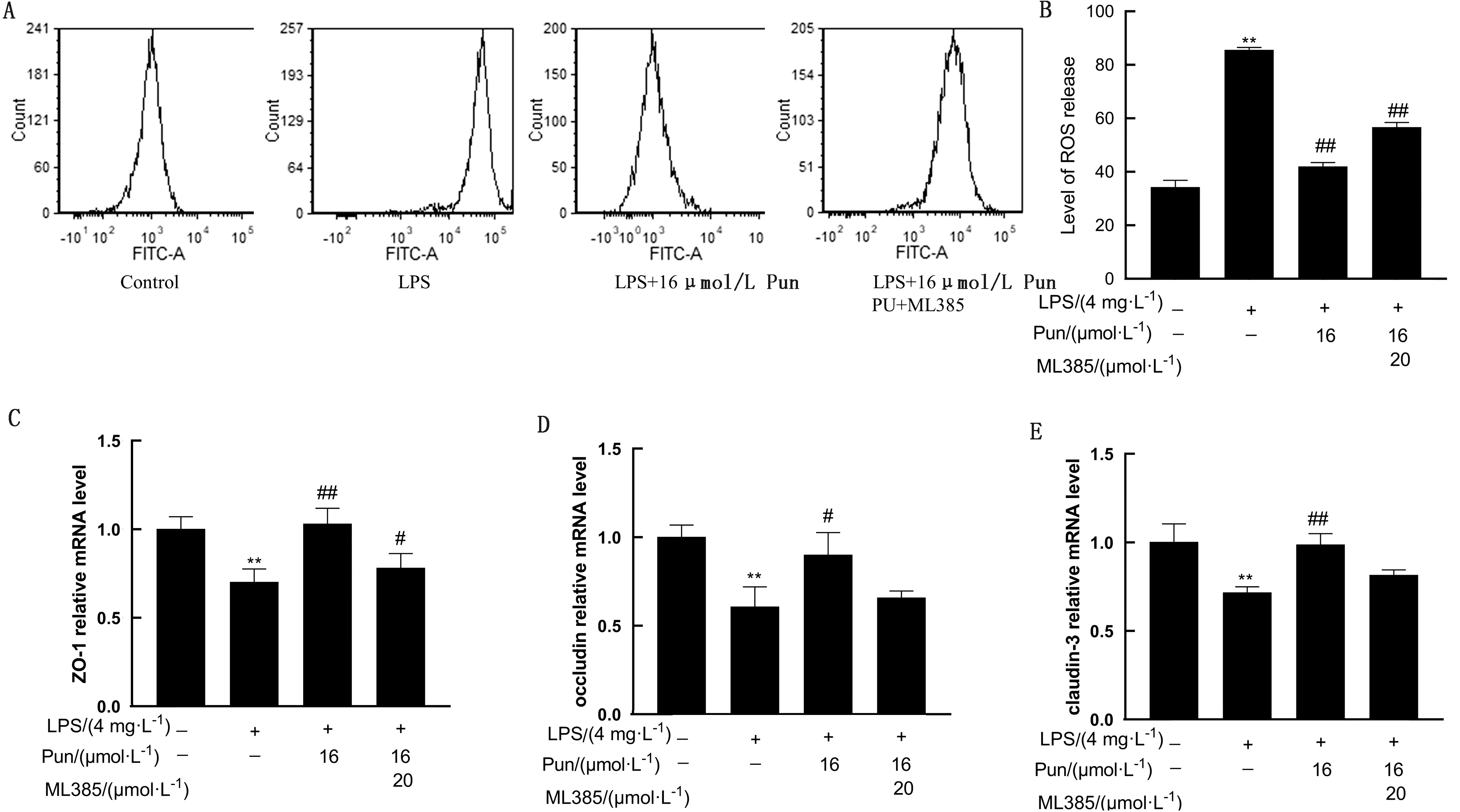
A,B.鸡腺胃上皮细胞ROS表达水平;C.鸡腺胃上皮细胞ZO-1的表达水平;D.鸡腺胃上皮细胞occludin的表达水平;E.鸡腺胃上皮细胞claudin-3的表达水平
3 讨论
鸡腺胃炎是一种常见的传染性疾病,严重损害腺胃黏膜,使胃酸和胃蛋白酶的分泌量及活性降低,进入腺胃的饲料难以被正常地消化利用,使鸡群生长发育缓慢、饲料转化不良、消化饲料的能力受损和整齐度下降[1]。胃黏膜屏障功能损伤是鸡腺胃炎致病的重要因素,主要与氧化应激和胃黏膜完整性相关。因此探究有效治疗药物的作用机制具有重要意义。
以往研究表明,LPS能诱导胃黏膜通透性使胃的通透性增加,破坏胃黏膜表面的疏水屏障,损害胃黏膜的完整性,加重胃损伤[8-9],故本研究采用LPS诱导鸡腺胃上皮细胞,从分子水平上模拟鸡腺胃炎的发生。
Pun作为一种天然抗氧化剂,可以降低肝损伤小鼠氧化应激水平及改善糖尿病小鼠脂质代谢紊乱及氧化应激状态[10-11]。本研究发现Pun能通过促进PGE2和NO的释放以及TFF2的表达来保护和修复LPS诱导的鸡腺胃黏膜损伤,同时能使ZO-1、occludin和claudin-3的表达水平显著增加,说明Pun能够修复被LPS损伤的腺胃黏膜的完整性。
研究表明,紧密连接蛋白与各种细胞内信号分子相关,并受到包括氧化应激在内的多种信号通路的控制[12]。ROS是生物系统氧化代谢的副产物,过量的ROS生成对蛋白质、脂质和核酸等重要的细胞生物分子产生有害影响,而抗氧化酶SOD控制ROS的水平,从而限制其潜在的毒性,在维持氧化还原稳态方面发挥着重要作用[5,13]。GSH也是氧化还原信号转导的关键决定因素,对氧化应激具有保护作用[14]。此外,Nrf2是介导抗氧化剂保护作用的关键转录因子,在稳态条件下,Nrf2受到细胞质中Keap1的负调控,Nrf2-Keap1系统协调一个非常强大的抗氧化防御机制[15-16]。为应对氧化应激,Nrf2易位到细胞核中并与ARE结合,刺激抗氧化蛋白的转录,包括GST、NQO1、SOD以及参与清除ROS和GSH生物合成和再生的蛋白等,导致下游抗氧化系统的激活[17]。本研究发现Pun处理后,LPS损伤的鸡腺胃上皮细胞中ROS的生成受到抑制,总SOD和总GSH的水平显著上升,Nrf2信号通路的活性显著增强。这些结果提示,Pun能够减轻LPS诱导的鸡腺胃上皮细胞的氧化应激,并且其抗氧化作用可能与Nrf2信号通路的活性有关。随后,加入ML385[18]特异性抑制Nrf2后,细胞中ROS水平显著上升,ZO-1、occludin和claudin-3的mRNA表达水平显著下降,说明Pun能通过调控Nrf2信号通路的活性发挥抗氧化作用。
综上所述,Pun通过保护和修复LPS诱导的鸡腺胃黏膜损伤,并调控Nrf2信号通路的活性,抑制氧化应激来保护LPS诱导损伤的鸡腺胃上皮细胞,为Pun预防和治疗鸡腺胃炎提供参考,对家禽养殖的生产实践具有一定的指导和借鉴意义。

