猪链球菌2型转座子文库构建及毒力基因筛选
杨求磊,吴 桐,闫广谋,李 娜,李丰阳,雷连成
(1.吉林大学 动物医学学院 教育部人兽共患病研究重点实验室,吉林 长春 130062)
猪链球菌(Streptococcussuis,SS)是一种重要的人兽共患病病原菌,可引起猪脑膜炎、败血症、心内膜炎、关节炎和肺炎等疾病,给养猪业造成巨大的经济损失[1]。SS可经飞沫或伤口接触而感染人,导致脑膜炎和中毒性休克综合征(STSS)等疾病,威胁人类健康。SS属于革兰阳性兼性厌氧球菌,根据其荚膜抗原的不同,被分为29个血清型[2]。其中又以猪链球菌2型(Streptococcussuisserotype 2,SS2)流行最广,致病性最强,危害最重[3]。SS2的致病性强弱与其毒力因子有关,目前为止已经发现了多种与SS2致病性相关的毒力因子,主要包括荚膜多糖、胞外因子、溶菌酶释放蛋白、猪溶血素、谷氨酸脱氢酶、纤粘连蛋白等[4-5]。但是一些研究表明这些毒力因子的单个或多个缺失对某些菌株毒力的影响并不明显,提示上述毒力因子在SS2致病性上可能协同发挥作用以及存在新的毒力因子或毒力因子基因决定簇[6]。因此,鉴于SS2较强的人兽共患性,挖掘新的SS2毒力因子对防控SS2感染具有重要意义。
转座因子或转座子是一类在很多动物中(包括线虫、昆虫和人等)发现的可自由移动的跳跃因子,可以自主复制及跳跃插入到某功能基因中,引起该基因失活,产生突变体[7]。目前研究最成熟的是Himar1转座元件,该元件分离自西方角蝇,是在细菌诱变中应用最广泛的Mariner家族转座子,可编码催化转座酶蛋白,并在无处不在的TA二核苷酸位点插入,且Himar1转座不需要寄主特异性因子,因此,该元件已成为在细菌基因组中进行随机突变的先进工具[8]。本研究利用Himar1转座诱变体系构建SC-19菌株的突变体文库,其中,pMar4S是专为随机诱变SS而设计的穿梭载体,该载体携带有TnYLB-1转座子、高温敏感的SS复制子以及依赖σA 启动子引导的 Himar1 转座酶[9]。高温条件下,pMar4S质粒无法复制,在Himar1 转座酶的催化作用下,TnYLB-1 转座子可以插入到SS2基因组任意的TA序列中,导致基因被随机诱变失活,进而构建突变体文库[10]。根据表型变化设计试验筛选突变菌株,通过生物检测等方法鉴定基因位点,选择毒力下降明显的基因进一步研究,并建立SUT2基因敲除株、回补株,对其生长特性进行观察,通过小鼠致病性试验了解其致病性。本研究为进一步阐明 SS2 的致病机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1主要试剂和仪器 SS2 SC-19菌株由本实验室于2005年分离自感染SS2的病猪。pMar4S质粒由南京农业大学马喆教授馈赠;大腊螟幼体,0.35~0.40 g,购自诺摩宠物用品企业店;BALB/c小鼠,6~8周,20~22 g,雌性,购自辽宁长生生物科技有限公司;本研究所用的限制性内切酶TaqⅠ、T4连接酶、HindⅢ、EcoRⅠ、Taq 酶均为 TaKaRa 公司产品;卡那霉素 (Kan+) 和壮观霉素 (Spc+) 均购自 Sigma 公司;其他试剂均为国产分析纯;所用引物见表1;基因测序均由吉林省库美生物科技有限公司完成。

表1 引物及相关信息
1.1.2培养条件 SS2 SC-19在BHI培养基中,37℃条件下培养;含有转座子的SS在28℃ 条件下,于含有100 mg/L卡那霉素(Kan+)的BHI培养基上培养;SS突变体在37℃ 条件下,于含有100 mg/L 卡那霉素(Kan+)的BHI培养基上培养;参考天根质粒提取试剂盒提取质粒。
1.2 方法
1.2.1SC-19菌株感受态的制备 用接种环取少量SC-19冻存菌液,3区划线于BHI平板,置于37℃温箱,过夜培养。挑取平板上的单菌落,接种至5 mL液体BHI,37℃、180 r/min 振荡培养12 h。将培养的菌液1∶100转接至含DL-苏氨酸的液体BHI(DL-苏氨酸终浓度40 mmol/L),37℃、180 r/min 振荡培养至D=0.3~0.5;冰浴15~30 min,5 000 r/min、4℃离心10 min,收集菌体;先用预冷的EB重悬菌体,洗涤2次,再用预冷的15%甘油重悬,洗涤1次,加入约1%最初菌体体积的15%甘油重悬;100 μL/管分装,-80℃保存。
1.2.2SC-19菌株的转化 取总量1 μg的 pMar4S质粒加至100 μL SS2感受态中,轻轻吹打混匀,全部转移至预冷的0.1 mL电转杯中,并将电击杯置于冰上冰浴20 min;擦干电转杯,设置电压2 500 V进行电转;电转后立即加入1 mL复苏液,并转移至2 mL 无菌EP离心管中,28℃、180 r/min 振荡培养2 h;取50 μL涂布于含Kan+(100 mg/L)的BHI平板,37℃培养过夜,诱导转座。
1.2.3高温诱导TnYLB-1转座子插入SC-19菌株基因组 挑取含Kan+(100 mg/L)的 BHI平板上长出的单菌落,对点划线于含Kan+(100 mg/L)的BHI平板及Spc+(100 mg/L)的BHI平板,37℃培养过夜。转座子片段TnYLB-1中含卡那霉素抗性筛选基因,pMar4S质粒中除转座子片段之外还存在1个Spc+(100 mg/L)抗性筛选基因,故可筛选出抗Kan+(100 mg/L) 而不抗Spc+(100 mg/L)的突变菌株。构建SS2突变体文库,并统计pMar4S质粒应用于SS2的转座效率。
1.2.4突变体TnYLB-1 插入的PCR验证 随机挑取18株SS2突变体文库中的转座子突变株,接种至含Kan+(100 mg/L)的液体BHI,37℃、180 r/min进行增菌培养。取菌液为模板,以引物oITR 通过PCR检测转座子TnYLB-1的基因片段。反应程序参考文献[11]:95℃ 5 min;94℃ 45 s,66℃ 60 s,72℃ 2 min,30个循环;72℃ 10 min。
1.2.5突变体菌株的大腊螟攻毒试验 用SS突变体感染大腊螟(G.mellonalla)幼虫。用10 μL 不同突变SS菌株的接种物在左后前肢感染幼虫,这些菌株的浓度为1 × 107CFU/mL,每隔6 h 记录1次幼虫的存活率直至72 h[12]。在感染试验中,将1× 107CFU/mL的SS作为阳性对照,用PBS作为阴性对照。
1.2.6反向PCR检测转座子插入位点 用限制性内切酶TaqⅠ在65℃对突变株的基因组酶切4 h,用试剂盒纯化酶切产物,然后用T4DNA连接酶进行连接,使DNA片段环化[11]。利用引物oIPCR1和oIPCR2对环化的DNA进行反向PCR(inverse PCR,IPCR)扩增。扩增程序:94℃ 5 min;94℃ 30 s,47℃ 30 s,72℃ 2 min,30个循环;72℃ 5min。对PCR产物进行测序及序列比对分析,确认转座子插入位点。
1.2.7SUT2基因缺失菌株的构建与鉴定 以提取的SC-19菌株的基因组为模板,采用引物A1/A2和A3/A4分别经PCR扩增SUT2基因的上、下游同源臂,通过融合PCR融合上下游同源臂,以EcoRⅠ和HindⅢ双酶切同源臂的PCR扩增产物,以EcoRⅠ和HindⅢ双酶切pSET4S,通过T4连接酶于16℃连接,将连接产物转化DH5α大肠杆菌感受态中,构建重组质粒,经PCR和测序鉴定正确后命名为pSET4S-S。将pSET4S-S电转入SC-19菌株,28℃振荡培养2 h后加入Spc+(100 mg/L),振荡培养10 h,接菌于新的培养基中,于37℃扩大培养12 h,将培养物(1∶100)转接至BHI液体培养基,28℃继续培养12 h后,传3代,涂布于BHI琼脂平板,37℃培养至长出单菌落并挑取单菌落涂布于含Spc+( 100 mg/L )的BHI琼脂平板,阳性菌株不能在含Spc+(100 mg/L)的BHI琼脂平板上生长。
1.2.8SUT2基因回补菌株的构建与鉴定 以SUT2基因缺失菌株为模板,设计引物将目的基因PCR扩增后用SphⅠ和BamHⅠ双酶切,回收后再与用相同内切酶处理的质粒载体pSET2进行连接,转化连接产物至DH5α感受态中,PCR和测序鉴定正确后,将含重组表达质粒的菌株命名为pSET2-U。将pSET2-U通过电转化至缺失株△SUT2感受态中(方法如1.2.2),加入复苏液BHI,振荡培养2 h,再加入含Spc+(100 mg/L)的BHI液体培养基,37℃、180 r/min振荡培养12 h,取菌液划线于含Spc+(100 mg/L)的固体BHI平板,培养24 h,挑取单菌落于含Spc+(100 mg/L)的BHI液体培养基中,并通过引物Y1/Y2进行PCR,测序后通过生物信息学比对分析进行鉴定。
1.2.9生长曲线测定 将SS2野生株SC-19、缺失株△SUT2和回补株C△SUT2划线接种于BHI固体培养基上,37℃培养箱培养18 h,挑取单菌落,在试管中37℃、180 r/min振荡培养12 h。次日利用分光光度仪将各菌株培养液的D600值调至一致,按 1∶100比例接种到新鲜的BHI液体培养基中,37℃、180 r/min振荡培养。以BHI液体培养基为空白对照,每隔1 h 无菌取样,用分光光度计测定培养物D600值,连续测定10 h,比较野生株SC-19菌株缺失株△SUT2和回补株C△SUT2的D600值差异。
1.2.10小鼠致病性试验 从BHI平板上挑取野生株SC-19、缺失株△SUT2和回补株C△SUT2的单克隆,转接于5 mL新鲜培养基中,37℃、180 r/min摇床中12 h,5 000 r/min离心5 min,用PBS清洗3遍,调整D600=0.8;调整菌液浓度至 1×1010CFU/mL;将40只雌性、体质量(18±2) g的BALB/c小鼠随机分为4组,每组10只,第1组注射PBS,其余3组分别腹腔注射野生株SC-19菌株、缺失株△SUT2和回补株C△SUT2,各组每只小鼠注射100 μL菌液浓度为1×1010CFU/mL菌液,观察BALB/c小鼠的存活状况。
2 结果
2.1 高温诱导TnYLB-1转座插入SC-19菌株基因组在高温条件下TnYLB-1被诱导随机插入到猪链球菌的基因组,而pMar4S质粒的残余部分会消失,质粒上的壮观霉素抗性也会随之消失。因此,根据同一单菌落在含卡那霉素抗性的BHI培养基上能够生长,而在壮观酶素抗性的BHI培养基上不能生长的特性,挑取了450个突变体,pMar4S质粒应用于SS2的转座效率达到83.33%(转座效率=壮观霉素敏感菌株数/卡那霉素敏感菌株数)。
2.2 突变体TnYLB-1 插入的PCR验证从SC-19菌株的突变体文库中随机挑选了18个突变体,PCR检测结果(图1)表明,18个突变体基因组DNA中都扩增出约1 342 bp的片段,同质粒pMar4S为模板(阳性对照)扩增出的片段大小一致,而从野生型SC-19菌株基因组中不能扩增出该片段,说明TnYLB-1的转座插入成功。

M.DL2000 DNA Marker;1~18.突变株样本;19.阳性对照;20.阴性对照
2.3 突变体菌株的大腊螟攻毒试验将注射10 μL SS2 (1×107CFU/mL)的大腊螟作为阳性对照,其死亡率为100%;试验组大腊螟注射10 μL 突变株 (1×107CFU/mL),记录0,6,12,24,30,36,42,48,54,60,66,72 h大腊螟幼虫的活动、茧形成、黑化以及生存情况,判定突变体表型变化的菌株[12],最终确定8株毒力减弱的突变体。根据最终鉴定得到的突变株的基因位点,绘制大腊螟数据图(图2)。

图2 SS2感染大腊螟幼虫健康评分的比较
2.4 反向PCR检测转座子插入位点利用反向PCR扩增18株毒力减弱的突变株(图3),其中毒力最弱突变株侧翼序列的大小为888 bp。PCR样品经测序后进行生物信息学分析,利用NCBI的BLAST工具对上述致病性减弱的突变株的pMar4S转座子插入位点侧翼序列进行比对,并分析插入位点基因及编码产物,最终确定8个插入位点基因(表2),分别编码二氨基庚酸脱羧酸、M24金属肽酶、两种假设蛋白、ABC转运通透酶亚基、磷酸吡哆醛依赖性氨基转移酶、ABC转运蛋白结合底物、核糖核酸G和E。

M.DL2000 DNA Marker;1.SC-19;2.阴性对照;4~21.18株突变文库中突变株样本
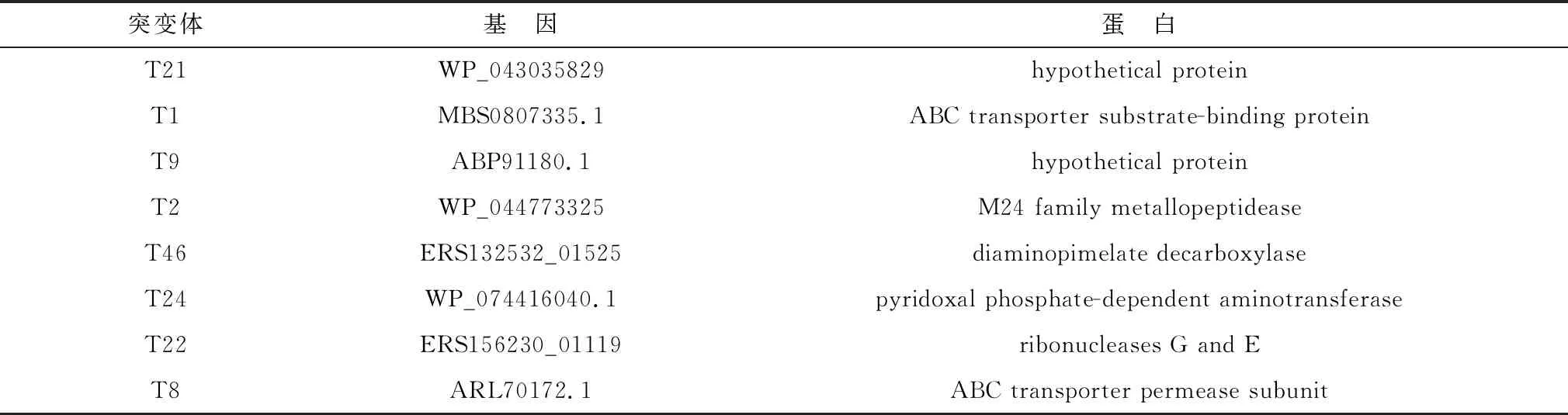
表2 TNYLB-1转座子插入位点
2.5 缺失株△SUT2构建及鉴定利用A1/A4引物进行PCR,鉴定△SUT2基因敲除重组载体(图4),并对PCR产物进行测序,利用正确的基因敲除重组载体,通过同源重组方法构建△SUT2基因敲除株,利用目的基因外部引物通过PCR鉴定△SUT2敲除株(图5),并对PCR产物进行测序和序列比对。

M.DL2000 DNA Marker;1.重组载体质粒样本;2.阳性对照;3.阴性对照

M.DL2000 DNA Marker;1.阳性对照;4.阴性对照;2~3.样品;5~8.样品
2.6 回补株C△SUT2的构建及鉴定利用Y1/Y2引物通过PCR鉴定回补重组载体C△SUT2(图6)和回补株C△SUT2(图7),并对PCR产物进行测序和序列比对,确定C△SUT2回补株构建成功。

M.DL2000 DNA Marker;1~5.样品.6.阳性对照;7.阴性对照
M.DL2000 DNA Marker;1~3.样品;4.阳性对照
2.7 生长曲线测定生长曲线显示,△SUT2突变株较SC-19菌株生长迟缓,C△SUT2回补株相较△SUT2突变株生长缓慢,野生型、敲除型、回补型菌株经历约2 h迟缓期后进入对数生长期,8 h后进入平台期,且△SUT2缺失株和C△SUT2回补株在平台期菌液D600 nm值较野生株低(图8)。

图8 SC-19、△SUT和C△SUT生长曲线测定
2.8 小鼠致病性试验结果显示,在7 d内,注射PBS的对照组小鼠始终保持活跃状态,注射1×109CFU/mL SC-19组的小鼠在18 h死亡1只,24 h 死亡5只,36 h死亡8只,48 h死亡10只,在48 h小鼠死亡率为100%。注射相同菌量的△SUT2敲除菌株小鼠在攻毒后7 d内无死亡情况,在12 h精神萎靡,24 h恢复正常精神状态。注射相同菌量的C△SUT2回补菌株小鼠在24 h死亡2只,36 h死亡1只,48 h死亡1只,直至168 h无任何死亡情况。表明SC-19菌株在缺失△SUT2基因后对小鼠的致死率显著降低(图9)。
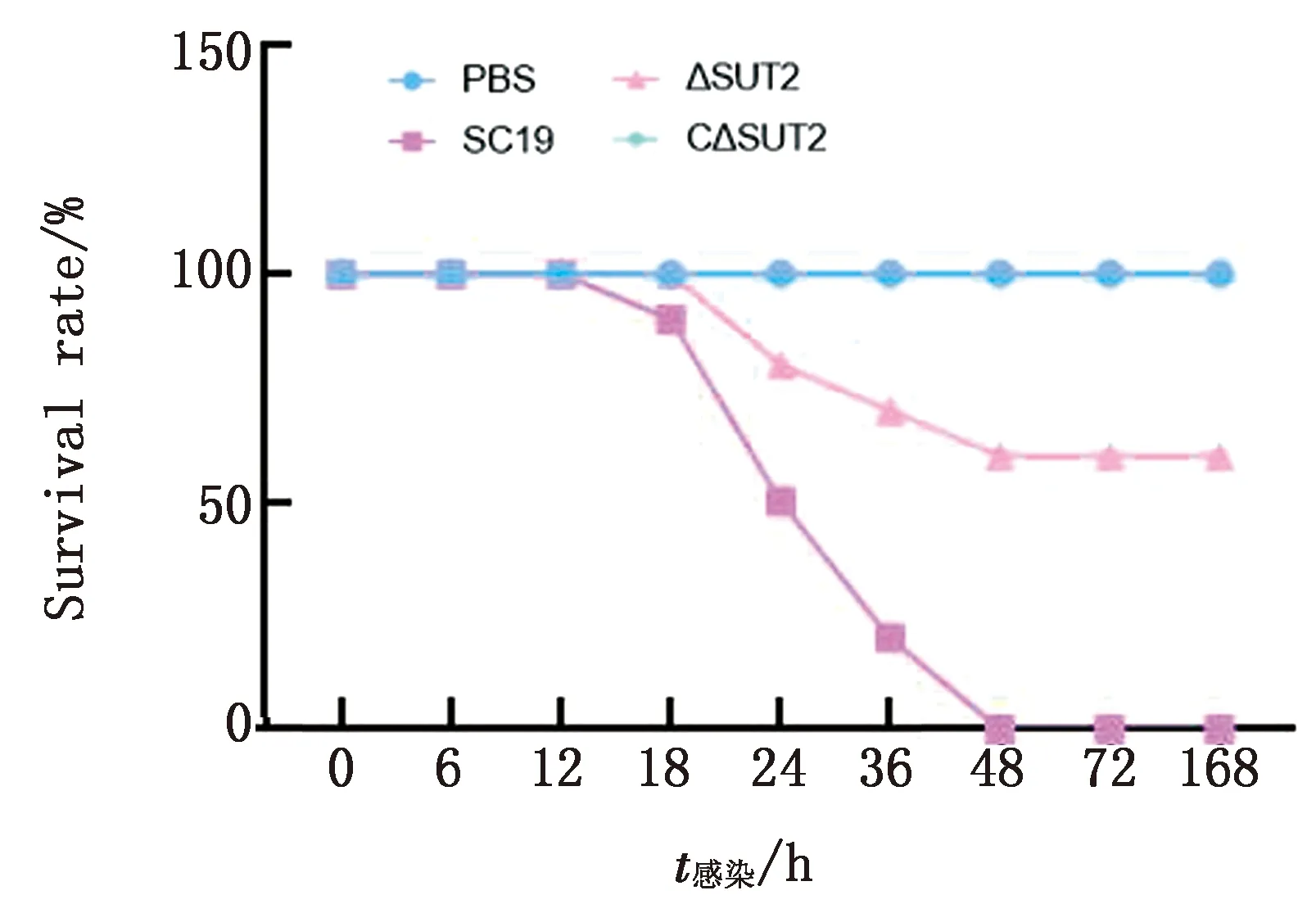
图9 SC-19、△SUT和C△SUT小鼠存活率测定
3 讨论
本研究利用有TnYLB-1转座子片段的pMar4S质粒构建SS2 SC-19菌株突变体转座子文库。研究发现pMar4S质粒对SC-19菌株的转座效率达到了83.3%,说明pMar4S质粒适用于建立SS2转座子文库。利用大蜡螟毒性试验筛选18株致病性减弱突变株,通过IPCR及序列比对确定8种毒力基因。IPCR结果显示筛选的突变体基因组为转座子单插入,并且插入位置不同,说明转座子随机、单拷贝插入SC-19菌株文库的构建非常成功。但是IPCR过程往往出现非特异性条带及弥漫性条带,片段自连效率及片段大小都可能导致IPCR失败,这也就导致只筛选出18株毒力致弱的突变株,最终只确定8种毒力因子,这也是Mariner转座子一个缺点,无法快速分析插入位点。构建敲除株△SUT2和回补株C△SUT2,通过小鼠致病性试验进一步明确,敲除△SUT2基因的菌株与野生型相比毒力下降100%,回补C△SUT2基因的菌株对小鼠死亡率为40%。推测可能涉及碳水化合物转运或ABC转运蛋白的多效性有关。
Himar1转座元件是在细菌诱变中应用最广泛的 Mariner 家族转座子[13]。基于Mariner1转座原件构建的穿梭载体pMar4s及其携带的TnYLB-1已经成为SS转座诱变及基因功能研究的新型有效工具,已成功应用于SS2的抗吞噬研究[14]。目前,SS无法通过单个毒力基因或多个毒力基因协作确定是强毒株还是弱毒株[6]。本研究通过穿梭载体pMar4s构建SC-19菌株突变体文库,筛选毒力减弱缺陷型突变体,最终确定8个毒力相关基因,分别为二氨基庚而酸脱羧酸、M24金属肽酶、两种假设蛋白、ABC转运通透酶亚基、磷酸吡哆醛依赖性氨基转移酶、ABC转运蛋白底物结合蛋白、核糖核酸G和E。
ABC转运蛋白底物结合蛋白和ABC转运蛋白通透酶亚基,都属于腺苷三磷酸结合盒转运蛋白,内含1个腺苷三磷酸而得名。ABC是生物体中最大的转运蛋白超家族。在原核生物中,ABC转运蛋白可以摄取营养物质,并将毒素和药物排除体外。ABC多重耐药转运蛋白在肺炎链球菌中可以排出有毒物质,并能够输出毒力因子参与定植和感染宿主细胞[15]。ABC转运蛋白和金属离子对化脓链球菌的生长和毒力很重要[16],碳水化合物的获取和代谢对细菌生长、增殖及致病能力很重要。现已证明参与碳水化合物摄取和代谢的蛋白质有助于SS的致病性[17]。有研究表明,有多种链球菌可以形成生物膜, ABC转运系统的蛋白也许会影响SS的生物膜形成。
在结核杆菌中,磷酸吡哆醛依赖性氨基转移酶是小鼠生长和毒力所必需的[18]。此外,磷酸吡哆醛依赖性氨基转移酶可能在能量产生、细胞膜、运动性、趋化性、翻译后修饰和铁相关机制中起重要作用[19]。因此,推测磷酸吡哆醛依赖性氨基转移酶可能具有多效性。二氨基庚二酸脱羧酶是磷酸吡哆醛(PLP)依赖性酶,对微生物生长和致病性至关重要。二氨基庚二酸脱羧酶是催化细菌二氨基庚二酸生物合成途径的最后一步,反应的产物是必需氨基酸l-赖氨酸,它是合成细菌的肽聚糖细胞壁、看家蛋白质和毒力因子的重要前体[20]。肽酶M24超家族是由许多不同类型的蛋白质组成的复杂群体。有研究表明M24金属蛋白肽酶PepP,PepP是一种参与介导弯曲杆菌病的新的毒力决定簇[21]。核糖核酸G和E属于Rpi,是一种高度保守的蛋白酶,参与原核和真核生物的戊糖磷酸途径,反应的产物或成为糖酵解的中间体,或成为合成核苷酸、维生素、氨基酸和细胞壁成分[22]。另两种假设蛋白需要进一步验证。
环境的不同可引起一系列基因的共同表达,包含毒力基因和非毒力基因,一些非毒力基因的产物也可能参与协助毒力基因的某些功能,因此SS引起的中毒性休克综合征、脑膜炎等病理变化往往需要一系列的物质共同协调完成。本研究筛选出8个毒力相关的基因,并选择ABC转运蛋白家族未知基因(ARL70172.1)进行基因敲除和回补,通过小鼠试验证明毒力基因敲除株的毒力下降明显,为进一步研究SS致病机制和药物治疗奠定了基础。

