锌指蛋白440在人膝关节OA软骨细胞损伤中的促进作用及机制*
龚高进 范海泉 江洋 黄海汛
(成都医学院第二附属医院·核工业四一六医院脊柱骨科,四川 成都 610000)
骨性关节炎(Osteoarthritis, OA)是最常见的退行性关节疾病,可导致持续的关节疼痛和功能丧失[1]。OA期间,炎症介质如白介素(IL)-1β、IL-6和单核细胞螯合蛋白-1(Monocyte chemoattractant protein,MCP-1)的水平增加,导致基质金属蛋白酶(Matrix metalloproteinase,MMP)表达上调和Ⅱ型胶原蛋白(COL2A1)等软骨细胞外基质(Extracellular matrix,ECM)成分表达降低,最终引起关节软骨破坏[2-3]。锌指蛋白(Zinc-fingers,ZNF)是一种含锌离子的金属蛋白,是真核生物中研究最充分的转录因子家族之一[4]。证据[5]表明,某些种类的ZNF可能在多种疾病类型中发挥关键的病理生理作用,包括OA。与未检测到或轻度关节突(Facet joint)OA患者相比,miR-181a-5p和miR-4454在中度至重度关节突OA患者的FJ软骨细胞中表达上调,并通过靶向ZNF440来介导下游的核转录因子(NF-κB)信号,促进OA关节退化的发生发展[6]。然而,ZNF440在膝关节(Knee)OA病理过程中对关节软骨退化的整体作用在很大程度上是未知的。本研究利用人类膝关节OA软骨确定ZNF440的表达,并探索其在膝关节OA软骨退行性病变中的作用及机制。
1 材料与方法
1.1 实验材料 抗ZNF400抗体(Abcam,ab66849,美国);山羊抗兔IgG荧光抗体(Sant,sc2749,美国);抗PARP p85抗体(Promega,G734,美国);抗β-actin抗体(Sigma,A1978,美国);ZNF400 siRNA(Santa,sc97725,美国);人重组IL-1β(R&D systems,201-LB美国);Lipofectamine RNAiMAX转染试剂(Invitrogen,13778075,美国)。
1.2 人Knee软骨的获取和分级 Knee OA软骨来源于接受全膝关节置换术(Total Knee Arthroplasty,TKR)的患者,OA影像学严重程度由Kellgren-Lawrence分级法[7]确定。Ⅲ和Ⅳ级患者的软骨样本作为Knee OA组;对照组软骨样本来自接受TKR手术的患者外侧髁未受损区域。Knee软骨的退化程度由OARSI评分[8]来评估。通过组织病理学染色分析进一步确定对照组和Knee OA组软骨变性程度。提供膝关节软骨样本的患者基本特征,见表1。
1.3 番红O-固绿(Safranin O-Fast Green)染色检测软骨退变程度 Knee软骨样本在福尔马林中固定至少72 h后,在0.5 mol/L盐酸和0.1%戊二醛中脱钙7 d,石蜡固定包埋,连续切片(5 μm)。用Safranin O和Fast Green分别染色,并使用OARSI评分进行评估。
1.4 免疫组化检测ZNF400表达 石蜡切片在二甲苯中脱蜡后,梯度酒精中复水。用1% H2O2阻断内源性过氧化氢5 min。0.1% BSA孵育30 min,阻断非特异性IgG结合。ZNF400一抗(1∶200)4 ℃孵育过夜。次日,PBS清洗2次,二抗孵育30 min,显色后封片。
1.5 软骨细胞的分离与培养 取对照组患者适量关节软骨组织,两步酶法消化后传代培养:无菌培养皿中PBS缓冲液冲洗软骨组织数次后将其剪碎;胰蛋白酶(0.25%)充分消化后恒温震荡40 min孵育,1000 r/min离心后弃上清。加入含有10%胎牛血清的DMEM培养基悬浮原代软骨细胞,调整密度为108/L并接种于培养瓶,37 ℃,5% CO2恒温培养箱培养。留取第2代、第3代细胞进行实验。
1.6 细胞实验分组与处理 将正常人软骨细胞消化、重悬、计数、铺六孔板,细胞密度为1×105个细胞/mL。建立无IL-1β刺激组(IL-1β-组)和有IL-1β刺激组(IL-1β+组),IL-1β+组给予人软骨细胞重组人IL-1β(10 ng/mL)刺激18 h(模拟OA表型),IL-1β-组仅给予等量PBS处理。
1.7 ZNF440过表达质粒转染人软骨细胞 按照说明书,用携带对照-绿色荧光蛋白(CTL-GFP)或ZNF440-GFP过表达质粒的慢病毒转染IL-1β+组和IL-1β-组细胞,分别建立CTL-GFP(对照)组和ZNF440-GFP组。方法如下:重悬软骨细胞(1×105个细胞/mL)并用慢病毒(MOI 2.5)转染,将细胞转移到6孔板中,培养24 h。3 d后用2 mL含嘌呤霉素(0.5 μg/mL)的完全培养基替换原培养基,并将细胞培养至融合,转染CTL-GFP或ZNF440-GFP。使用EVOS FL成像系统对GFP信号进行可视化分析。收集转染GFP的软骨细胞,流式细胞仪检测GFP转染的阳性率,推算慢病毒感染效率。
1.8 流式细胞术检测细胞凋亡 采用7-AAD PE Annexin V凋亡检测试剂盒,检测人软骨细胞凋亡和细胞死亡。软骨细胞(2×105细胞/孔)用0.05%胰蛋白酶消化,PBS洗涤2次。将细胞用细胞染色缓冲液重悬后,与PE Annexin V/7-AAD在室温黑暗下孵育30 min,加入400 μL结合缓冲液。数据在FACSCanto Ⅱ(BD)上获得,并用FlowJo进行分析。
1.9 siRNA细胞转染 IL-1β+组和IL-1β-组细胞均使用Lipofectamine RNAiMAX转染试剂(10 nmol/L)在含有10%胎牛血清和1%青霉素/链霉素的DMEM培养基中转染ZNF440-siRNA或阴性对照(NC)-siRNA(50 nmol/L)48 h,分别建立ZNF440-siRNA组和NC-siRNA组。
1.10 RNA提取和定量实时PCR(qRT-PCR)检测炎症、合成分解代谢和凋亡相关标志物的表达 使用TRIZOL一步法提取软骨或体外培养的软骨细胞中分离总RNA,然后使用RNeasy Mini kits (Qiagen)进行纯化。检测RNA的纯度及浓度后,采用一步RT-PCR试剂盒配制反应体系进行qRT-PCR扩增。反应试剂配制:5X QIAGEN一步RT-PCR缓冲液10 μL、dNTP 混合物2 μL、QIAGEN一步RT-PCR酶混合物2 μL、上下游引物各1 μL、RNA 1 μg和无酶水补足20 μL。反应条件:逆转录50 ℃ 30 min、预变性95 ℃ 15 min,变性94 ℃ 30 s,退火56 ℃ 60 s,延伸72 ℃ 60 s,变性、退火、延伸设置40个循环,终延伸72 ℃ 10 min。每个样品设置3个重复。所有引物都是用Primer3Plus(http:// primer3plus.com)设计的。各RNA的表达以GAPDH进行标准化处理,用2-ΔΔCt法计算PCR产物的相对表达量。引物序列,见表2。

表2 实时荧光定量PCR引物基因序列Table 2 Real-time fluorescence quantitative PCR primer gene sequence
1.11 Western blotting(WB)检测聚腺苷二磷酸核糖聚合酶(PARP)p85 和ZNF440蛋白表达 收集细胞,加入RIPA蛋白裂解液,冰上裂解,获得细胞总蛋白。BCA法检测蛋白浓度。SDS-PAGE凝胶电泳分离蛋白,电湿转将蛋白转移至PVDF膜上。5%脱脂牛奶室温孵育1 h,用兔多克隆IgG一抗:PARP p85 (1∶500),ZNF440 (1∶3000)或β-actin(1∶1000)抗体,孵育过夜,然后与二抗(1∶10000)在5%脱脂牛奶-TBS中在4 ℃下孵育1.5 h。采用ECL化学发光法显示蛋白条带,Image-Pro Plus 6.0进行灰度分析。
1.12 生物信息学分析 通过文献检索和对Connectivity Map 02 (CMAP)基因表达数据的分析,确定有可能下调ZNF440表达的化合物[9]。对CMAP数据进行处理,以确定CMAP中单个化合物引起的ZNF440表达的倍数变化:在单个化合物的所有实例中计算平均倍数变化,选出了能使ZNF440平均表达量减少至少1.5倍的化合物,其中包括Scriptaid,进行化合物验证,在给予IL-1β+组和IL-1β-组细胞Scriptaid(0~10,000 nmol/L)处理72 h。建立IL-1β+Scriptaid(1000 nmol/L)组、ZNF440-GFP+Scriptaid(1000 nmol/L)组和对照组,方法同上,对照组仅给予等量二甲基亚砜(DMSO)处理。

2 结果
2.1 膝关节软骨组织番红O-固绿染色 番红O-固绿染色显示,对照组膝关节软骨表面光滑,着色均匀;而Knee OA组软骨严重退化,表现为组织淡染,伴有裂隙和变薄,软骨细胞数量减少,排列紊乱,见图1。

图1 膝关节软骨组织番红O-固绿染色(100×)Figure 1 Knee cartilage tissue stained with safranin O-fast green
2.2 ZNF440在膝关节OA软骨中的表达 采用免疫组化和WB检测OA软骨组织中ZNF440的表达。Knee OA组软骨组织中表达ZNF440的阳性细胞数量较对照组显著增加(P<0.05)(见图2A);WB进一步显示,Knee OA组软骨组织ZNF440蛋白表达明显高于对照组(P<0.05),见图2B。
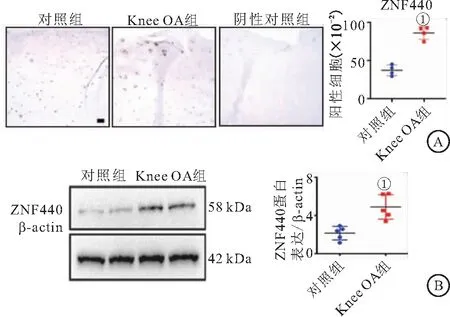
图2 ZNF440在Knee OA软骨中的表达Figure 2 Expression of ZNF440 in Knee OA cartilage注:A.免疫组化(100×);B.Western blotting。与对照组相比,①P<0.01。
2.3 ZNF440过表达对Knee OA细胞炎症、软骨分解和合成代谢标志物影响 通过给予IL-1β刺激软骨细胞模拟OA环境,CTL-GFP组和ZNF440-GFP组之间IL-6和MCP1基因表达差异无统计意义(P>0.05);与CTL-GFP组相比,ZNF440-GFP组细胞无论有(+)或无(-)IL-1β刺激,MMP13表达均明显增加,而COL2A1表达显著减少,这些效果在有IL-1β(+)刺激时表现更明显(P<0.01)。见图3。

图3 qPCR检测ZNF440过表达对OA软骨细胞炎症、软骨分解和合成代谢标志物的影响Figure 3 Effect of ZNF440 overexpression on inflammation, chondrolysis and anabolic markers in OA chondrocytes by qPCR注:与CTL-GFP组相比,①P<0.05, ②P<0.01;与无IL-1β刺激的CTL-GFP组相比,③P<0.05,④P<0.01;与有IL-1β刺激的CTL-GFP组相比,⑤P<0.05, ⑥P<0.01。
2.4 ZNF440过表达对Knee OA细胞凋亡的影响 通过流式细胞术检测Knee软骨细胞在ZNF440-GFP过表达质粒转染后的细胞凋亡。与CTL-GFP组相比,ZNF440-GFP组软骨细胞有更大比例的AnnexinV/7-AAD双阳性细胞(P<0.01)。见图4。

图4 流式细胞术检测细胞凋亡Figure 4 Flow cytometry detection of apoptosis注:A.在CTL-或ZNF440-GFP转染后,对Knee OA组Annexin V/7-AAD双阳性细胞进行流式细胞术分析;B.统计阳性细胞占比。与CTL-GFP组相比,①P<0.01。
2.5 siRNA敲除ZNF440对软骨炎症、分解合成代谢和细胞凋亡标志物表达的影响 与无IL-1β刺激组的NC-siRNA相比,有IL-1β刺激组均可诱导MMP13、IL-6、MCP1和PARP p85的表达水平上调(P<0.05)。IL-1β(+)刺激下,ZNF440-siRNA组中MMP13、IL6、MCP1和PARP p85表达均较NC-siRNA显著降低(P<0.05)。然而,无论有或无IL-1β刺激,NC-siRNA组和ZNF440-siRNA组之间COL2A1表达差异均无统计学意义(P>0.05)。见图5。
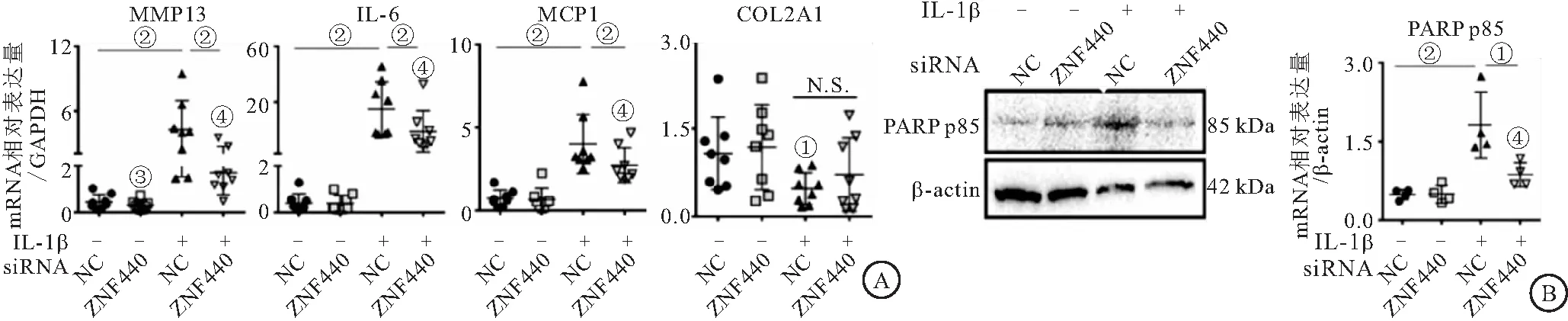
图5 敲除ZNF440在OA软骨细胞中的效果Figure 5 Effect of knockdown of ZNF440 in OA chondrocytes注:A.qPCR评估软骨细胞MMP13、IL6、MCP1和COL2A1的mRNA表达。B.WB检测软骨细胞PARP p85蛋白表达。与NC-siRNA相比,①P<0.05,②P<0.01。与无IL-1β刺激NC-siRNA相比, ③P<0.05;与有IL-1β刺激NC-siRNA相比,④P<0.01。
2.6 Scriptaid处理对OA软骨分解代谢、炎症和细胞凋亡标志物表达的影响 Scriptaid(10~1000 nmol/L)处理以浓度梯度的方式抑制Knee OA软骨细胞ZNF440的表达,并在1000 nmol/L浓度达到最大抑制率(P<0.05)。qPCR结果显示,有IL-1β刺激时,与对照组相比,Scriptaid组MMP13、IL6和MCP1的mRNA表达以及PARP p85的蛋白表达均显著降低(P<0.01)。无IL-1β刺激时,Scriptaid组和对照组以上各基因表达无显著统计学差异(P>0.05)。见图6。
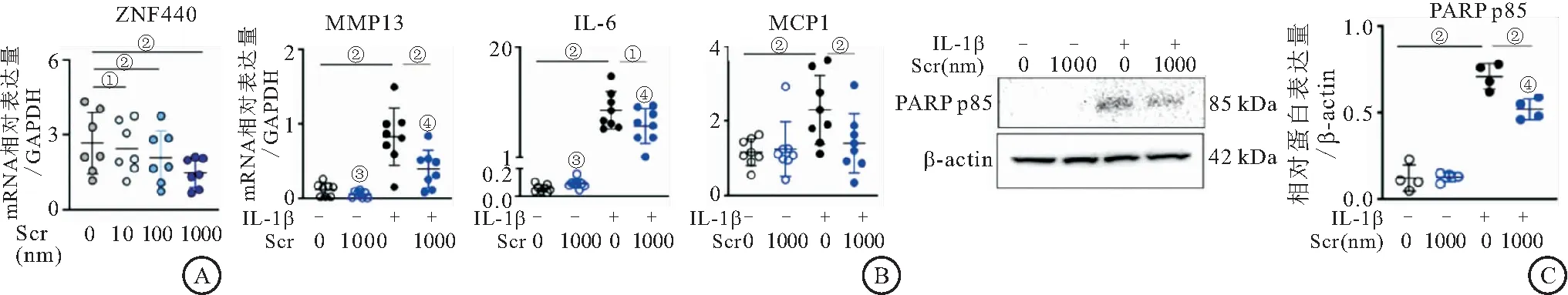
图6 验证可抑制OA软骨细胞ZNF440表达化合物Scriptaid的作用Figure 6 Validation of the inhibition of the expression of the compound Scriptaid by OA chondrocytes ZNF440注:A.Scriptaid对ZNF440在软骨细胞中表达的影响(Scr 0, 10, 100, 1000 nmol/L)。B.qPCR评估软骨细胞中MMP13、IL6和MCP1的mRNA表达。C.WB检测PARP p85蛋白表达。与对照组相比,①P<0.05,②P<0.01;与无IL-1β刺激对照组相比,③P<0.01;与无IL-1β刺激的Scr(1000 nmol/L)组相比,④P<0.01。
2.7 Scriptaid通过靶向降低ZNF440的表达发挥作用 给予Scriptaid组细胞转染ZNF440-GFP过表达质粒,检测Scriptaid是否通过ZNF440影响软骨分解代谢和细胞凋亡标志物表达。结果显示,与ZNF440 GFP组相比,ZNF440-GFP+Scriptaid组MMP13和PARP p85的表达显著降低(P<0.05)。然而,各组间COL2A1的表达差异均无统计学意义(P>0.05)。见图7。
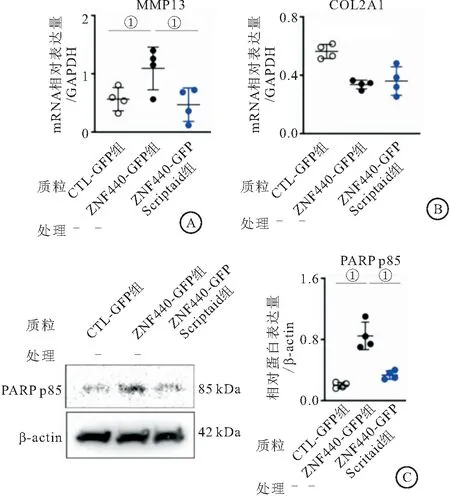
图7 Scriptaid通过直接降低ZNF440表达发挥作用Figure 7 Scriptaid acts by directly reducing the expression of ZNF440注:A、B.qPCR检测Scriptaid对MMP13和COL2A1表达的影响。C.WB检测Scriptaid对PARP p85蛋白表达的影响。与ZNF440 GFP组相比,①P<0.01。
3 讨论
OA是一种累及关节软骨和滑膜关节周围组织的慢性进行性关节恶化疾病,是最常见的退行性关节疾病,严重影响患者的生活质量[10]。OA多累及颈椎、腰椎、手、膝、髋关节等,其中膝关节是最复杂、最脆弱的负重关节[11]。有研究[12-14]发现,软骨细胞相关的有害变化在膝关节OA的发病机制中发挥关键作用。尽管对膝关节OA具有深刻的认识,但临床研究人员仍在努力探索OA发病机制背后的关键原因。本研究发现Scriptaid是一种小分子药物,能够下调人OA软骨细胞中ZNF440的表达,并减少ZNF440诱导的软骨破坏和凋亡。
尽管之前还尚少研究报道ZNF440在软骨变性中的作用,但其他类型的ZNF蛋白已被证明可在软骨变性和形成中发挥重要作用[15-17]。ZNF440是一种在灵长类动物包括人类、黑猩猩和猴子中发现的C2H2型蛋白。研究[6]发现,在中重度脊柱小关节软骨OA患者中,NF440表达增加,而降低ZNF440的表达水平可引起NF-κB-p65磷酸化下调。本研究发现,ZNF440在Knee OA组软骨中的表达显著高于对照组(非退变)软骨,这说明OA可导致ZNF440表达上调。
多种炎症介质在OA发病机制中发挥关键作用,研究[2,18-19]发现,OA期间IL-1β在OA患者的滑膜和软骨组织中普遍高表达,并可刺激MMP-1,MMP-3和MMP-13的释放,诱导IL-6、IL-8、MCP-1和CCL5等趋化因子的产生。本研究结果说明ZNF440在OA的发生发展过程中软骨细胞的损伤和退行性作用起到促进作用,其机制可能与ZNF440促进炎症反应和分解代谢有关。早期研究[20]发现,OA软骨细胞可发生形态学改变,而且凋亡比例高于正常组织,提示骨关节炎软骨细胞凋亡是一种可能的OA病理途径。本研究结果发现,与CTL-GFP转染的软骨细胞相比,ZNF440-GFP转染的Knee OA软骨细胞中PARP p85蛋白表达和Annex-inV/7-AAD双阳性细胞量明显增加。这些结果表明,ZNF440在OA的病理过程中具有促凋亡作用,抑制ZNF440的表达可能有助于延缓OA的发生发展。
在OA的病理过程中,IL-1β诱导产生的蛋白酶能够降解软骨,是OA发生发展的主要驱动因素[21-22],此外,ZNF440的表达在IL-1β刺激下可显著增加[5]。基于此,本研究通过给予IL-1β刺激膝关节软骨细胞建立OA体外模型,结果发现,ZNF440过表达软骨细胞中MMP13、IL6、MCP1、PARP p85表达和Annex-inV/7-AAD阳性细胞数量明显增加,这些效果在IL-1β刺激后表现更明显。然而,敲除ZNF440可显著逆转OA软骨细胞中IL-1β引起的损伤作用。这些结果说明促炎因子IL-1β在ZNF440表达和功能方面发挥重要的促进作用。
鉴于ZNF440可能是与OA相关的分解代谢过程调节器,本研究利用Connectivity Map筛选化合物,通过qPCR验证,并确定了Scriptaid可以减少ZNF440在人膝关节OA软骨细胞中的表达。Scriptaid是一种广谱的组蛋白去乙酰化酶抑制剂(HDACi),主要功能是抑制Ⅱ类(a)HDACs[23]。结果发现,用Scriptaid干预可明显减少ZNF440高表达的人膝关节OA软骨细胞中分解代谢和凋亡标志物的表达。有研究[6]发现ZNF440可部分调控人类关节突软骨细胞中的NF-κB-p65(p-p65)表达,因此,ZNF440可能通过改变p-p65的表达来调节细胞凋亡和炎症标志物的表达。与此相一致,Ji等[24]发现,在小鼠软骨细胞系ATDC5中,IL-1β诱导的细胞凋亡和炎症标志物的表达上调可以通过降低p-p65的水平而减弱。然而,ZNF440在促进炎症和细胞凋亡方面的确切作用需要在未来的研究中进一步阐明。
4 结论
ZNF440在人Knee OA软骨中表达增加,通过调节细胞中炎症、分解代谢和凋亡标志物的表达参与软骨退行性机制。小分子化合物Scriptaid可降低ZNF440的表达,并抑制其在OA软骨细胞中的破坏作用,可能成为临床治疗OA患者的新型药物。

