高温高压下C3H8/C2H4 在空气中的爆炸上限*
陈 昇,宁 也,何 萌,祁 畅,王亚磊,闫兴清,喻健良
(1.中国特种设备检测研究院国家市场监管技术创新中心(炼油化工装备风险防控),北京 100029;2.大连理工大学化工学院,辽宁 大连 116024)
可燃气体在生产、运输及储存等过程中与空气混合遇火源极易发生爆炸。爆炸上限是可燃气体能够发生爆炸的最大体积分数,是评估工艺爆炸风险的重要参数[1-2]。随着工艺的发展,高温、高压、多元可爆介质共存的场合不断出现[3],因而对高温、高压、多元可爆介质爆炸上限的研究需求不断增多。
有些学者通过实验研究了不同温度、压力下可燃混合气体的爆炸上限,发现温度、压力的升高显著提升了可燃气体的爆炸风险[4-9],且不同可燃气体体积分数占比对爆炸上限的影响较明显[10-12]。此外,一些学者提出了可燃气体爆炸上限的预测方法。Cui 等[13]考察了极限火焰温度法预测CH4爆炸上限的准确性,发现随着初始温度的提升,预测值与实验值的偏差增大。Mashuga 等[14]基于绝热火焰温度和勒夏特列定律计算了CH4、C2H4及二者混合物的爆炸上限,发现预测值显著低于实验值。Hu 等[15]通过热力学理论预测了CH4/CO2在氧气中的爆炸上限,但结果偏高。Giurcan 等[16]提出了基于最大爆炸压力和其上升速率预测混合气体爆炸极限的方法,与文献数据对比发现预测结果过低。从现有研究成果看,高温高压下,多元可爆介质的爆炸上限还无法用可靠的预测方法得到,准确数值仍需要通过实验获得。
初始温度和初始压力协同作用对可燃气体爆炸上限影响显著。Qi 等[17]总结了近年来高温高压下可燃气体爆炸极限的实验和预测模型研究进展,认为升高可燃气体的初始温度和初始压力会提升爆炸上限的规律基本一致。Liu 等[18]发现温度、压力协同作用下H2的爆炸上限远高于常温常压下H2的爆炸上限。Yu 等[19]分别测定了高温高压下C2H6和C2H4在氧气中的爆炸上限,认为初始压力超过一定阈值后,爆炸上限的增长率从压敏变为温敏。喻健良等[20]研究了高温和高压对C2H6在氧气中爆炸上限的影响,发现温度和压力对爆炸上限的协同作用大于单一因素,略小于二者单独作用之和。但目前对初始温度、初始压力及二者协同作用下混合气体的爆炸上限还缺乏足够的研究。
C3H8作为一种常见的石油化工原料,在高温高压下可用于裂解制备C2H4[21],二者与空气混合形成可爆介质,存在爆炸风险。基于此,本文中,在自主搭建的高温高压20 L 球形爆炸特性实验装置内,对不同初始温度和初始压力下、不同比例的C3H8/C2H4混合气体爆炸上限展开实验研究,分析温度、压力对C3H8/C2H4混合气体爆炸上限的影响规律,为高温高压工艺流程下的安全生产提供参考依据。
1 实验装置与方法
自行搭建的高温高压气体爆炸特性实验装置如图1 所示,包括20 L 球形爆炸容器、配气系统、点火系统、加热系统、控制及数据采集系统。

图1 高温高压下20 L 球形实验装置Fig.1 20 L spherical experimental device under high temperatures and pressures
实验初始压力范围为0.1~1.5 MPa,温度范围为20~200 ℃。20 L 球形爆炸容器可承温500 ℃,水压试验55 MPa,满足实验要求。球内爆炸压力通过高频动态压力传感器采集,压力测量范围为0~10 MPa,响应频率为100 kHz;通过高温烘箱鼓吹高温气流实现对球体的均匀加热,升温速率不超过2 ℃/min,精确度为0.1 ℃,并通过热电偶实时监控球内温度;通过冷却水循环系统冷却压力传感器。
实验采用常温下分压法配置C3H8、C2H4与空气的混合气体至实验所需的初始压力,精确到0.000 1 MPa。设定C3H8/C2H4混合气体中C2H4的体积分数(φ)分别为0%、25%、50%、75%、100%。采用气体循环泵混合球内气体以保证气体均匀混合,循环5 min 后静置5 min,然后点火。点火方式为镍铬合金电热丝在球心处点火,点火时长2.5 s,点火能量高于100 J。对于高温实验,气体在循环、静置后开始加热,超出实验所需初始压力的气体在加热到实验所需初始温度后通过排气管路排出。
依据爆炸极限测试标准BS EN 1839—2017[22]和GB/T 12474—2008[23],以压力跃升超过5%为发生爆炸的判据,每组实验重复3 次。测得混合气体发生爆炸的最高体积分数和不发生爆炸的最低体积分数,二者取平均值即为混合气体的爆炸上限。以常温常压下C3H8的爆炸上限实验为例,如图2 所示。
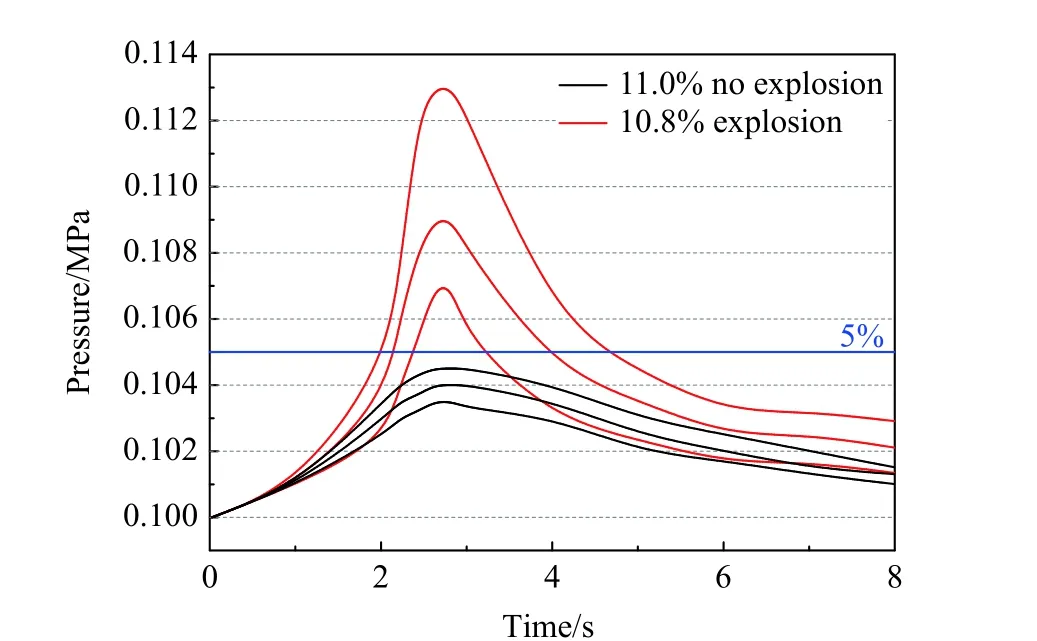
图2 爆炸判定准则Fig.2 Explosion determination method
在上述装置内分别测量了不同初始温度和压力下C3H8、C2H4的爆炸上限,并与参考文献[4]进行对比,如表1 所示。可以看出,采用上述装置得到的测试结果与文献值基本一致,验证了装置的可靠性。

表1 气体爆炸上限Table 1 The upper explosion limits of gases
2 温度和压力分别对爆炸上限的影响
2.1 温度的影响
初始压力0.1 MPa 时,不同初始温度、不同C2H4体积分数 φ 时,C3H8/C2H4混合气体的爆炸上限如图3所示。图3(a)给出了爆炸上限随初始温度的变化,可见C3H8/C2H4混合气体的爆炸上限始终介于相同温度时纯C3H8与纯C2H4的爆炸上限之间。随着初始温度上升,混合气体的爆炸上限呈近线性升高。C2H4体积分数越高,线性升高的趋势越明显;由图3(b)可知,一定初始温度下,随着C2H4体积分数的升高,混合气体爆炸上限呈指数升高,C2H4体积分数越高,上升幅度越大。初始温度的上升会进一步提高混合气体爆炸上限上升的幅度。

图3 高温下不同比例C3H8/C2H4 的爆炸上限Fig.3 The upper explosion limits of C3H8/C2H4 mixtures at high temperatures with different proportions
在可燃气体爆炸过程中,更高的初始温度可以提供更多热量,气体分子和氧分子的运动动能增加,分子间增强的传热提高了化学反应速率。并且,高温促进离解反应,提升了自由基的扩散,其中普遍认为易扩散的H 原子增加会明显加快火焰传播速度(uH)。火焰传播速度可以反映出单位时间内燃烧的可燃混合气体体积分数。当混合物中可燃气体体积分数接近化学计量比时,其燃烧或爆炸反应最为剧烈;若可燃气体体积分数增加至过量,空气不足,火焰传播速度降低至极限值后火焰停止传播,而这个能使火焰传播的可燃气体最高体积分数为其爆炸上限。如图4 所示[24],随着初始温度的升高,火焰传播速度提升,H 原子也会出现明显增加,这对于反应体系中H 原子较少的C2H4等不饱和烃类气体来说至关重要,关键的H+O2的链分支反应得到了强烈满足[25]。根据图5 可知[24],相比于饱和烷烃C3H8,C2H4的燃烧速度更高且受初始温度的影响更大。因此,随着C3H8/C2H4混合气体中C2H4体积分数的增加,整体的火焰传播速度随之提升,初始温度越高,提升的幅度也越大。火焰传播速度的上升促进了爆炸反应的进行,可爆区域扩大,最终导致C3H8/C2H4混合气体的爆炸上限上升。
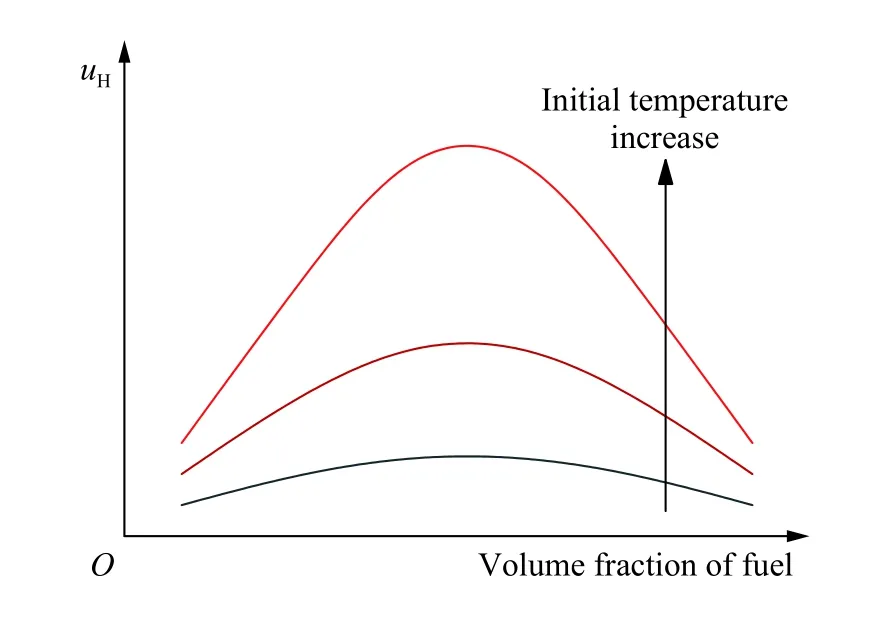
图4 初始温度对火焰传播速度的影响[24]Fig.4 Effect of initial temperature on flame propagation velocity[24]

图5 温度与3 种气体火焰传播速度的关系[24]Fig.5 Relations between temperature and flame propagation velocity of three gases[24]
以初始温度T(℃)、C2H4体积分数 φ 为自变量,混合气体爆炸上限U(C3H8/C2H4)为因变量进行三维非线性曲面拟合,以分析温度、C2H4体积分数对常压下C3H8/C2H4爆炸上限的影响,结果如图6 所示,拟合函数表达式为:

图6 温度、C2H4 体积分数对C3H8/C2H4 爆炸上限的影响Fig.6 Influence of temperature and volume fraction of C2H4 on the upper explosion limits of C3H8/C2H4 mixtures
式中:U0、A01、B01、B02、C1、A1、A2、B1、B2和C2均为拟合参数,取值如表2 所示。

表2 式(1)中的拟合参数Table 2 Dimensionless fitting coefficients of Eq.(1)

表3 式(2)中的拟合参数Table 3 Dimensionless fitting coefficients of Eq.(2)
综上分析可知,高初始温度下,不同C2H4体积分数的C3H8/C2H4混合气体的爆炸上限随着初始温度、C2H4体积分数的升高而升高。在初始温度为20~200 ℃范围内,相比于初始温度对C3H8/C2H4混合气体爆炸上限的影响,C2H4体积分数对爆炸上限的影响更明显。无论初始温度和C2H4体积分数如何变化,C3H8/C2H4混合气体的爆炸上限始终介于20 ℃下C3H8爆炸上限与200 ℃下C2H4爆炸上限之间。
2.2 压力的影响
初始温度为20℃,不同初始压力、不同C2H4体积分数时,C3H8/C2H4混合气体爆炸上限结果如图7所示。图7(a)给出了爆炸上限随初始压力的变化,随着初始压力逐渐上升,可燃气体的爆炸上限也呈上升趋势,而C2H4体积分数高于50%时,混合气体的爆炸上限在0.3 MPa 前上升较快,0.3 MPa 后爆炸上限的升高速度出现了明显的降低,但整体数值仍在不断上升。由图7(b)可以发现,随着C2H4体积分数的增加,混合气体爆炸上限呈指数上升,0.1 MPa 下混合气体爆炸上限上升了25%,而此时初始压力的增加会进一步扩大爆炸上限的上升范围,同时爆炸上限逐渐呈现接近线性升高的趋势。

图7 高压下不同比例C3H8/C2H4 的爆炸上限Fig.7 The upper explosion limits of C3H8/C2H4 mixtures at high pressures with different proportions
Bychkov 等[26]在研究中表明,火焰传播速度与Lewis 压力指数m成正比。其中压力指数m是由uH∝pm的比例关系决定的参数,具体数值由图8 给出。由图8 可知,C3H8、C2H4在各自爆炸上限附近的火焰传播速度不会超过0.5 m/s,那么C3H8/C2H4混合气体在其爆炸上限附近的火焰传播速度不会超过C3H8、C2H4在爆炸上限附近的火焰传播速度,即也低于0.5 m/s。此时压力指数m<0,所以火焰传播速度uH随着初始压力的上升而有所下降,并且随着C2H4体积分数的增加,下降幅度会更明显。但与此同时,单位体积内初始压力升高,混合气体中的可燃气体分子和氧分子数量增多、距离缩短,这也使得二者的碰撞更加容易且快速,使得C3H8/C2H4混合气体的爆炸反应更容易进行,其爆炸上限出现上升。因此,C2H4体积分数高时,随着初始压力上升,C3H8/C2H4混合气体爆炸上限虽然仍在逐渐上升,但上升速率会逐渐缓慢。
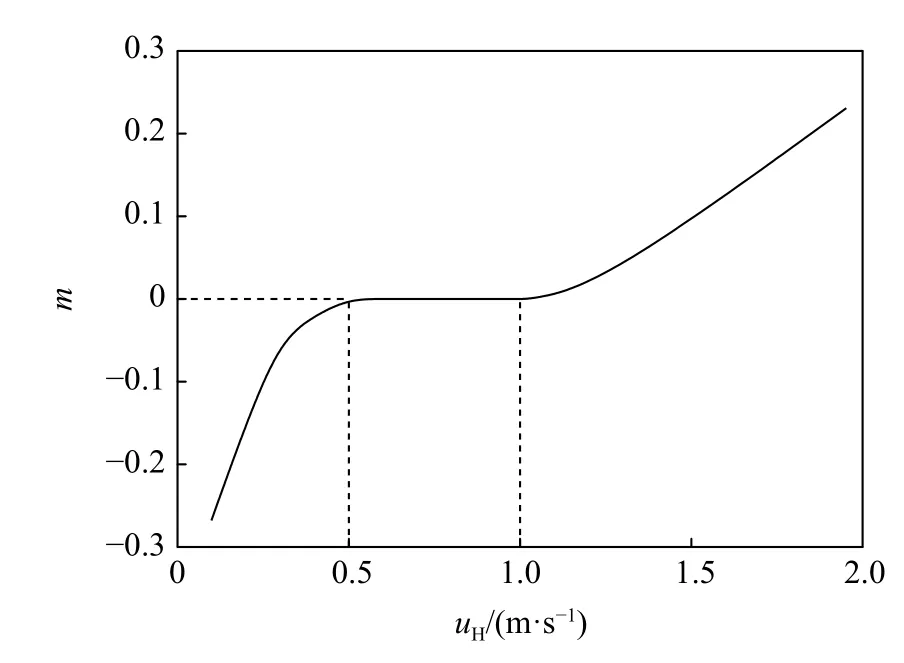
图8 压力对火焰传播速度的影响Fig.8 Effect of initial pressure on flame propagation velocity
实验发现,随着C2H4体积分数和初始压力的升高,爆炸压力跃升值越高,爆炸形成的产物越多,存在生成大量碳黑产物造成管路堵塞的可能,如图9 所示。Wang 等[27]研究发现C2H4体积分数的增加可以提升CH4的火焰传播速度、最大爆炸压力及其上升速率。C3H8与CH4均属于饱和烷烃,虽然碳原子数不同,但二者的燃烧性质及火焰传播速度基本相似[28]。结合图5 可知,C2H4的火焰传播速度要高于C3H8,故可以认为C2H4体积分数的增加也可以提升C3H8的火焰传播速度,从而导致混合气体爆炸上限明显变化[29]。初始压力的增加会进一步加剧气体分子之间的碰撞,提升爆炸上限的上升范围,并不会改变爆炸上限原本就上升的这一趋势。

图9 爆炸后生成的大量产物Fig.9 A large number of products formed after explosion
以初始压力p(MPa)、C2H4体积分数 φ 为自变量,混合气体爆炸上限U(C3H8/C2H4)为因变量进行三维非线性曲面拟合,以综合分析压力、C2H4体积分数对常温下混合气体爆炸上限的影响,结果如图10 所示,拟合函数表达式为:

图10 压力、C2H4 体积分数对C3H8/C2H4 爆炸上限的影响Fig.10 Influence of pressure and volume fraction of C2H4 on the upper explosion limits of C3H8/C2H4 mixtures
综上分析可知,高初始压力下,不同C2H4体积分数的C3H8/C2H4混合气体的爆炸上限随着初始压力、C2H4体积分数的增加而增加。在初始压力0.1~1.5 MPa 的范围内,相比于初始压力对C3H8/C2H4混合气体爆炸上限的影响,C2H4体积分数对爆炸上限影响更明显。无论初始压力和C2H4体积分数如何变化,C3H8/C2H4混合气体的爆炸上限始终介于0.1 MPa 下C3H8的爆炸上限与1.5 MPa 下C2H4的爆炸上限之间。
3 温度和压力协同作用对爆炸上限的影响
鉴于高压下易生成大量碳黑产物,因而选择在初始压力为0.1、0.3 和0.5 MPa,初始温度20、80、140 和200 ℃的实验工况下对C3H8/C2H4混合气体爆炸上限进行实验研究,以探究初始温度和初始压力的协同作用对混合气体爆炸上限的影响规律。
不同实验工况下,混合气体爆炸上限的上升值如图11 所示。初始压力为0.1 MPa 时,初始温度从20 ℃升至200 ℃后,C3H8爆炸上限提升了1.2%,C2H4爆炸上限提升了8.2%,C2H4体积分数为25%、50%和75%时,混合气体爆炸上限分别提升2.7%、3.8%和7.5%,如图中曲线1所示;在初始温度为20 ℃时初始压力从0.1 MPa升至0.5 MPa 后,C3H8和C2H4的爆炸上限分别提升4.8% 和13.0%,C2H4体积分数为25%、50% 和75% 时,混合气体爆炸上限分别提升6.2%、8.6%和11.5%,如图中曲线2 所示;相较于初始温度20 ℃、初始压力0.1 MPa 的实验工况,200 ℃、0.5 MPa 下C3H8爆炸上限提升了10.8%,C2H4爆炸上限提升了22.9%,C2H4体积分数为25%、50%和75%时,混合气体爆炸上限分别提升13.1%、17.8%和21.0%,如图中曲线4 所示。温度、压力单独作用下爆炸上限的上升值之和如图中曲线3 所示,可以看出,温度、压力协同作用下,爆炸上限的上升值高于二者单独作用下的上升值之和。随着可燃气体中C2H4体积分数逐渐接近100%,二者差值也逐渐缩小。
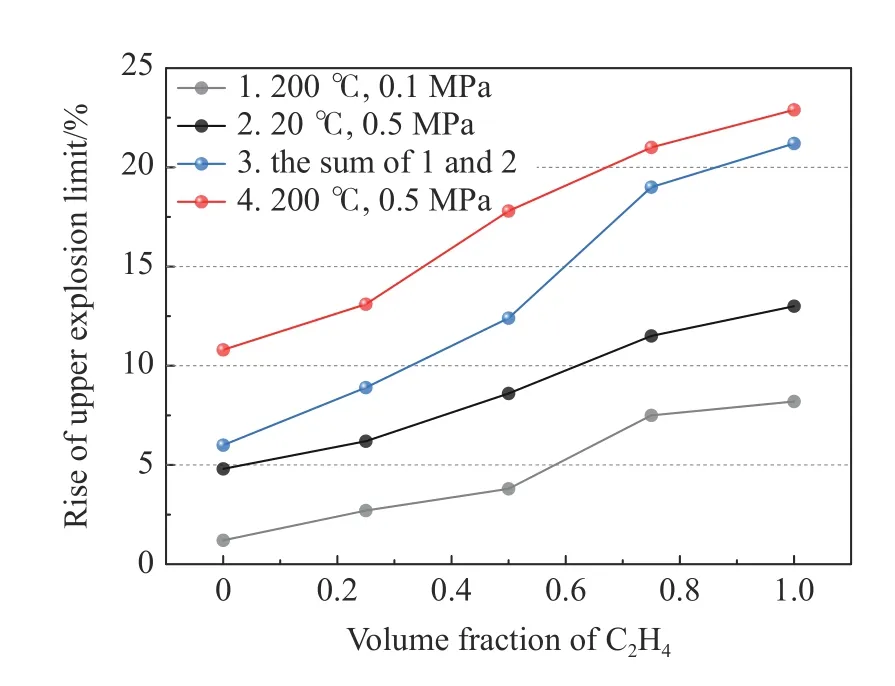
图11 高温高压下C3H8/C2H4 爆炸上限提升幅度Fig.11 Increase in the upper explosion limit of C3H8/C2H4 at high temperature and pressure
以初始温度T(℃)、初始压力p(MPa)为自变量,混合气体爆炸上限为因变量,进行三维非线性曲面拟合,初始温度为x轴,初始压力为y轴,爆炸上限为z轴,以进一步综合分析温度、压力二者协同作用对混合气体爆炸上限的影响,如图12 所示。为了提高拟合精度,单独拟合C2H4体积分数 φ =0(即纯丙烷)时的函数关系,拟合函数表达式为:
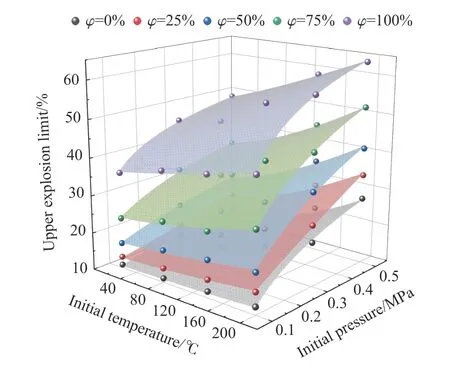
图12 温度、压力协同作用对不同比例C3H8/C2H4爆炸上限的影响Fig.12 Influence of temperature and pressure on the upper explosion limits of C3H8/C2H4 mixtures with different proportions
式中:A、B、C、D、E和F均为拟合参数,取值如表4 所示。

表4 式(3)~(4)中的拟合参数Table 4 Dimensionless fitting coefficients of Eqs.(3)−(4)
综上可知,在温度和压力协同影响下,C3H8/C2H4混合气体爆炸上限的上升值大于二者单一作用下爆炸上限的上升值之和,即初始温度和初始压力协同作用下对爆炸上限的影响要远大于二者单独作用的影响。同时,高温、高压协同作用下,C3H8/C2H4混合气体具有更高的爆炸风险,且随着混合气体中C2H4体积分数的增大,爆炸风险进一步增大。
4 结 论
通过自行搭建的高温高压爆炸特性测试装置,研究了初始温度20~200 ℃、初始压力0.1~1.5 MPa下C3H8/C2H4混合气体的爆炸上限,得出如下结论。
(1) 随着初始温度的升高,C3H8/C2H4混合气体爆炸上限呈线性上升趋势;随着初始压力的升高,C3H8/C2H4混合气体爆炸上限也逐渐上升,但C2H4体积分数高于50%,初始压力大于0.3 MPa 时,爆炸上限上升速度出现了明显降低。无论初始温度或初始压力如何变化,C3H8/C2H4混合气体的爆炸上限始终介于20 ℃或0.1 MPa 下C3H8爆炸上限与200 ℃或1.5 MPa 下C2H4爆炸上限之间。
(2) 无论初始温度或初始压力如何变化,随着C2H4体积分数的增大,混合气体的爆炸上限升高,且逐渐接近该初始温度或初始压力下C2H4的爆炸上限。高温与高压下的区别在于,随着C2H4体积分数的增加,高温下混合气体爆炸上限始终呈指数升高;高压下混合气体爆炸上限先是呈指数升高,后随着压力上升而接近线性升高趋势。在初始温度20~200 ℃或初始压力0.1~1.5 MPa 范围内,相比于温度或压力对C3H8/C2H4混合气体的爆炸上限的影响,C2H4体积分数对爆炸上限影响更明显。
(3) 通过非线性曲面拟合获得混合气体中不同C2H4体积分数下初始温度-爆炸上限、初始压力-爆炸上限、初始温度-初始压力-爆炸上限相应的函数关系。综合分析初始温度和初始压力协同作用对混合气体爆炸上限的影响,发现二者协同作用对爆炸上限的影响远比单一因素的影响更严重,说明高温、高压协同作用下混合气体存在更高的风险,并且随着C2H4的增加爆炸风险更高。

