《日本药局方》药包材标准概况及对我国药包材标准建设的启示*
陆维怡,杨美成,蔡荣,陈蕾
(1.上海市食品药品包装材料测试所,上海 201203;2.国家药典委员会,北京 100061)
药品包装材料和容器是药品上市流通的载体,其质量优劣对于药品质量的重要性毋庸置疑。随着药品监管模式的改变,在落实企业主体责任的同时,积极鼓励行业创新和发展。以药品质量为核心,药包材生产企业与药品生产企业的合作正在不断深入[1]。从《中华人民共和国药典》(简称《中国药典》)(2015年版)开始,我国已开启药包材标准的建设, 《中国药典》(2020年版)已收入部分药包材通用技术要求以及应用比较广泛、较成熟的16个通用检测方法,并不断探索药包材标准的进一步完善提高[2-5]。目前《中国药典》(2025年版)正在编制,其时也正是贯彻落实《中华人民共和国国民经济和社会发展第十四个五年规划和2035年远景目标纲要》《“十四五”国家药品安全及促进高质量发展规划》的重要契机。如何进一步完善我国药包材标准建设,满足各方需求,显得尤为迫切。本文通过对《日本药局方》中药包材内容的研究和思考,提出我国药典药包材标准制定工作中可借鉴之处。
1 《日本药局方》概述
《日本药局方》[6]是由日本厚生劳动省药品和医疗器械局编撰出版的日本药品标准(Japanese Pharmaceutical,JP,也称《日本药典》)。自1886年出版以来(1886年6月25号颁布第一版JP1版),根据《医药品医疗仪等法规》第41条第2项的规定,至少每10年修订一次。自JP9版起,每5年更新一次。自JP12版起,为及时反映科学进步和标准国际化要求,再版期间出版增补本2个。现行版JP18版,于2021年6月7日实施生效,2022年12月发布第一增补本。可查询的《日本药局方》历史版本中,药包材相关内容也经历了不断完善和发展的阶段,统计结果见表1。
JP由凡例、生药通则、制剂通则、通用试验法以及各论、通用信息组成。JP18中药品包装材料和容器相关内容主要分布在通则、测试方法、通用信息中,见表2。
2 JP(18版)包材部分介绍
2.1制剂包装通则 包含制剂包装的原则以及制剂和包装适用性要求。制剂包装的原则强调了在制剂开发阶段对包装充分评估的重要性,结合制剂特性开展评估,设定产品质量控制的项目,如最终产品的标准、试验方法,生产过程中的控制试验以及用于制剂包装的材料的评价,并通过制剂的稳定性试验最终确认该包装适用于制剂。
包装的适用性主要从包装的保护性、相容性、安全性、功能性四个方面进行评估。包装变更后需再次评估。
对于注射剂包装设计的适用性评估,按照7.01注射剂用玻璃容器试验法、7.02塑料容器试验法、7.03输液用橡胶密封件试验法、容器密封完整性测试、光稳定性测试、制剂各论相应要求等进行考察。
2.2容器和包装材料试验法 包装材料包含玻璃、塑料、橡胶3种材质,重点是注射剂用包装。试验法内容除了测试项目和方法,还包含了产品要求,采用了产品通则形式。此外在下列各部分均强调了所列项目的非强制性及对保证药品质量的非充分性、关注药包材与药品相容性的研究,这也是JP中很重要的一个内容。
2.2.1注射剂用玻璃容器试验法(7.01) 概述注射用玻璃容器不能与内容物发生相互作用影响药品的质量,通过适宜的密封方式避免药品被微生物污染,内表面处理过的水性注射液用玻璃容器的耐水性要求。列举质量控制项目有:容器外观,可溶性碱试验,避光容器的可溶性铁试验和透光率试验。重点介绍了可溶性碱即耐水性试验的2个方法,可以根据容器的类型或药物的剂型进行选择。对于熔封容器或不熔封但容量不超过100 mL的输液容器,可采用颗粒法;对于不熔封且容量超过100 mL的容器,采用内表面耐水性方法。

表1 《日本药局方》中药包材相关内容

表2 《日本药局方》18版中药包材内容
2.2.2塑料容器试验法(7.02) 主要分为2个部分,第一部分是测试方法,列举了材料灰化试验:炽灼残渣、重金属、铅、镉、锡;溶出物试验项目:泡沫试验、pH值、易氧化物、紫外吸收度、不挥发物;不溶性微粒;透明度;水蒸气透过量(模拟液体制剂及固体制剂两种方法);泄漏试验;细胞毒性。第二部分分别对水性注射液用聚乙烯或聚丙烯容器、水性注射液用聚氯乙烯容器和其他水性注射剂用塑料容器需进行的测试项目进一步明确。见表3。
2.2.3输液用橡胶密封件试验法(7.03) 明确橡胶产品指容量为≥100 mL输液容器用橡胶密封件(包含涂覆或层压有塑料等材质的材料)。要求密封件不得与药品发生相互作用影响药品质量,密封后能防止微生物污染。列举测试项目包括材料测试:镉、铅;溶出物试验项目:性状、pH、锌、易氧化物、紫外吸收度、不挥发物;生物安全性能:细胞毒性、急性全身毒性。
2.3通用信息部分对药品包装材料和容器的要求 通用信息有G0和G7两个部分,G0为药品包装的基本要求及术语,G7有5个章节,包括固体泡罩的水蒸气透过量测定方法,玻璃、塑料、橡胶材料要求,以及新增的无菌药品包装密封完整性评估和泄漏测试章节。
2.3.1药品包装的基本要求及术语(G0-5-170) 除术语部分外,此章节根据制剂包装通则(2)中“开展适用性评估”的要求,进一步展开阐述。主要内容包括:设计阶段应从包装材料的安全性、与内容物的相容性、包装的保护性、容器完整性(防止微生物污染)、包装的功能性评估,根据适用性评估所用的试验方法和(或)评价技术,建立保证包装适用性的必要和充分的质量控制项目;为保证药品质量,在包装开发和生产阶段,通过适当的变更控制、稳定性监测以确认包装的适用性。根据评估建立质量控制项目,对包装适用性进行必要和充分的控制。此外本章节列举了固体口服剂型包装、注射剂容器、容器封闭系统中金属杂质、避光包装等适用性评估需关注内容。
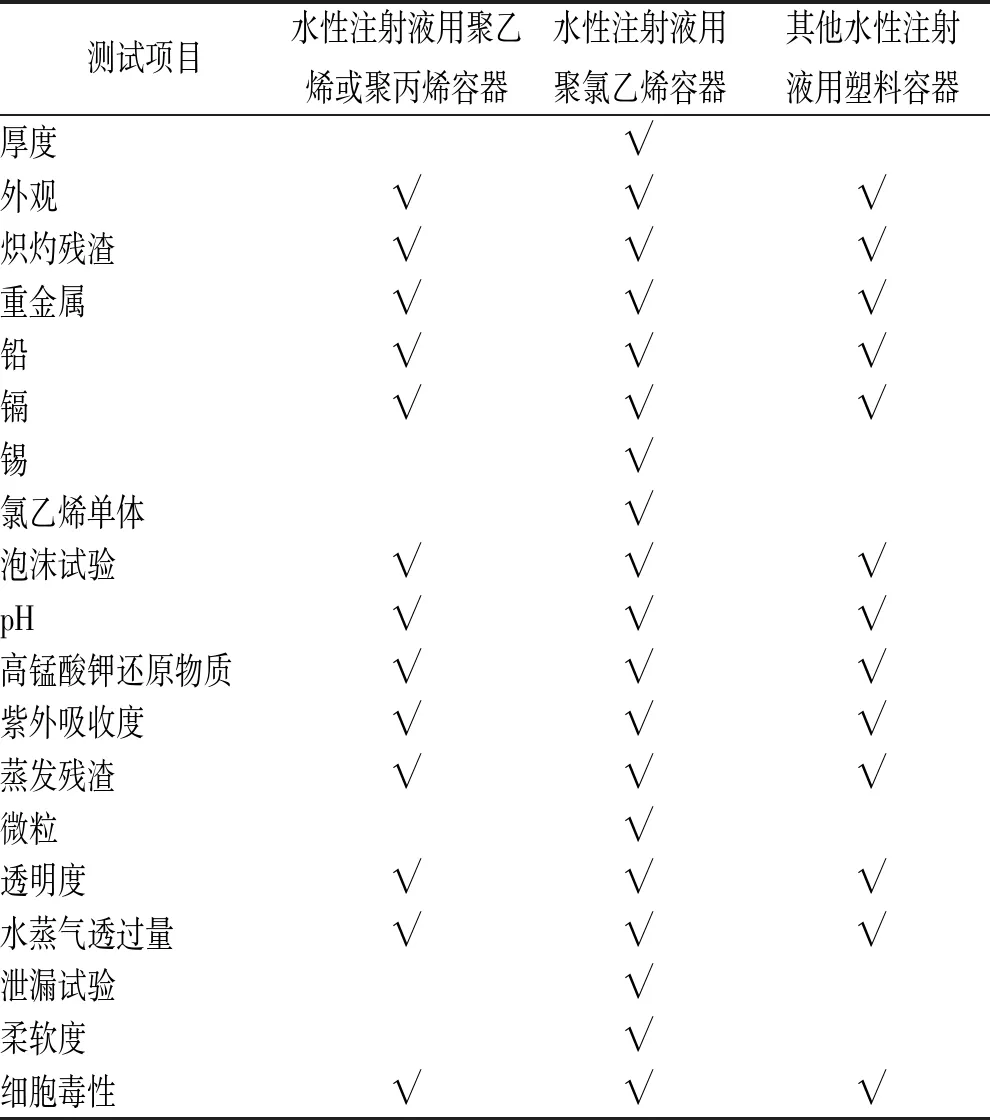
表3 《日本药局方》18版中不同材质塑料容器测试项目
2.3.2医药产品用玻璃容器(G7-1-171) 阐述玻璃容器的基本信息和制剂设计阶段药品玻璃容器的质量评价要求。基本信息包括玻璃的材质构成,药用玻璃容器内表面处理方式。制剂设计阶段药品玻璃容器的质量评价包括玻璃容器与药品的相容性研究;根据制剂特点,选择适宜的组件满足药品对密封性能的要求;有色玻璃容器透光率的考察;无菌产品玻璃包装的耐灭菌性能;注射用药品用玻璃容器的异物(脱片、碎屑等)。根据这些评价原则列举了口服固体制剂的玻璃瓶和注射用安瓿或管制瓶需设立的控制项目。
2.3.3药用塑料容器和输液容器用橡胶密封件的基本要求(G7-2-162) 明确不得使用结构未知的回收塑料材料;根据制剂对光、水分、氧气敏感程度,考虑塑料产品遮光性、氧气透过性、水蒸气透过性等性能指标是否满足要求。塑料包装材料容器须具备与其用途相适应的硬度、柔韧性、耐冲击性、拉伸强度、撕裂强度、弯曲度、耐热性等物理性能等。对于需要目视检测是否有异物或浑浊的药品,容器需要具备一定的透明度。
输液用橡胶密封件不得使用可能引起过敏的天然橡胶或未知材料组分的再生材料。橡胶密封件,应具备密封性、穿刺保持性、柔韧度(防落屑性)、穿刺后的自密封性等物理性能。本章节还根据塑料和橡胶材料的特点,提出在设计阶段需对容器进行毒性评价,并建议参考相关医疗器械和材料的评价方法进行。
2.3.4固体制剂吸塑包装的水蒸汽渗透试验(G7-3-171) 介绍以PTP为代表的吸塑包装水蒸气渗透测定方法,包括样品制备、设备要求、试验条件、测试方法、结果计算等。说明该方法可用于开发阶段对塑料材料、厚度、成型条件等进行筛选,也可用于在开发或生产阶段发生材料及工艺的变更后,比较变更前后泡罩水蒸气渗透结果的差异。列举了影响水蒸气渗透结果的因素包括成型材料的材质、厚度,泡罩成泡的方法和条件,泡罩的大小和壁厚均匀性,泡罩的储存条件。
2.3.5无菌制剂包装密封完整性评估和泄漏测试(G7-4-180、G7-5-180) 密封完整性评价是JP(18版)新增内容,分为G7-4-180无菌药品包装完整性评价和G7-5-180无菌药品包装泄漏试验。前者主要介绍完整性、泄漏测试等基本概念和术语;将泄漏试验分为定性泄漏试验和定量泄漏试验,并列举了4种定性试验方法和7种定量试验方法;介绍密封质量和微生物挑战试验;包装密封完整性测试和评估涵盖制剂开发和制造过程(设计阶段、制造阶段、稳定性监测阶段);测试方法选择原则以及方法验证的概述。后者是对定性及定量方法的进一步展开,JP参考信息中这两节的内容也参考了《美国药典》相关内容。
从上述分析可知,JP(18版)主要采用通则收录不同材质药包材的质量控制,虽然与《美国药典》和《欧洲药典》相比,通则涉及的具体材料种类较少;也没有材料提取、迁移等研究指南,但是质量控制从总述到分述整体有比较清晰的脉络:制剂包装通则总体阐述制剂包装需评估的基本原则以及开展评估的4个方面(保护性、相容性、安全性、功能性);通用信息部分结合材料特点和用途对玻璃、塑料、橡胶进一步提出评估的要求;在测试方法部分对玻璃、塑料、橡胶3类包材质量控制设立了具体测试方法和控制指标。此外无菌产品密封性评价、泡罩透湿方法、包装基本要求和术语作为旁支构成《日本药局方》包材质量控制内容。
JP(18版)药包材质量控制体现了几个特点:一是强调对药包材进行评估的重要性,通过评估设立质量控制项目;二是强调评估的覆盖范围,从制剂研发阶段开始,到稳定性考察以及包材变更;三是包材质量控制关注点与制剂特点密切相关;四是关注无菌产品包装完整性评价。
3 启示
结合我国目前药品监管模式以及药包材行业发展的现状,从药典标准的视角,构建我国药包材标准体系过程中,可从以下几个思维角度进行思考以获得借鉴。
3.1推动科学监管
3.1.1药包材标准从药品全生命周期的角度,考虑药包材的质量控制 JP(18版)多个章节均提及在制剂研发中考虑包装材料和容器的设计、选择、稳定性考察阶段以及变更后的评价。同时通则的检测项目也不局限于仅仅针对终端药包材的考察,而是从设计阶段开始就可以采用的质量控制手段,如7.02塑料容器试验法中就明确“塑料容器的试验方法可用于设计和保证塑料容器的质量”。
3.1.2药包材质量控制要求与包装制剂的特点密切联系 在JP玻璃产品通则中,与口服玻璃容器比较,注射用玻璃容器的评价和控制增加“对耐灭菌和脱片碎屑等异物控制”,这也体现了质量控制从风险出发的理念,在我国标准建设中也可借鉴其不同风险制剂所用的药包材质量控制各有侧重的理念,使药包材质量控制更加科学合理。
3.2夯实企业责任
3.2.1以药品质量为核心,标准中体现药包材在选择、使用、变更等环节均需开展质量评估的要求 在JP的3类产品通则中,都强调了需从安全性、相容性、保护性、功能性等多个角度去评估包装材料和容器的适用性。目前我国无论从药品上市许可持有人制度还是药包材的备案管理方式来看,都是以药品质量为核心,在这个前提下,药品生产企业对包材的选择和评估是保证药品质量的前提。因此药包材标准仅仅只体现包材本身的质量控制已不能满足要求,有必要围绕药品所需体现相应的评估要求。
3.2.2标准应涵盖对包装系统密封性评价的要求 药品包装系统密封性对保证药品尤其是无菌制剂在生命周期的质量有重要作用。在欧美国家经过多年的研究积累,对药品包装系统密封性的考察已形成了一套比较完整的体系,尤其是《美国药典》[7-10]。JP(18版)也新增了无菌产品包装完整性概述,以及泄漏测试的内容。随着对药品包装与药品质量认识的不断深入,从药品安全出发,开展密封性评价既是和国际标准的接轨,更是企业保证药品质量的需要。目前《中国药典》(2025年版)药包材标准建设中,已充分认识到密封性研究对药品质量的重要性,现阶段已开展相关标准的起草工作,发布了《药品包装系统密封性研究指导原则》征求意见稿[11],可为行业开展密封性评价提供技术支持。
3.3服务产业发展
3.3.1采用通则的形式收载对药包材进行质量控制,强化《中国药典》药包材标准对药品质量控制的导向作用 在JP(18版)塑料通则中明确说明所列的方法和技术要求并不是所有的塑料产品均需开展并符合要求,对不同的产品以及不同的质量控制阶段,必要时需考虑对补充标准所列之外的项目进行测试。体现通则标准的科学性,对药包材质量控制需结合产品具体情况开展。随着我国药包材行业水平的不断提升,创新产品的不断涌现,《中国药典》药包材标准以通则形式收录,可以具有更好的灵活性,结合不同制剂的风险程度,在检测项目和限量设置方面,既保障药品安全的底线,对一些非关键项目可以由企业双方协商质量标准,又能更好发挥企业质量控制的主动性。企业必须对产品及标准都有准确的认识和理解才可对产品进行合理的控制,也有助于进一步落实企业主体责任。
3.3.2推进与国际标准的协调 JP(18版)玻璃材质通则中,对玻璃材质分类引用了《美国药典》和《欧洲药典》分类的内容;在对元素杂质的控制中,凡例中增加了基于 ICH Q3D“元素杂质指南”的元素杂质条款。并对“2.66 元素杂质测定”章节进行了相应的修订;新增的密封性评价章节也参考了《美国药典》的相关要求等。在全球经济一体化的大背景下,我国药包材的质量标准也应不断推进和国际标准及规范的协调,助力我国药品进入全球药品供应链,促进医药经济高质量发展[12]。
《中国药典》2025年版包材标准的制订工作是我国包材标准体系建设完善的重要契机,发挥自身优势,借鉴他人长处,才能更好适应药品生产企业对包装质量的需求,充分发挥药包材标准在推动产业高质量发展中的重要作用[13]。

