彩超在乳腺癌新辅助化疗腋窝淋巴结疗效的评估与预测中的应用价值研究
杨理雯,曹跃龙,丁以芹(江苏省太湖干部疗养院(江苏省太湖康复医院),江苏 无锡 214000)
乳腺癌是一种临床常见恶性肿瘤,患者多伴有乳头溢液、乳房肿块等症状,在发病早期癌细胞极易发生全身性转移,其中腋窝是最容易发生转移的部位[1]。有研究表明,乳腺癌患者发生腋窝淋巴结转移后,临床症状无特异性,但会严重影响患者预后[2]。新辅助化疗是目前临床治疗乳腺癌的常用方法,可有效抑制癌细胞生长、浸润,最终达到延长患者生存期的目的[3]。在乳腺癌患者新辅助化疗过程中及早对治疗效果作出评价与预测,有助于医生及早根据个体差异性调整治疗方案,最大限度地提高患者存活率。彩超是临床诊断乳腺疾病的常用影像学技术,具有使用方便、无痛苦、无创伤、价格低廉等优点,可以提供腋窝淋巴结皮质厚度、边界清晰度、纵横比改变、病灶大小、形态等信息,辅助医生判断淋巴结转移情况[4-5]。基于此,为探究彩超在乳腺癌新辅助化疗腋窝淋巴结疗效的评估与预测中的应用价值,本文选定于2020年1月-2022年1月在江苏省太湖干部疗养院超声科接受新辅助化疗治疗的108例乳腺癌患者作为研究对象,具体内容报道如下。
1 资料与方法
1.1 一般资料 选定于2020年1月-2022年1月在江苏省太湖干部疗养院超声科接受新辅助化疗治疗的108例乳腺癌患者,根据新辅助化疗后腋窝淋巴结有无残留分组,将70例病理完全缓解(pCR)患者设为观察组,将38例非完全缓解(non-PCR)患者设为对比组(注:①pCR:完全缓解(CR):病灶彻底消失,且≥4周。部分缓解(PR):病灶缩小>50%,且≥4周。②non-PCR:疾病稳定(SD):病灶缩小25%-50%,未发现新生的肿瘤病灶。疾病进展(PD):病灶增大或者缩小<25%,甚至出现新的肿瘤病灶[7])。观察组:均为女性;年龄在28-60岁,平均(44.26±5.04)岁;病灶部位:40例单侧、30例双侧;病灶直径在1.2-4.6cm,平均(2.94±0.55)cm;TNM分期:37例II期、33例III期;病理分型:8例浸润性小叶癌、22例导管内癌、40例浸润性导管癌;分化程度:20例低分化、28例中分化、22例高分化;体质量指数(BMI)在21-29kg/m2,平均(25.11±1.54)kg/m2。对比组:均为女性;年龄在28-60岁,平均(44.26±5.04)岁;病灶部位:25例单侧、13例双侧;病灶直径在1.2-4.6cm,平均(2.94±0.55)cm;TNM分期:22例II期、16例III期;病理分型:5例浸润性小叶癌、15例导管内癌、18例浸润性导管癌;分化程度:6例低分化、24例中分化、8例高分化;体质量指数(BMI)在21-29kg/m2,平均(25.11±1.54)kg/m2。两组相比差异不显著,P>0.05,可比较。医院伦理委员会已审批。
纳入标准:①均满足《中国抗癌协会乳腺癌诊治指南与规范(2019年版)》[6]中的“乳腺癌”诊断标准,均存在不同程度乳头溢液、腋下结节、乳腺包块等症状。②年龄>18周岁。③临床资料完整、齐全。④生命体征平稳、神志清楚,可配合医生完成本研究。⑤患者及家属均知情本研究,自愿参与并签署同意书。排除标准:①合并全身严重感染性疾病者。②合并血液、免疫系统疾病者。③合并淋巴瘤等其他肿瘤疾病者。④妊娠期、哺乳期女性。⑤合并其他部位淋巴结转移者。⑥合并双相情感障碍、狂躁症等精神系统疾病者。⑦淋巴结坏死液体过深者。⑧同期参与其他研究者。⑨复发转移性乳腺癌者。
1.2 方法 ①新辅助化疗:第1天,给予75mg/m2多西他赛、50mg/m2多柔比星、500mg/m2环磷酰胺,静脉输注,1周期为21d,共计治疗6周期。②彩超检查:采用彩色超声诊断仪(型号:Voluson 730 Pro;生产企业:GE Medical Systems Kretztechnik GmbH &Co.OHG)检查,选择L12-3高频探头,12MHz探头频率,指导患者采取仰卧位,双臂上举,充分暴露双侧腋窝,扫描肿大淋巴结,观察淋巴结边界、回声、大小、形态、血流信号等,测量、记录淋巴结最大直径、血流速度,最终记录值是连续测量3次的平均值。超声血流信号分级标准:0级:无血流信号。I级:血流信号较弱,存在点状或棒状血流信号1-2处。II级:血流信号中等,点状血流信号有3-4处,小血管在3条以下,主血管在1条以下。III级:血流信号丰富,血管呈网状,相互交织,血管数在3条以上(包括3条)[8-9]。
1.3 观察指标及评价标准 比较两组淋巴结最大直径、血流速度、超声血流信号、血流分布(混合型、分散型、周边型、门型)。
1.4 统计学方法 数据处理选择SPSS26.0软件,计量资料正态分布t检验,以±s表示,计数资料用χ2检验以及秩和检验,以[n(%)]表示,绘制受试者工作特征(ROC)曲线,分析彩超对新辅助化疗治疗效果预测价值,P<0.05表示对比存在差异。
2 结果
2.1 两组淋巴结最大直径、血流速度比较 观察组淋巴结最大直径、血流速度均低于对比组,P<0.05,见表1。
表1 两组淋巴结最大直径、血流速度比较(±s)
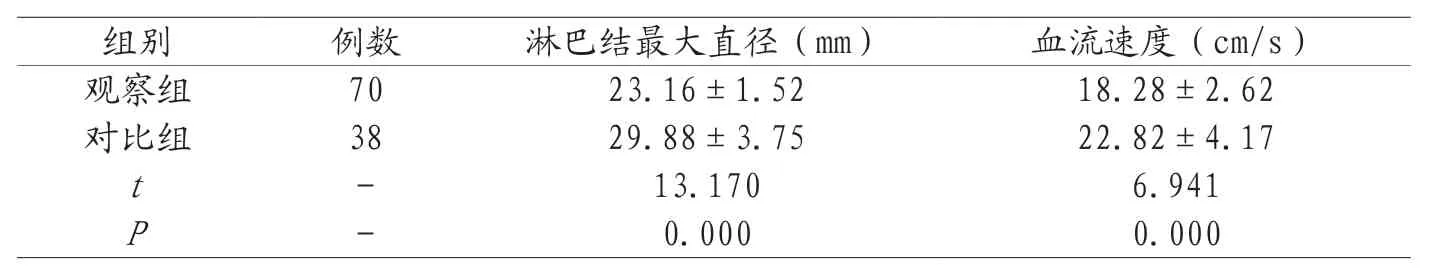
表1 两组淋巴结最大直径、血流速度比较(±s)
?
2.2 两组超声血流信号比较 观察组超声血流信号0级率(54.29%)、I级率(42.86%)均高于对比组(5.26%、21.05%),观察组II级率(2.86%)、III级率(0)均低于对比组(39.47%、34.21%),P<0.05,见表2。2.3 两组血流分布比较 观察组血流分布混合型率(21.43%)、分散型率(38.57%)与对比组(18.42%、21.05%)比较,差异不显著,P>0.05;观察组周边型率(38.57%)高于对比组(10.53%),观察组门型率(1.4 3%)低于对比组(50.00%),P<0.05,见表3。

表2 两组超声血流信号比较[n(%)]
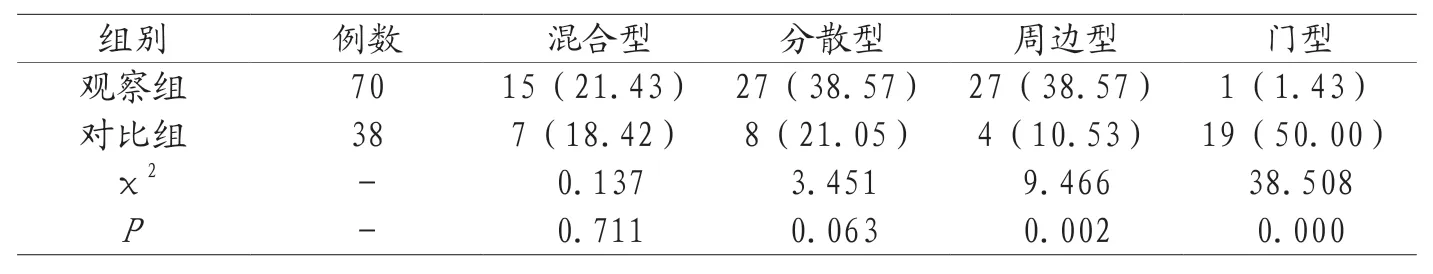
表3 两组血流分布比较[n(%)]
2.4 彩超对新辅助化疗治疗效果预测价值 ROC曲线显示:彩超预测新辅助化疗治疗效果的标准误是0.012,AUC是0.799,95%CI可信区间是0.781-0.934,灵敏度是90.26%,特异度是87.19%,见图1。

图1 彩超对新辅助化疗治疗效果预测价值的ROC曲线图
3 讨论
据调查显示,世界范围内每年有130万左右新发乳腺癌患者[10]。乳腺癌转移与扩散主要通过淋巴结完成,淋巴结是人体重要的免疫器官,乳腺癌淋巴结转移主要以腋窝为主[11]。国内外研究证实,腋窝淋巴结转移是导致乳腺癌患者术后复发、死亡的重要原因之一[12-13]。新辅助化疗是临床治疗中晚期结直肠癌的主要手段,通过给予化学药物治疗,杀灭癌细胞、抑制病灶生长、浸润,从而达到降低患者死亡率、延长生存期的目的[14-15]。及早对乳腺癌淋巴结转移患者新辅助化疗治疗效果作出评价,可避免手术淋巴结清扫等过度治疗而引发的患侧肢体感觉异常、水肿等并发症,改善患者生存质量。
超声在鉴别诊断多种肿瘤病灶良、恶性方面具有较高的准确率、灵敏度。常规超声由于分辨率较低,不能准确地判断较小淋巴结新辅助化疗后淋巴结状态,存在一定的局限性。高频超声与常规二维超声相比,探头分辨率更高,可以准确地分辨淋巴结髓质、皮质等,发现淋巴结结构、形态异常改变,提供淋巴结内部血供、血流阻力指数、内部回声是否均匀、纵横比是否变小、形态是否规整、淋巴结直径等信息[16-17]。本研究显示,观察组淋巴结最大直径、血流速度均低于对比组,P<0.05。说明经新辅助化疗治疗后病理完全缓解的患者淋巴结直径、血流速度更低。究其原因,与FOLFOX6新辅助化疗可以缩小原发肿瘤病灶、转移淋巴结,促进肿瘤细胞凋亡,从而起到阻断新生血管生成、肿瘤细胞增殖的作用有关。本研究显示,观察组超声血流信号0级率(54.29%)、I级率(42.86%)均高于对比组(5.26%、21.05%),观察组II级率(2.86%)、III级率(0)均低于对比组(39.47%、34.21%),P<0.05。说明病理完全缓解的患者血流信号以0级、Ⅰ级为主,血管数目相对较少。分析如下:乳腺癌患者随着肿瘤细胞的转移、浸润,会释放大量的血管因子,不断形成新生血管,滋养细胞迅速繁殖,从而导致血流信号更加丰富[18]。新辅助化疗通过静脉给药的方式,可有效增强肿瘤部位的药物浓度,在短期内杀灭大量的病灶组织,阻断淋巴结转移部位的血供,从而减少淋巴结转移部位的血流分布[19]。观察组周边型率(38.57%)高于对比组(10.53%),观察组门型率(1.43%)低于对比组(50.00%),P<0.05。说明病理完全缓解的患者腋窝淋巴结转移病灶以周边型为主,非完全缓解的患者以门型为主。本研究通过ROC曲线分析显示:彩超预测新辅助化疗治疗效果的灵敏度是90.26%,特异度是87.19%。说明彩超在预测新辅助化疗治疗效果中灵敏度以及特异度较高,并且具有操作方便、价格低廉、可重复检查、无创伤、无辐射等优点,患者及家属接受度均较高。在孙家宝[20]等人的研究中,超声预测pCR的AUC是0.824,灵敏度是68.8%、特异度是96.1%,与本研究结果接近,证实了超声在预测乳腺癌患者治疗效果中灵敏度及特异度均较高。
综上所述,彩超可准确判断乳腺癌淋巴结转移患者新辅助化疗治疗后淋巴结状态,具有较高的灵敏度、特异度,同时可提供转移淋巴结血流信号、血流参数等信息,为医生评估新辅助化疗治疗效果提供科学参考依据。

