炙甘草来源的sRNA可能通过靶向TNF-α缓解轻度ADRS模型小鼠的肺损伤
姜振宇,王小娜,汤克功,陈明锐,蒋澄宇
中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系,北京 100005
急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种急性弥漫炎性反应性肺损伤,根据柏林定义可分为轻度(200<氧合指数≤300)、中度(100<氧合指数≤200)和重度(氧合指数<100)[1],迫切需要一种针对ARDS新的预防和治疗方法。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)作为一种重要的炎性因子,参与免疫调节、发热和炎性反应发生[2]。TNF-α在ARDS的发展过程中起到重要作用[3],在ARDS的患者中TNF-α的水平也有显著上升[4]。现有研究发现使用抗TNF-α类药物的COVID-19感染患者,其呼吸衰竭的临床恢复良好[5]。因此将TNF-α作为治疗ARDS的靶点是一种可行的思路。传统中药(traditional Chinese medicine,TCM)的药效已被临床治疗验证了几千年,在实验室前期工作中鉴定出传统中药中存在汤剂体(decoctosome)[6]。汤剂体由多种小RNA(small RNA,sRNA)、脂质分子、蛋白质及小分子化合物组成,其中的多种sRNA被证明可以治疗许多疾病[7-8]。这些sRNA能靶向成千上万的基因,之前的研究构建了中药sRNA数据库[9],能从中筛选出靶向特定基因的sRNA序列。四逆汤具有温中祛寒,回阳救逆的功效,由附子、干姜、炙甘草三味药组成。本研究从四逆汤水煎液来源的sRNA中筛选出。本研究筛选出1条靶向TNF-α的sRNA——TNF-α-sRNA-9,并对其在体外和体内实验中的药效进行验证。
1 材料与方法
1.1 材料
1.1.1 细胞:人肺腺癌细胞系A549、人单核细胞白血病细胞系THP1和人胚肾细胞系HEK-293T均购自中国医学科学院基础医学研究所细胞资源中心(北京协和细胞资源中心CRC/PUMC)。
1.1.2 小鼠:SPF级雄性BALB/c小鼠, 6~8周龄(北京维通利华实验动物技术有限公司)。
1.1.3 试剂:胎牛血清(Hyclone公司); Ham’s F-12细胞培养基、DMEM细胞培养基(Life Technologies公司); LipofectamineTM2000、LipofectamineTMRNAiMAX、TRIzol(Thermo Fisher Scientific公司); 双荧光素酶报告系统检测试剂盒(Promega公司); 反转录试剂(TaKaRa公司); 实时荧光定量PCR试剂盒LightCycler®480 SYBR Green Ⅰ Master试剂盒(Roche公司); BCA蛋白质定量试剂盒[天根生化科技(北京)有限公司]; PVDF膜(Millpore公司); GAPDH鼠源一抗,TNFα蛋白质兔源一抗和HRP-conjugated山羊抗小鼠二抗以及抗兔二抗(均武汉爱博泰克生物科技有限公司);小RNA(sRNA)[通用生物(安徽)股份有限公司合成]; NC-sRNA(苏州瑞博生物技术股份有限公司合成); 质粒(苏州泓迅生物科技股份有限公司构建); 脂多糖(lipopolysaccharide,LPS)和poly(I:C)(Sigma-Aldrich公司); IL-1β ELISA试剂盒、IL-6 ELISA试剂盒和TNF-α ELISA试剂盒(R&D Systems公司)。
1.2 方法
1.2.1 生物信息学分析:人类TNF-α的mRNA全长序列来源于NCBI(National Center for Biotechnology Information)。选择TNF-α作为预测的候选靶基因,利用RNAhybrid(version 2.1.2)软件对四逆汤来源sRNAs的靶基因进行预测,筛选条件:最小自由能(minimal free energy, MFE)≤-20 kcal/mol。
1.2.2 细胞的培养及转染:将A549、THP1和HEK-293T置于37 ℃,50 mL/L CO2细胞培养箱中培养。sRNA用LipofectamineTMRNAiMAX转染,浓度为100 nmol/L;质粒用LipofectamineTM2000转染,浓度为1 mg/L。
1.2.3 双荧光素酶报告基因检测靶向关系:在psi-check2.0质粒上构建TNF-α-WT质粒和TNF-α-MUT质粒。96孔板培养HEK-293T细胞24 h后,将100 ng质粒用LipofectamineTM2000转染,将100 nmol/L sRNA用LipofectamineTMRNAiMAX转染。48 h后裂解细胞,用GloMax 96微孔板发光检测仪(Promega公司)检测海肾(Renilla reniformis)荧光素酶及萤火虫(Photinus pyralis)荧光素酶活性。
1.2.4 LPS或poly(I:C)THP1和A549细胞炎性模型的建立:将细胞分为4组,Native组为未用LPS或poly(I:C)处理的空白对照组,模型组用LPS或poly(I:C)刺激,阴性对照组转染无义的NC-sRNA,治疗组转染TNFα-sRNA-9,然后用10 μg/mL的LPS或1 μg/mL的poly(I:C)刺激细胞24 h。
1.2.5 RT-qPCR检测mRNA水平:用TRIzol提取细胞总RNA后,用1 μg RNA进行反转录,用SYBR Green进行荧光定量PCR,以人泛素基因UBC为内参,按照2-ΔΔCt法计算相对表达量。引物序列见表1。

表1 RT-qPCR引物序列
1.2.6 Western blot检测蛋白质的表达:用RIPA裂解细胞后,提取细胞总蛋白,电泳,转膜,室温封闭1 h,4 ℃过夜孵育一抗,用TBST洗膜3次,室温孵育二抗1 h,用TBST洗膜3次,显影拍照。抗体稀释浓度:TNF-α一抗(1∶10 000),GAPDH一抗(1∶5 000),二抗(1∶10 000)。实验重复3次,用ImageJ进行吸光度值分析统计。
1.2.7 ELISA检测炎性因子:按照ELISA试剂盒说明书,过夜包被板子,洗板拍板3次,封闭1 h,洗板拍板3次,加检测样品和标准品静置2 h,洗板拍板3次,加检测抗体静置2 h,洗板拍板3次,加streptavidin-HRP静置20 min,洗板拍板3次,加底物溶液静置20 min,加终止液,用酶标仪检测。
1.2.8 小鼠实验:将小鼠分为native组、模型组、NC组和sRNA治疗组,每组4只(n=4)。将10 nmol的TNFα-sRNA-9与脂质sphingosine(d18∶1)加热制备本草体,连续3 d灌胃给小鼠后,用LPS或poly(I:C)气管滴注构建轻度ARDS小鼠模型。12 h后收取小鼠的血液和支气管肺泡灌洗液(bronchoal-veolar lavage fluid,BALF),将血液3 000 r/min离心10 min得到血清(serum)。
1.3 统计学分析
2 结果
2.1 生物信息学方法筛选靶向TNF-α的小RNA
以TNF-α的mRNA全长为靶序列,用RNAhybrid预测结合,将最小自由能从低到高排序,筛选出前50条靶向TNF-α的sRNA序列,如表2。

表2 四逆汤水煎液来源的sRNA序列和最小自由能
2.2 双荧光素酶报告基因实验验证TNFα-sRNA-9可能靶向TNF-α
这50条sRNA中,有10条sRNA能够与TNF-α的mRNA结合,降低荧光相对量(图1A)。用THP1炎性细胞模型验证,与NC-sRNA相比,这10条sRNA中TNFα-sRNA-9降低TNF-α浓度的效果最好(图1B)。
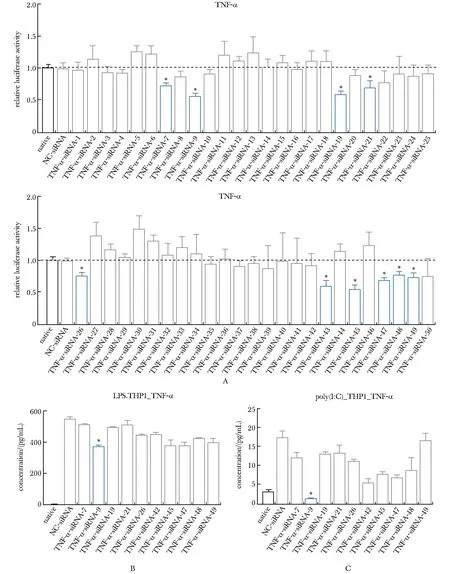
A.dual luciferase reporter assay screen 50 pieces of sRNA targeting TNF-α; B,C.LPS or poly(I:C)induced THP1 cell to screen 10 pieces of sRNA targeting TNF-α; *P<0.01 compared with NC-sRNA group.
在本草数据库[Bencao(herbal)sRNA Atlas]中[9],TNF-α-sRNA-9来源于四逆汤中的炙甘草(baked licorice, Zhi gan cao, ZGC,GlycyrrhizauralensisFisch./GlycyrrhizainflataBat./GlycyrrhizaglabraL.)。
2.3 TNF-α-sRNA-9可能靶向TNF-α的3′-UTR区
TNF-α-sRNA-9可能与TNF-αmRNA的3′-UTR区结合(图2A)。
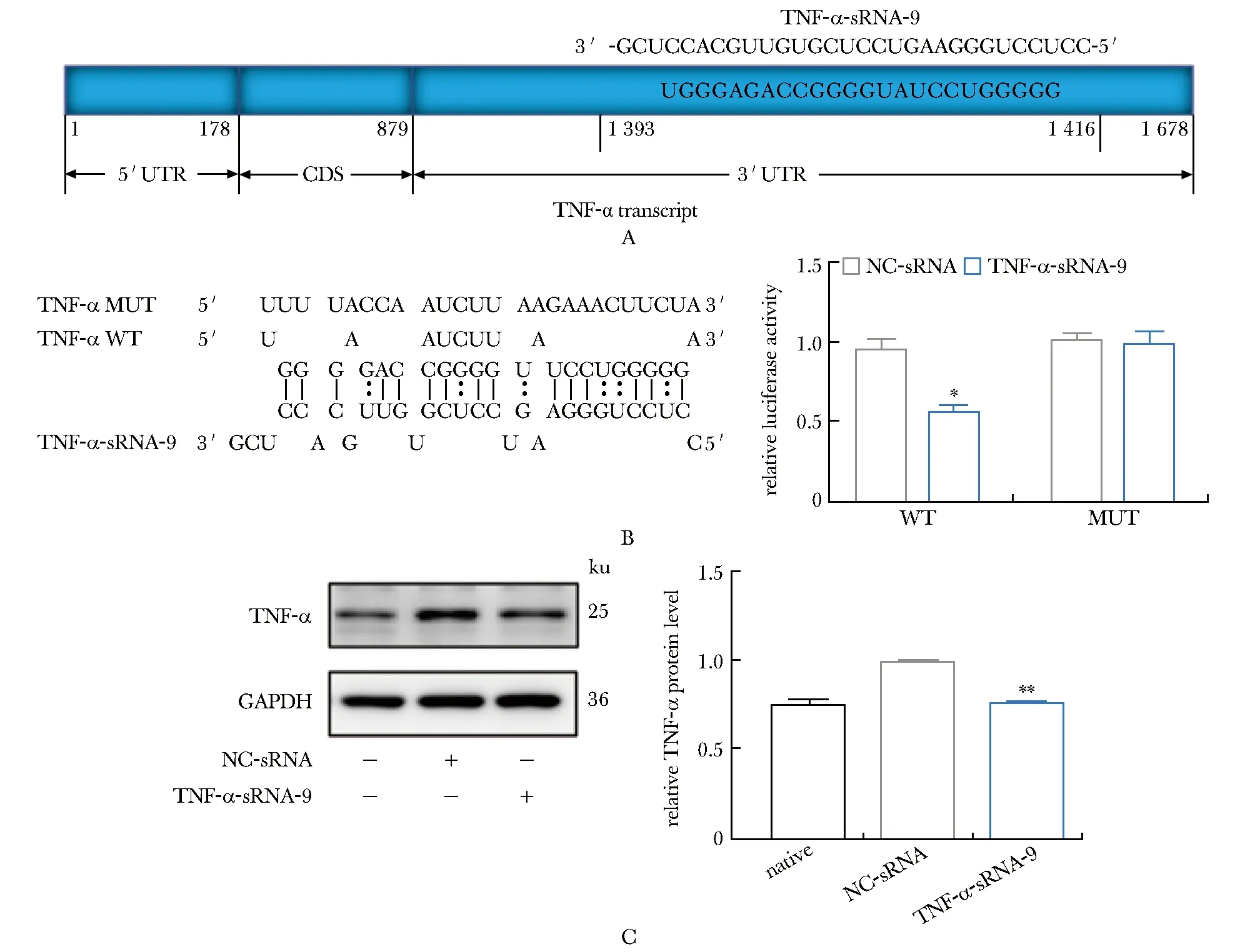
A.binding site of TNF-α-sRNA-9 was in 3’UTR of TNF-α transcript; B.mutation of TNF-α could not bind with TNF-α-sRNA-9; C.TNF-α-sRNA-9 could downregulate the relative TNF-α protein level in A549 cell; *P<0.05, **P<0.01 compared with NC-sRNA group.
与NC-sRNA相比,TNF-α-sRNA-9可能靶向TNF-α使得相对荧光素酶活性降低。将TNF-α上的结合位点突变后,TNF-α-sRNA-9不能靶向TNF-α(图2B)。说明TNF-αmRNA的3′-UTR可能是TNF-α-sRNA-9的直接结合位点。
与阴性对照组(NC-sRNA)相比,转染TNF-α-sRNA-9后,TNF-α的蛋白表达量降低(图2C)。
2.4 TNF-α-sRNA-9降低LPS或poly(I:C)刺激的A549细胞模型中炎性因子的表达
与阴性对照组(NC-sRNA)相比,TNF-α-sRNA-9可以降低炎性因子IL-1β、IL-6和TNF-α的浓度(图3A)。与阴性对照组(NC-sRNA)相比,TNF-α-sRNA-9可以降低IL-1β、IL-6和TNF-α的mRNA水平(图3B)。
与阴性对照组(NC-sRNA)相比,TNF-α-sRNA-9可以降低炎性因子IL-1β、IL-6和TNF-α的浓度(图3C)。与阴性对照组(NC-sRNA)相比,TNF-α-sRNA-9可以降低IL-1β、IL-6和TNF-α的mRNA水平(图3D)。
2.5 TNF-α-sRNA-9降低急性肺损伤模型小鼠的血清和支气管肺泡灌洗液(BALF)中的炎性因子
与阴性对照组(NC-sRNA)相比,经过TNF-α-sRNA-9治疗后的小鼠,血清和支气管肺泡灌洗液(BALF)中的炎性因子IL-1β、IL-6和TNF-α的浓度均降低(图4A~D)。

A.ELISA result of IL-1β,IL-6 and TNF-α in BALF of LPS induced mild ARDS mouse models; B.ELISA result of IL-1β,IL-6 and TNF-α in serum of LPS induced mild ARDS mouse models; C.ELISA result of IL-1β,IL-6 and TNF-α in BALF of poly(I:C)induced mild ARDS mouse models; D.ELISA result of IL-1β,IL-6 and TNF-α in serum of poly(I:C)induced mild ARDS mouse models; *P<0.05,**P<0.01,***P<0.001, ****P<0.000 1 compared with NC-sRNA.
2.6 TNF-α-sRNA-9缓解了轻度ARDS模型小鼠的肺损伤
与阴性对照组(NC-sRNA)小鼠的存活率曲线相比,经过TNF-α-sRNA-9治疗后的小鼠的存活率上升(图5)。
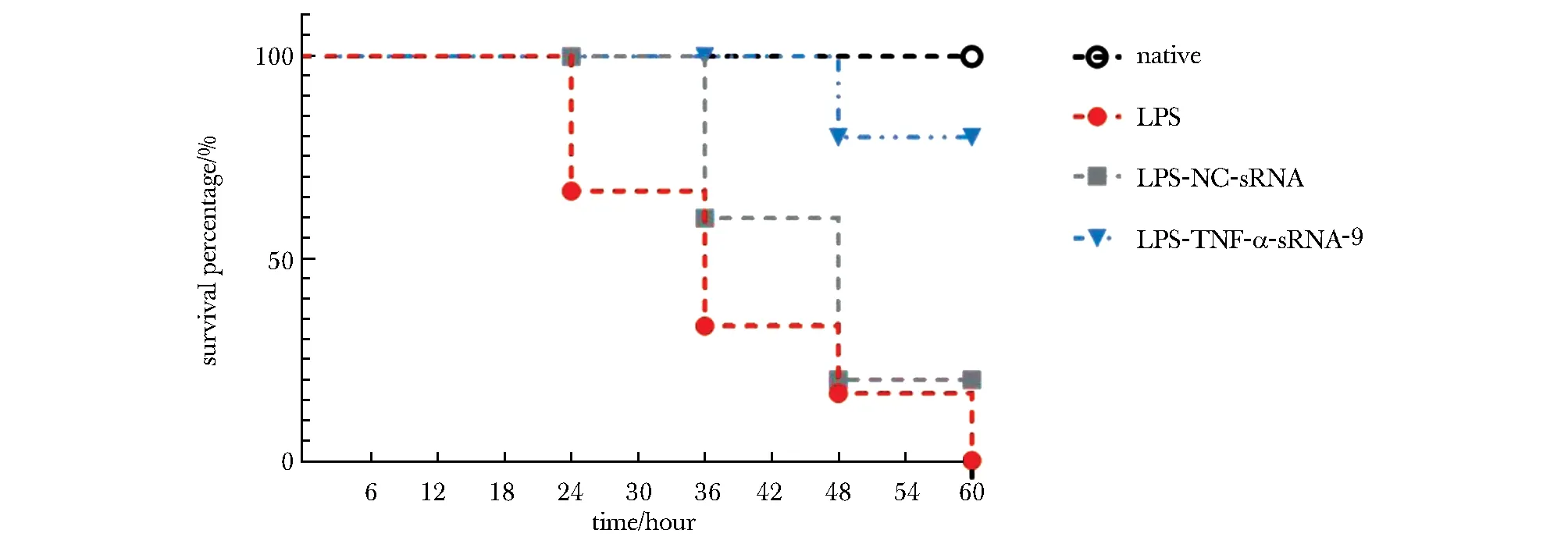
图5 TNF-α-sRNA-9能缓解轻度ARDS模型小鼠的肺损伤
3 讨论
急性呼吸窘迫综合征是发病后致死率极高的一种肺部疾病,在全球COVID-19大流行的背景下,COVID-19导致急性呼吸窘迫综合征患病人数增加,并且由于其发病的迅猛,服用药物进行预防更加有必要。本研究以急性呼吸窘迫综合征为适应症,筛选得到了1条新型的小核酸药物TNF-α-sRNA-9,能够缓解ARDS模型小鼠的肺损伤,并且是提前口服,能够预防疾病的进程,在疾病未形成的阶段就形成保护,能够有效缓解ARDS模型小鼠的肺损伤的症状。未来,TNF-α-sRNA-9可能在大型动物上甚至人身上发挥临床疗效,或将成为一种新型的口服小核酸药。
炙甘草具有补脾和胃,益气复脉的功能。主要用于脾胃虚弱,倦怠乏力,心动悸,脉结代,其药效已经在临床上被验证了几千年。2019年的一项研究表明中药水煎液中含有大量的脂质分子、多肽、化合物和sRNA,可在煎煮的过程中自然形成结构类似于外泌体的汤剂体,汤剂体作为中药水煎液中药效的集中成分在口服后将sRNA递送进入机体[6]。本研究的TNF-α-sRNA-9是来源于天然中草药炙甘草的sRNA,实验表明TNF-α-sRNA-9可能是炙甘草的重要药效成分,为sRNA在中药中发挥的药效作用提供了依据。
TNF-α作为一种重要的炎性因子,发挥免疫调节、发热和炎性反应发生的作用,在许多急性呼吸窘迫综合征的患者体内的TNF-α水平均上升。诱发急性呼吸窘迫综合征的一个关键因素就是细胞因子风暴[10],而细胞因子风暴中最重要的炎性因子之一是TNF-α。本研究中的新型小核酸药物TNF-α-sRNA-9通过靶向TNF-α在体外体内表现出良好的效果,说明以TNF-α靶点、抑制TNF-α的表达,可以用于治疗急性呼吸窘迫综合征,解释了治疗急性呼吸窘迫综合征的机制,为治疗急性呼吸窘迫综合征提供了一个新的靶点思路。
综上所述,本研究筛选得到了1条来源于炙甘草的sRNA——TNF-α-sRNA-9,在体外和体内实验中,TNF-α-sRNA-9具有缓解ARDS症状的药效,可能是一种新型的寡核苷酸类药物。

