蛋白质精氨酸脱亚胺酶2与4在恶性间皮瘤中的表达及其临床意义
干译涵,沈 蔚,陈伊童,严凯丽,胡帅悦,蒋兆强,应士波*
1.杭州医学院,浙江 杭州 310013;2.慈溪市第三人民医院 呼吸内科,浙江 宁波 315324
恶性间皮瘤(malignant mesothelioma,MM)是一类与石棉暴露相关的职业性肿瘤,其多发于腹膜、胸膜和心包膜,致死率高,潜伏期长达20~40年,中位生存期仅12~18个月[1-2]。恶性间皮瘤包括3种主要的组织学分型:上皮型、肉瘤型和双相型,其中上皮型最常见,而肉瘤型的侵袭性最强且预后最差,双相型由上皮样和肉瘤样双相形态组成,临床上少见[1,3]。蛋白质精氨酸脱亚胺酶(peptidylarginine deiminases,PADs)是一种催化蛋白质的精氨酸残基改变成瓜氨酸残基的钙离子依赖性水解酶[4]。这个催化过程是一种不可逆的蛋白质翻译后修饰(post-translational modifications,PTMs),被称为瓜氨酸化(citrullination)。人类PAD家族有5个序列高度同源的蛋白质同工酶成员,基因簇位于1号染色体的1p36.1区域[5]。其中,PAD2和PAD4及其催化的蛋白质瓜氨酸化与肿瘤的发生发展密切相关[6]。但是据目前所知,在国内外未有关于PAD2和PAD4及其瓜氨酸化在恶性间皮瘤中的基础与临床研究报道,也缺少关于PAD酶的表达与瓜氨酸化水平相关性研究。本研究通过免疫组化和相关性分析研究PAD2和PAD4在恶性间皮瘤与癌旁组织中的表达差异及其与蛋白瓜氨酸化之间的相关性,并结合公共数据库信息进一步探讨PAD2和PAD4的转录水平及其临床意义。
1 材料与方法
1.1 材料
1.1.1 病例:在2014年至2021年期间,共收集浙江省内45例恶性间皮瘤患者的组织样本,男性10例,女性35例。按照发病部位分,胸膜间皮瘤14例,腹膜间皮瘤31例;按照组织学分型分,上皮型恶性间皮瘤41例,肉瘤型恶性间皮瘤4例。本研究已通过杭州医学院医学伦理委员会审批(编号:LL2020-35)。
1.1.2 试剂与材料:PAD2抗体(Abcam公司)、PAD4抗体(Proteintech公司)、抗肽基瓜氨酸抗体F95(Sigma-Aldrich公司); DAB显色试剂盒(DACO公司);血清(Gibco公司)。
1.2 方法
1.2.1 组织芯片:使用石蜡包埋标本制作恶性间皮瘤组织芯片,其中45组肿瘤组织和配对癌旁组织纳入本研究。恶性间皮瘤样本的组织学分型由3名病理医师独立判读,并标记癌和癌旁代表性区域。使用组织阵列仪(Beecher公司)冲压阵列蜡块且连续切片半自动制作芯片点阵,切片厚度为5 μm,点阵孔径为1.5 mm。
1.2.2 免疫组化(immunocytochemistry,IHC)检测蛋白:组织芯片在63 ℃烘焙1 h,用二甲苯脱蜡和复水,用柠檬酸盐缓冲液修复抗原,室温下10%血清封闭30 min,加入抗PAD2和抗PAD4抗体,4 ℃孵育过夜。PBS清洗3次后,加二抗在室温下孵育30 min,加入 DAB 显色液,用苏木精复染 2~3 min,使用中性树胶进行封片,使用Pannoramic全景切片扫描仪(匈牙利3DHISTECH公司)扫描成像。蛋白组织化学评分使用Quant Center2.1分析软件(匈牙利3DHISTECH公司)检测组织芯片扫描成像图的每个点的H-Score值。H-Score=∑(pi×i)=(弱着色强度细胞百分比×1)+(中着色强度细胞百分比×2)+(强着色强度细胞百分比×3);式中pi表示阳性信号像素面积占比,i代表着色强度。
1.2.3 生物信息学分析:从TCGA(The Cancer Genome Atlas)数据库中获得PAD2和PAD4在恶性间皮瘤组织中FPKM(fregments per kilobase per million)格式的RNAseq数据转换成了TPM(transcripts per million reads)格式并进行log2转化,并结合恶性间皮瘤患者的临床信息资料,绘制相关性散点图和Kaplan-Meier生存曲线,分析其表达水平的相关性、差异性和临床意义。
1.3 统计学分析

2 结果
2.1 PAD2和PAD4在恶性间皮瘤组织中的表达情况
PAD2在恶性间皮瘤癌组织中的总表达量显著高于癌旁组织(P<0.05)。PAD4在恶性间皮瘤癌组织中的总表达量也显著高于癌旁组织(P<0.01)(图1)。PAD2常见于在细胞质中表达,而PAD4多数在细胞核中表达。
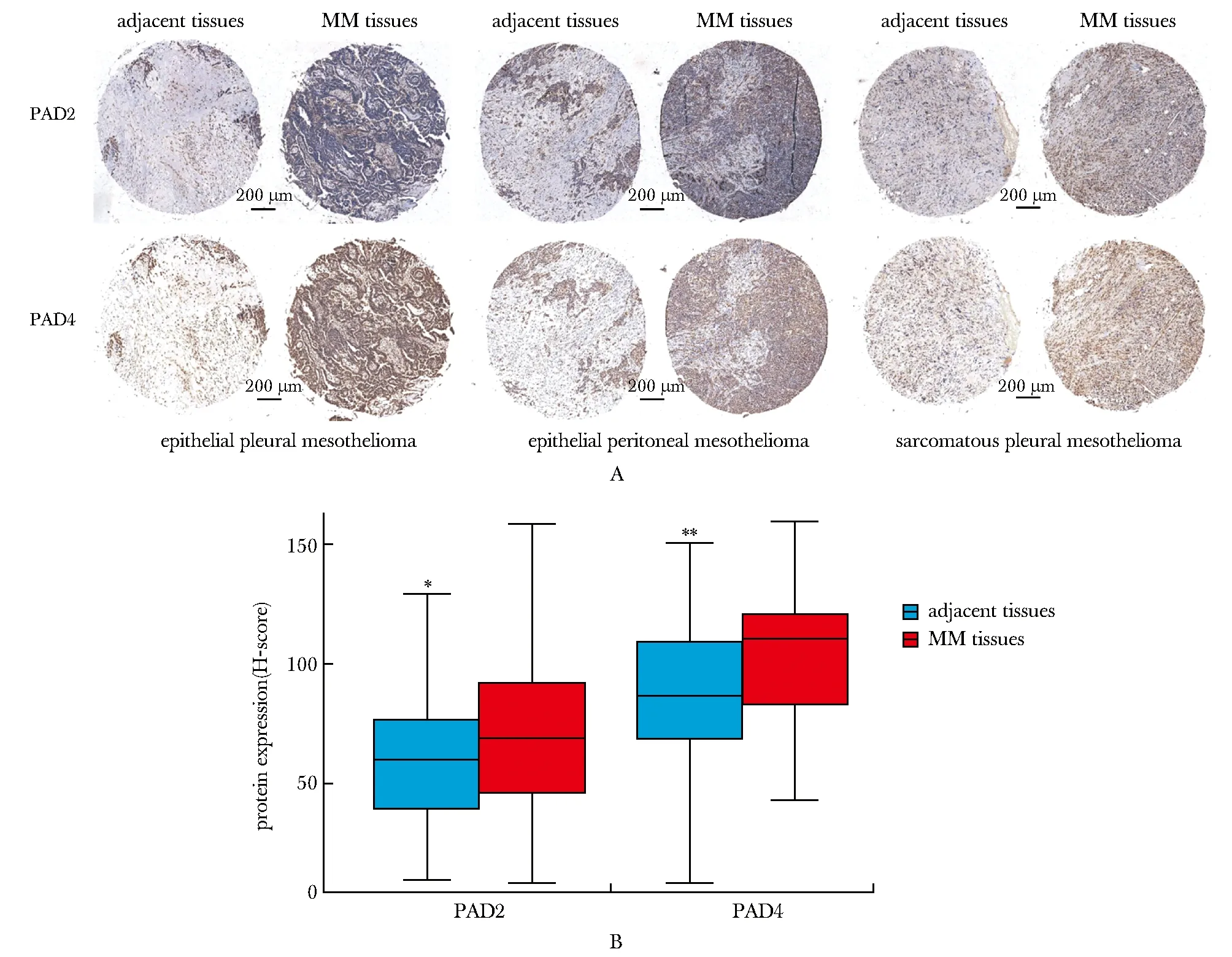
A.expressions of PAD2 and PAD4 in 3 typical pathological specimens; B.comparison of PAD2 and PAD4 expression in MM tissues and adjacent tissues(n=45);MM.malignant mesothelioma; *P<0.05,**P<0.01 compared with adjacent tissues.
2.2 PAD2和PAD4在癌组织中表达水平的相关性
在恶性间皮瘤组织中,PAD2与PAD4的蛋白表达之间呈正相关(P<0.001)。在不同的组织学分型中,PAD2与PAD4的蛋白表达在上皮型恶性间皮瘤中呈正相关(P<0.001)。另外,PAD2与PAD4的蛋白表达在胸膜恶性间皮瘤(P<0.05)和腹膜恶性间皮瘤中均呈正相关(P<0.001)。
基于TCGA中恶性间皮瘤组织(n=86)的mRNA表达数据分析,发现PAD2与PAD4的mRNA转录水平之间呈正相关(r=0.259,P<0.05)(图2)。综上所述,PAD2与PAD4的蛋白和转录水平均呈正相关。
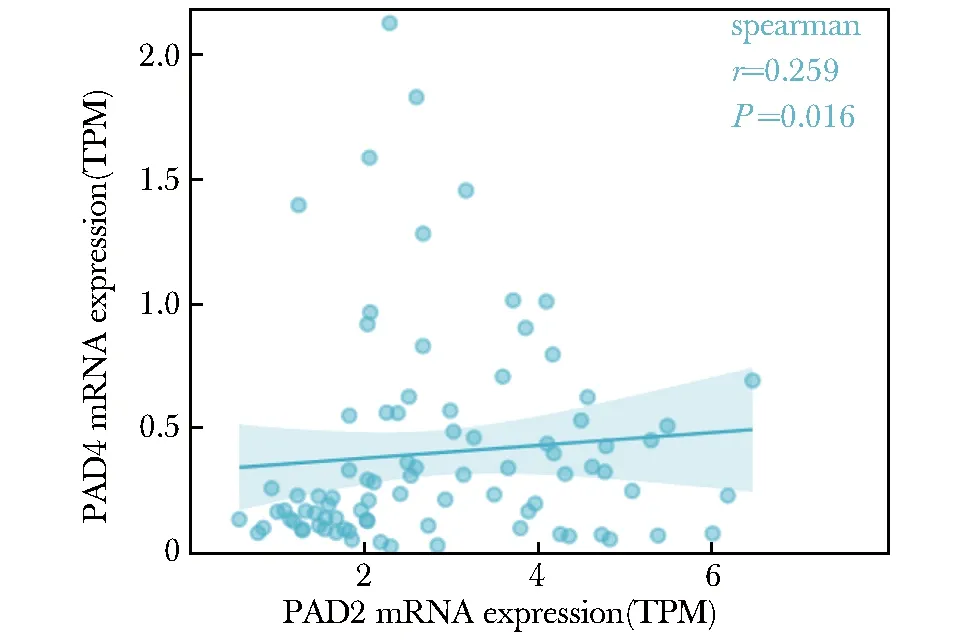
TPM.transcripts per million.
2.3 PAD2和PAD4在癌组织中的表达与瓜氨酸化蛋白质的相关性
在恶性间皮瘤组织中,PAD2与瓜氨酸化蛋白呈正相关(r=0.517,P<0.001)(图3);同时,PAD4也与瓜氨酸化蛋白呈正相关(r=0.392,P<0.01)(图3)。

A.correlation between expression of PAD2 and citrullinated proteins in MM tissue; B.correlation between expression of PAD4 and citrullinated proteins in MM tissue.
2.4 PAD2、PAD4表达与临床意义的关系
PAD2、PAD4和瓜氨酸化蛋白在恶性间皮瘤组织中,不同发病部位和组织学分型均未发现统计学相关性。
PAD2高表达患者的总生存期(overall survival, OS)较低表达患者更短(P<0.05),PAD4高表达患者的OS相对于低表达患者也更短(P<0.05)。PAD4高表达患者的无进展间隔期(progression free interval, PFI)相对于低表达患者更长(图4)。
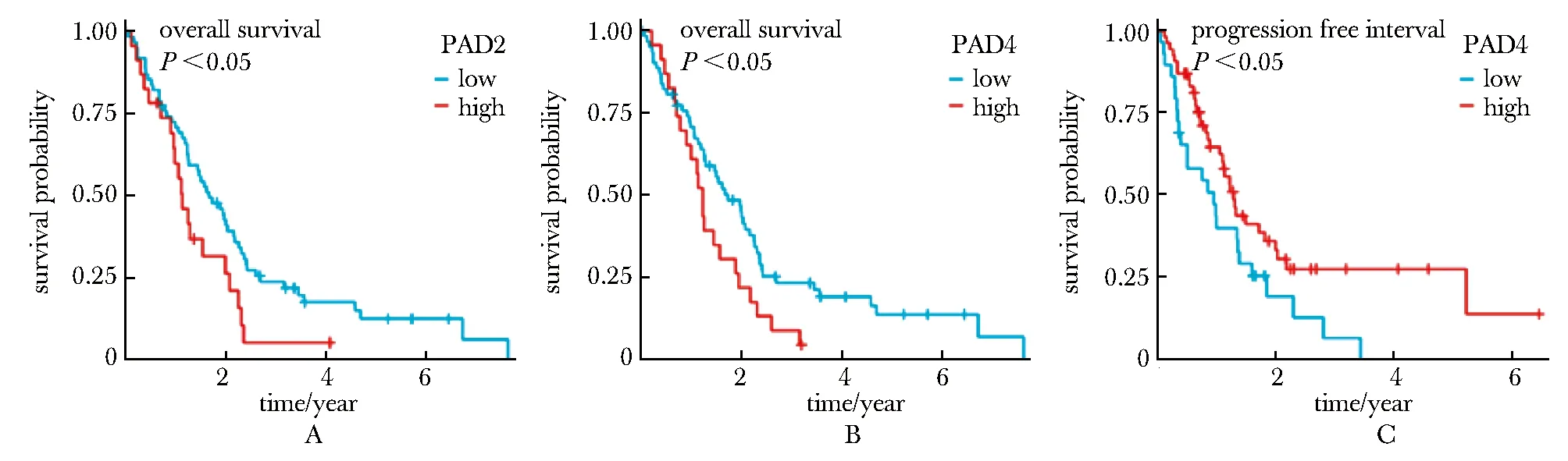
A.overall survival for PAD2 expression; B.overall survival for PAD4 expression; C.progression free interval for PAD4 expression.
3 讨论
近年来,PAD2和PAD4已经逐渐成为肿瘤生物标志物和治疗癌的潜在靶向目标。研究发现,PAD2和PAD4均在多种消化系统肿瘤、乳腺癌、肺细胞癌等多种常见肿瘤中呈高表达,并可能影响肿瘤的恶性程度[6]。本研究发现PAD2和PAD4在恶性间皮瘤组织较癌旁组织均呈高表达,提示PAD可能与恶性间皮瘤的发生发展有关,具有作为肿瘤的非特异性诊断生物标志物的潜在价值。
PAD介导的瓜氨酸化是一种特殊的蛋白质翻译后修饰过程,这种催化反应不仅使靶蛋白质量减少1 ku,而且显著改变电荷,将带正电荷的残基变为带中性电荷的残基,可能会改变靶蛋白质的构象、聚集能力或解聚趋势[6]。PAD2是PAD家族中表达最广泛的同工酶,主要在胞质中表达,也可转移到细胞核中,调节基因转录[4,7]。PAD4具有经典核定位序列,在调控细胞外基质和中性粒细胞胞外杀菌网络的形成中发挥重要作用[4]。PAD2和PAD4都可以通过靶向蛋白瓜氨酸化调节参与肿瘤生长、细胞周期和蛋白质合成的基因来改变细胞信号[4]。例如PAD2促进肿瘤抑制因子p53的降解,从而使肿瘤细胞增殖不被G1/S检查点阻遏[8-9]。PAD4介导I型胶原的瓜氨酸化对原发性肿瘤的生长有重要作用,抑制其表达可以降低原发性肿瘤的生长[10]。本研究发现在恶性间皮瘤组织中PAD2和PAD4与瓜氨酸化蛋白质正相关,提示PAD2和PAD4可能同时参与了蛋白质瓜氨酸化。另外,本研究发现PAD2和PAD4都有成为恶性间皮瘤预后标志物的潜力,PAD表达越高OS越短,但是PAD4高表达患者的PFI却比低表达患者更长,提示其分子机制的复杂性。PAD可通过组蛋白瓜氨酸化调控多种肿瘤相关基因转录从而促进肿瘤进展,组蛋白瓜氨酸化正在成为肿瘤靶点研究热点[11],因此针对PAD酶的靶向抑制研究有可能为协助恶性间皮瘤治疗提供一种新途径。
综上所述,PAD2和PAD4及其介导的蛋白质瓜氨酸化与恶性间皮瘤进展和预后有关,具有作为生物标志物或治疗靶点的潜在价值,但相关的具体分子机制需要通过进一步深入研究获得验证和解析。本研究有助于提高对恶性间皮瘤发生发展的分子生物学理解,为诊断和治疗提供理论基础。

