SiRNA诱导ROR2表达下调抑制软骨肉瘤细胞的增殖、迁移和侵袭
黄建军 石莺 刘泉 陈忠益 曾国庆 赵柏阳
软骨肉瘤作为发病率排名第二的原发恶性骨肿瘤,对放化疗具有很强的抵抗作用,外科手术治疗术后易出现复发和转移,使得预后效果较差[1],严重危及患者生命。因此,探索并阐明软骨肉瘤的发生发展机制,寻找有效的治疗靶点是治疗软骨肉瘤的重要策略。受体酪氨酸激酶样孤儿受体2(receptor tyrosine kinase-like orphan receptor 2,ROR2)是受体酪氨酸激酶家族(RTKs)成员之一,参与体内细胞增殖调控、凋亡、分化、黏附、迁移等多种重要的细胞生理活动,在动物发育的形态发生及组织分化过程中发挥重要作用[2]。研究表明,ROR2参与调节成骨细胞的存活和分化从而影响骨发育和重塑[3,4]。正常组织中ROR2的表达水平较低,而在多种肿瘤组织或细胞(如慢性淋巴细胞性白血病、恶性黑色素瘤、头颈鳞癌、卵巢癌、乳腺癌、肾癌等)中呈高表达,并加速肿瘤细胞的增殖、迁移、侵袭和凋亡等过程[5-8]。我们前期的研究发现ROR2在骨肉瘤组织及细胞中有较强表达,并可能促进了骨肉瘤的发生发展及恶性生物学行为[9,10]。但笔者发现ROR2在软骨肉瘤中的功能尚不清楚。本实验拟采用体外培养人软骨肉瘤SW1353细胞,应用小干扰RNA(SiRNA)特异性下调SW1353细胞中ROR2的表达水平,观察其对软骨肉瘤SW1353细胞增殖、迁移及侵袭能力的影响,以期为软骨肉瘤的临床治疗提供新的靶点。
1 材料与方法
1.1 实验材料 人软骨肉瘤细胞系SW1353购于美国ATCC公司;RPMI-1640培养基、胎牛血清购于美国Gibco公司;Lipofectamine 2000转染试剂盒购于美国Thermo Fisher Scientific公司;Trizol试剂、逆转录试剂盒、BCA蛋白定量试剂盒、化学发光试剂盒、CCK-8试剂盒及RIPA裂解液购于碧云天生物公司;鼠抗人ROR2单克隆抗体购于美国novus公司;Transwell小室购自美国Corning公司。小干扰RNA序列由上海博亚公司合成、纯化。
1.2 方法
1.2.1 细胞培养、转染及分组:人软骨肉瘤SW1353细胞用含10%胎牛血清的RPMI1640培养液,37℃恒温培养箱,5%的CO2,相对饱和湿度95%的条件下培养。根据细胞生长状态,每2~3天更换1次新鲜培养液,待细胞生长至汇合度达85%左右时,以胰酶消化传代。转染前24 h,胰酶消化处于对数生长期的细胞并计数,用无抗生素含10%胎牛血清的RPMI1640培基稀释细胞后传代于6孔板(1×106个/孔)中,保证细胞贴壁后的密度为60%~70% 时,严格按SiRNA转染说明书进行相应的转染。将不做任何处理的人软骨肉瘤SW1353细胞记为空白对照组、将转染了NC-SiRNA的SW1353细胞作为阴性对照组(记为NC组),将转染了ROR2-SiRNA的SW1353细胞作为实验组(记为ROR2-SiRNA组)。
1.2.2 qRT-PCR检测转染后细胞中ROR2 mRNA表达水平:通过qRT-PCR检测转染效果。转染48 h后收集各组细胞,用Trizol试剂提取3组细胞总RNA,紫外分光光度计检测总RNA纯度和浓度后,逆转录合成cDNA。调整cDNA浓度为50 ng/μl后进行荧光定量PCR扩增,以GAPDH基因为内参,用相对定量 2-ΔΔCT计算细胞中ROR2 mRNA相对表达水平。见表1。

表1 引物序列
1.2.3 Western blot检测各组细胞中ROR2蛋白表达水平:收集转染后48 h的后3组SW1353细胞,胰酶消化细胞,1 500 r/min离心10 min,加入100 μl总蛋白提取液,用移液器充分吹打,直到细胞完全被溶解。超声3次,3 s/次。4℃下12 000 min,离心10 min,取上清,BCA法(按试剂盒说明书步骤进行)测定总蛋白浓度。将总蛋白混合液:蛋白上样缓冲液=4∶1,混匀,100℃加热3 min使蛋白质变性。离心取上清液20 μl进行12%浓度的SDS-PAGE凝胶电泳后转至PVDF膜,5%脱脂奶粉封闭2 h,加入鼠抗人ROR2单克隆抗体(1∶1 000稀释)4℃孵育过夜,PBST洗膜3次(5 min/次)后,加入二抗(1∶2 000稀释)室温孵育1 h。暗室中加入化学发光ECL显影液显影曝光后,凝胶成像系统曝光拍照,计算目的蛋白条带灰度值与内参GAPDH蛋白条带灰度值用以表示ROR2蛋白相对表达水平。
1.2.4 CCK-8法检测各组细胞增殖能力:取对数生长期的各组细胞接种于96孔板中,每组设6个复孔(6×103个/孔),应用CCK-8法分析各组细胞增殖能力是否存在不同。各组细胞分别在37℃下孵育0、24、48和72 h后加入10 μl的CCK-8溶液(每个时间点均设置3个平行复孔),继续在培养箱中孵育2 h,在酶标仪450 nm处测定各孔细胞的光密度(OD)值。
1.2.5 细胞划痕实验检测各组细胞迁移能力:取对数生长期的各组细胞以5×105个细胞/孔的浓度接种到6孔板中过夜。当细胞达到融合时,用无菌20 μl枪头尖端垂直于横线划痕,PBS洗涤3次后,加入无血清培养基。37℃,5%CO2培养箱孵育,于划痕后0、48 h在同一位置用倒置显微镜观察拍照,Image J软件测量划痕面积,计算相对划痕愈合率。相对划痕愈合率=实验组(0 h划痕面积-48 h划用痕面积)/对照组(0 h划痕面积-48 h划痕面积)。
1.2.6 Transwell实验检测各组细胞侵袭能力:用50 mg/L Matrigel 1∶8稀释液包被Transwell小室底部,4℃风干。将Transwell小室放入24孔细胞板上,取对数生长期细胞制成1×106个/ml无血清细胞悬液,将200 μl的单细胞悬液加入小室上室中,下室中加入600 μl含胎牛血清的完全培养基,置于培养箱内常规培养24 h后,取出小室。用40 g/L多聚甲醛固定20 min,0.1%结晶紫染色10 min,棉签小心拭去上室面的细胞,PBS清洗残留染色液,倒置显微镜下每组随机选取取5个视野拍照并计数。
2 结果
2.1 3组SW1353细胞中ROR2 mRNA和蛋白的表达水平比较 ROR2-SiRNA组ROR2 mRNA和蛋白的表达水平明显低于空白对照组和NC组(P<0.05),而空白对照组和NC组比较,差异无统计学意义(P>0.05)。见图1,表2。
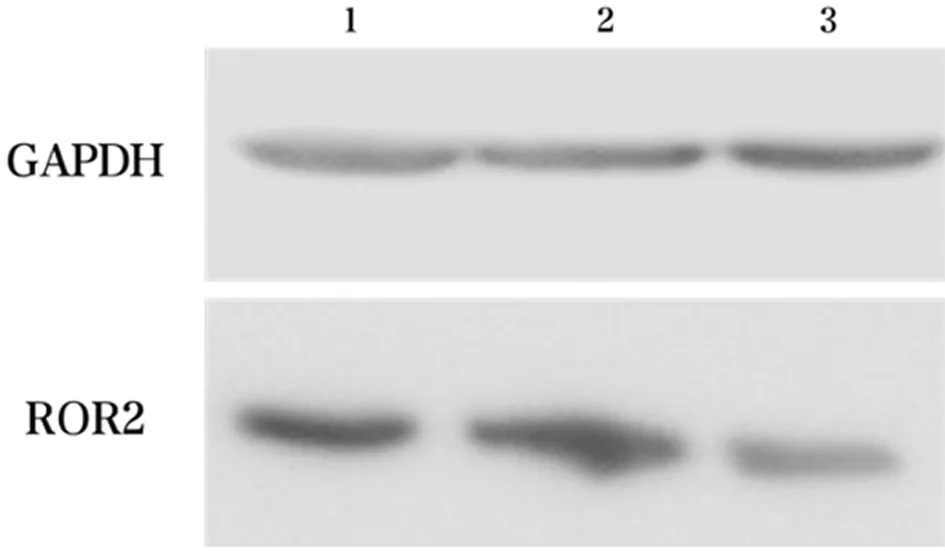
图1 3组SW1353细胞中ROR2蛋白表达水平;1 空白对照组;2 NC组;3 ROR2-SiRNA组

表2 3组SW1353细胞中ROR2 mRNA和蛋白的表达水平
2.2 3组SW1353细胞增殖能力比较 相同的作用时间,ROR2-SiRNA组OD值明显低于空白对照组和NC组(P<0.05),而空白对照组与NC组比较差异无统计学意义(P>0.05)。见表3。

表3 3组细胞增殖能力比较
2.3 3组SW1353细胞划迁移、侵袭能力 细胞划痕实验结果显示,与NC组相比,ROR2-SiRNA组肿瘤细胞的迁移距离明显变短,迁移能力明显受到抑制,差异有统计学意义(P<0.05)。Transwell实验结果显示,与NC组比较,ROR2-SiRNA组的穿膜细胞数明显减少,侵袭能力明显减弱,差异有统计学意义(P<0.05)。见图2、3,表4。
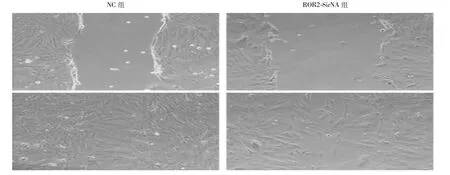
图2 细胞划痕实验检测2组SW1353细胞的迁移能力(×100)

图3 Transwell实验检测2组SW1353细胞的侵袭能力(HE×100)

表4 2组SW1353细胞的迁移距离及穿膜细胞数的比较n=9,
3 讨论
软骨肉瘤是一种常见的起源于软骨组织[11]的恶性骨肿瘤,其发病率仅次于骨肉瘤,好发于骨盆、股骨近端和肱骨近端、肋骨外,还可以发生于椎骨、骶骨、锁骨、肩胛骨和足骨[12]。大多数软骨肉瘤继发于良性软骨瘤,如内生软骨瘤和骨软骨瘤。作为一种较为罕见且尚未被研究透彻的肉瘤的一种亚型,软骨肉瘤具有高度异质性并且难以治疗。因其对放疗和化疗不敏感,目前手术切除仍然是软骨肉瘤惟一有效的治疗方法[13]。而术后复发和转移是导致绝大多数软骨肉瘤患者预后不良的主要原因。研究表明,除了染色体异常等因素外,软骨肉瘤的发生发展还与多种癌基因的异常激活和肿瘤抑制因子的失活有关,但其发生发展的分子机制仍尚不清楚[14]。寻找影响软骨肉瘤细胞恶性生物学行为的致癌基因,并探讨调节软骨肉瘤生长和转移的分子机制将有助于开发新的治疗策略。
ROR2作为受体酪氨酸激酶家族(RTKs)成员之一参与多种肿瘤的发生发展。ROR2在肺癌、胃癌、鼻咽癌和肝癌中表达下调,而在头颈鳞癌、卵巢癌、乳腺癌、肾癌和骨肉瘤中表达上调,表明ROR2的表达失衡与多种恶性肿瘤的发展密切相关。早期的研究已发现,在胰腺导管腺癌中,ROR2表达上调与患者预后不良相关[15],在乳腺癌中,ROR2蛋白表达增高则促进肿瘤细胞发生侵袭和转移[16]。而在结直肠癌中,ROR2表达下调且可促进肿瘤细胞增殖和迁移[17]。以上研究结果表明,ROR2在不同恶性肿瘤中的发挥不同的功能。
ROR2在软骨肉瘤中的确切功能尚不清楚。为探讨ROR2在软骨肉瘤发生发展中的作用,本研究使用软骨肉瘤细胞系进行ROR2体外作用的研究。本实验将ROR2-SiRNA及NC-SiRNA分别转染入人软骨肉瘤SW1353 细胞后,qRT-PCR和Western blot检测各组细胞中ROR2 mRNA和蛋白的表达变化,用以检验转染效果。实验结果显示与空白对照组和NC组比较,ROR2-SiRNA组细胞中ROR2 mRNA和蛋白的表达水平均明显降低,提示小干扰RNA成功转染入人软骨肉瘤SW1353 细胞且显著抑制软骨肉瘤细胞中ROR2的表达。CCK-8法检测结果显示与空白对照组和NC组比较,ROR2-SiRNA组中软骨肉瘤细胞增殖受到明显抑制,这一结果证实ROR2具有促进软骨肉瘤细胞的增殖的作用。划痕实验及Transwell实验结果显示,与NC组比较,在抑制软骨肉瘤细胞中ROR2的表达后,ROR2-SiRNA组中软骨肉瘤细胞的迁移和侵袭能力明显降低,表明抑制ROR2的表达能够有效阻遏软骨肉瘤细胞的迁移迁移和侵袭。
通过本研究的一系列实验结果证实,靶向沉默ROR2的表达可以有效抑制软骨肉瘤细胞的恶性生物学行为,提示ROR2在软骨肉瘤中发挥促癌作用。
综上所述,ROR2在软骨肉瘤细胞中表达上调,靶向沉默ROR2表达可有效抑制软骨肉瘤细胞的增殖、迁移和侵袭。本研究探索了软骨肉瘤的发病机制并为后续软骨肉瘤的治疗提供了理论基础。

