混合谱系激酶结构域样蛋白、caspase-8及受体相互作用蛋白激酶3 mRNA在不同阶段乙型肝炎病毒感染患者中的表达及诊断价值
文正燕,孙传俊,杨献光
(1.新乡市传染病医院肝病科,河南 新乡 453000;2.新乡市传染病医院检验科,河南 新乡 453000;3.河南师范大学生命科学学院,河南 新乡 453000)
乙型肝炎病毒(hepatitis B virus,HBV)感染是一个全球性的重大医学问题,据统计,目前全世界约有3.5亿~4.0亿人长期感染HBV,每年约有100万人死于与HBV感染相关的疾病[1]。慢性HBV感染可导致慢性乙型肝炎(chronic hepatitis B,CHB)、肝硬化(liver cirrhosis,LC),并可能发展成为肝细胞肝癌(hepatocellular carcinoma,HCC),而HCC为全球第三大死亡原因[2]。积极探究HBV感染相关疾病的发生、发展机制并对其进行早期诊断和防治具有重要的意义。研究显示,CD8+和CD4+T细胞介导的免疫应答在HBV感染所致肝损害中起着重要作用,而程序性细胞坏死又可在一定程度上影响T细胞介导的免疫应答过程[3],然而,程序性细胞坏死在HBV感染相关疾病的发生、发展中的作用有待进一步明确。受体相互作用蛋白激酶(receptor interacting protein kinase,RIPK)3是程序性细胞坏死的关键调节因子,当RIPK3及其下游靶分子混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)表达上调,caspase-8活性受到抑制时,RIPK3与RIPK1结合并通过磷酸化形成坏死小体,从而导致程序性细胞坏死[4]。本研究通过分析MLKL、caspase-8及RIPK3 mRNA在不同阶段HBV感染患者外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中的表达水平,旨在探究MLKL、caspase-8及RIPK3 mRNA 表达水平对不同阶段HBV感染患者的鉴别价值,并为寻找潜在的治疗靶点提供参考。
1 资料与方法
1.1 一般资料
选择2016年11月至2019年11月新乡市传染病医院收治的175例HBV感染患者为研究对象。病例纳入标准:(1)均符合HBV感染诊断标准[5];(2)入组前未接受相关治疗。排除标准:(1)合并其他肝炎病毒感染者;(2)合并其他系统、器官恶性肿瘤者;(3)自身免疫性疾病患者;(4)因酒精、药物等因素导致的肝损伤患者。根据患者的HBV感染病情程度[5]将其分为CHB组(n=67)、LC组(n=61)和HCC组(n=47)。另选择同期于新乡市传染病医院体检的80例体检健康者为对照组,纳入标准:(1)既往无长期服药或酗酒史;(2)无肝炎病毒感染史;(3)无自身免疫性疾病。CHB组:男38例,女29例;年龄28~63(45.71±8.02)岁。LC组:男41例,女20例;年龄27~62(45.66±7.94)岁。HCC组:男33例,女14例;年龄28~64岁(45.93±8.16)岁。对照组:男48例,女32例;年龄28~65(45.84±7.99)岁。4组受试者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究通过医院医学伦理委员会审核批准,所有受试者知情同意并签署知情同意书。
1.2 方法
1.2.1 PBMC的采集
对照组受试者于体检当天采集空腹外周静脉血5 mL,CHB组、LC组、HCC组患者于入院后24 h内采集空腹外周静脉血5 mL,置于乙二胺四乙酸抗凝管中,采用淋巴细胞分离液分离PBMC。
1.2.2 实时荧光定量聚合酶链反应(quantitative real-time fluorescence polymerase chain reaction,qRT-PCR)法检测PBMC中MLKL、caspase-8及RIPK3 mRNA的表达
采用TRIzol试剂盒(北京百奥莱博科技有限公司)提取PBMC总RNA,测定总RNA浓度,采用反转录试剂盒(日本TaKaRa公司)将RNA反转录为cDNA,然后使用7500型荧光定量聚合酶链式反应(polymerase chain reaction,PCR) 仪(美国ABI公司),采用qRT-PCR法检测MLKL、caspase-8及RIPK3 mRNA表达水平。内参基因β-actin上游引物序列为5′-ATGGGTCAGAAGGATTCCTATGTG-3′,下游引物序列为5′-CTTCATGAGGTAGTCAGTCAGGTC-3′;目的基因MLKL上游引物序列为5′-GCCACTGGAAAGATCCCGTT-3′,下游引物序列为5′-CAACAACTCGGGGCAATCCT-3′;caspase-8上游引物序列为5′-CAAATGCAAACTGGATGATGAC-3′,下游引物序列为5′-AGCAGGCTCTTGTTGATTTGG-3′;RIPK3上游引物序列为5′-GAGACTCCCGGCTTAGAAGG-3′,下游引物序列为5′-TCCTTTACCGTGGAGACAGC-3′。引物由南京金斯瑞生物科技有限公司合成。qRT-PCR反应体系:2×SYBR Green Mix 5 μL,无RNase酶 2 μL,上游引物 1 μL,下游引物1 μL,cDNA 1 μL;qRT-PCR反应条件:95 ℃ 30 s预变性;95 ℃ 5 s变性,55 ℃ 30 s退火,72 ℃ 30 s延伸,45个循环。采用2-ΔΔCt法计算MLKL、caspase-8及RIPK3 mRNA相对表达量。
1.3 统计学处理

2 结果
2.1 4组受试者PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平比较
4组受试者PBMC中MLKL、RIPK3、caspase-8 mRNA表达水平比较差异有统计学意义(F=1 019.364、1 009.381、159.407,P<0.05);CHB组、LC组、HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平显著高于对照组,caspase-8 mRNA表达水平显著低于对照组,差异有统计学意义(P<0.05);LC组、HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平显著高于CHB组,caspase-8 mRNA表达水平显著低于CHB组,差异有统计学意义(P<0.05); HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平显著高于LC组,caspase-8 mRNA表达水平显著低于LC组,差异有统计学意义(P<0.05)。结果见表1。
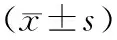
表1 4组受试者PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平比较Tab.1 Comparison of expression levels of MLKL,caspase-8 and RIPK3 mRNA in PBMC of subjects among the four groups
2.2 不同阶段HBV感染组患者PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平的相关性
Pearson相关检验结果显示,不同阶段HBV感染组患者PBMC中MLKL mRNA表达与RIPK3 mRNA表达呈正相关(r=0.414、0.432、0.449,P<0.01),MLKL mRNA表达与caspase-8 mRNA表达呈负相关(r=-0.556、-0.378、-0.721,P<0.01),RIPK3 mRNA表达与caspase-8 mRNA表达呈负相关(r=-0.415、-0.400、-0.416,P<0.01)。结果见表2。

表2 HBV感染不同阶段患者PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平的相关性Tab.2 Correlation of expression levels of MLKL,caspase-8 and RIPK3 mRNA in PBMC among the patients with different stages of HBV infection
2.3 PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平对HBV感染不同阶段的鉴别诊断价值
PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平鉴别CHB与HCC的AUC分别为0.918、0.859和0.912,三者联合鉴别CHB与HCC的AUC为0.945,三者单独及联合均对CHB与HCC有一定的鉴别诊断价值。PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平鉴别LC与HCC的AUC分别为0.768、0.834和0.839,三者联合鉴别LC与HCC的AUC为0.895,三者单独及联合均对CHB与HCC有一定的鉴别诊断价值。结果见表3、图1和图2。

图1 PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平鉴别诊断CHB与HCC的ROC曲线Fig.1 ROC curve of expression levels of MLKL,caspase-8 and RIPK3 mRNA in PBMC in differential diagnosing CHB and HCC
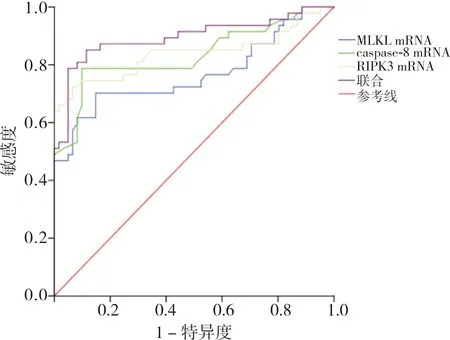
图2 PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平鉴别诊断LC与HCC的ROC曲线Fig.2 ROC curve of expression levels of MLKL,caspase-8 and RIPK3 mRNA in PBMC in differential diagnosing LC and HCC

表3 PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平对HBV感染不同阶段的鉴别诊断价值Tab.3 Differential diagnostic value of expression levels of MLKL,caspase-8 and RIPK3 mRNA in PBMC on different stages of HBV infection
3 讨论
HBV感染是一个全球性的公共卫生问题,也是我国CHB的主要病因,更是HCC发生的主要危险因素[6]。HBV感染所导致的HCC大多数发生在肝纤维化进展之后,但在轻度肝纤维化的病例中仍可能会发生HCC,提示HBV感染引起HCC的发生存在多种途径[7]。对高危人群进行早期筛查并给予及时有效的干预,可显著改善患者预后。血液具有收集方便、检测周期短以及敏感度高等优点,故血液生物学标志物在HCC早期诊断中具有重要价值。
程序性细胞坏死作为一种非典型的死亡方式,在不同类型的肿瘤中的作用复杂且多样[8]。RIPK1、RIPK3及MLKL是程序性细胞坏死中的关键调节因子,当程序性细胞坏死被触发后,可进一步激活RIPK1-RIPK3-MLKL信号通路,形成RIPK1-RIPK3-MLKL复合物,造成细胞破裂,并抑制caspase-8活性,进而介导程序性细胞坏死的发生[9]。若caspase-8切割位点发生突变,其介导的RIPK3引起的程序性细胞坏死则被抑制[10]。陈少慕等[11]研究显示,MLKL在非小细胞肺癌癌组织中呈低表达,可抑制RIPK1-RIPK3-MLKL信号通路,减少细胞死亡。另外,RIPK3在恶性间皮瘤[12]、结直肠癌[13]中表达降低,但在胶质瘤[14]、复发的乳腺癌[15]中表达升高。尽管已有研究证实了MLKL、caspase-8及RIPK3在程序性细胞坏死中的作用[16],但有关HBV感染不同阶段患者中MLKL、caspase-8及RIPK3表达的研究鲜有报道。本研究通过观察不同阶段HBV感染患者PBMC中MLKL、caspase-8及RIPK3 mRNA的表达水平,旨在探讨MLKL、caspase-8及RIPK3 mRNA表达水平对不同阶段HBV感染患者的鉴别诊断价值,并为寻找潜在的治疗靶点提供参考。
有研究报道,程序性细胞死亡中另一个关键的调节因子RIPK1在HCC中上调表达,并预示HCC患者预后不良,表明RIPK1可能在HCC中激活程序性细胞死亡过程[17]。而随着对RIPK3研究的不断深入,发现RIPK3能够通过调控程序性细胞死亡,影响肝脏损伤、病毒感染等进程[18]。AFONSO等[19]研究显示,RIPK3与人和小鼠非酒精性脂肪性肝病严重程度有关,并在肝脏代谢、损伤、炎症、纤维化以及致癌方面发挥着重要作用,RIPK3信号通路可作为治疗非酒精性脂肪性肝病的靶点。HAN等[20]研究则表明,RIPK3 mRNA在CHB、LC以及HCC中表达显著上调,与RIPK3相关的细胞因子同样发生了异常改变。本研究结果显示,与对照组相比,CHB组、LC组、HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平均显著增高,caspase-8 mRNA 表达水平均显著降低,提示MLKL、caspase-8及RIPK3可能参与了HBV感染过程;同时,LC组、HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平显著高于CHB组,caspase-8 mRNA表达水平显著低于CHB组;且HCC组患者PBMC中MLKL、RIPK3 mRNA表达水平显著高于LC组,caspase-8 mRNA表达水平显著低于LC组;提示MLKL、caspase-8及RIPK3可能参与了HBV感染所导致的CHB、LC及HCC的发展进程。
另外,本研究Pearson相关检验结果显示,HBV感染不同阶段患者PBMC中MLKL mRNA表达与RIPK3 mRNA表达呈正相关,MLKL mRNA表达与caspase-8 mRNA表达呈负相关,RIPK3 mRNA表达与caspase-8 mRNA表达呈负相关,提示MLKL、caspase-8及RIPK3这3个关键的程序性细胞坏死调节因子可能在HBV感染所导致的CHB、LC以及HCC进程中相互作用,共同发挥作用,进而推动HBV感染的进展,但目前尚缺乏三者在HBV感染致病机制中作用的相关报道,有待后续进一步研究。本研究ROC曲线显示,PBMC中MLKL、caspase-8及RIPK3 mRNA表达水平联合检测鉴别CHB和HCC的AUC为0.945,鉴别LC和HCC的AUC为0.895,提示MLKL、caspase-8及RIPK3 mRNA 表达水平可作为鉴别诊断HBV感染不同阶段的生物学标志物,通过检测MLKL、caspase-8及RIPK3 mRNA 表达水平,有助于CHB与HCC及LC与HCC的鉴别诊断,进而为HBV感染相关疾病的治疗提供指导。
4 结论
HBV感染不同阶段患者PBMC中MLKL、caspase-8及RIPK3 mRNA 表达水平显著上升,且三者之间存在显著相关性,MLKL、caspase-8及RIPK3 mRNA 表达水平可作为鉴别诊断不同阶段HBV感染的生物学标志物,这为HBV感染相关疾病的诊断及治疗提供指导。

