柴油机排放颗粒物对小胶质细胞氧化应激和炎症因子表达的影响及机制
张 玲,王 亚,徐 飞,杨亦舒,韩克阳,王韶澜,刘 源,杨 林,安 珍,李 娟,吴 辉,宋 杰,吴卫东
(1.新乡医学院公共卫生学院,河南 新乡 453003;2.镇江市高等专科学校卫生护理学院,江苏 镇江 212028)
目前,空气污染仍然是全球突出的环境和公共卫生问题,其不仅会导致呼吸和心血管系统疾病,还会对中枢神经系统造成不利影响,如增加神经退行性疾病发病风险[1]。柴油机排放颗粒物(diesel exhaust particle,DEP)是交通污染颗粒物的主要成分,也是城市PM2.5的主要来源[2]。DEP可以穿过血脑屏障到达大脑,造成神经毒性效应[3]。小胶质细胞是中枢神经系统固有免疫细胞,发挥着免疫监视功能,其分泌的炎症细胞因子可造成中枢神经系统炎症,与神经退行性病变密切相关[4]。研究表明,小胶质细胞可能在颗粒物引起的中枢神经损伤中发挥着重要作用[5-7]。为阐明大气污染颗粒物所致中枢神经系统毒性效应及其机制,本研究用DEP处理大鼠原代小胶质细胞和小鼠小胶质细胞株BV2,以期探讨DEP对小胶质细胞炎症因子表达的影响以及氧化应激在其中的作用。
1 材料与方法
1.1 实验动物及主要试剂与仪器
新生24 h内清洁级Sprague Dawley(SD)大鼠6只由新乡医学院实验动物中心提供; 胎牛血清购自美国 Gibco公司,小鼠小胶质细胞BV2购自青旗(上海)生物技术发展有限公司,达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自北京索莱宝生物科技有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)购自美国Abmole公司,乳酸脱氢酶、活性氧(reactive oxygen species,ROS) 检测试剂盒、抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)购自上海碧云天生物技术有限公司,β-actin、离子钙结合适配分子1(ionized calcium binding adaptor molecule 1,Iba1)抗体购自美国Affinity公司,引物由上海生工生物工程有限公司合成,肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)检测试剂盒购自武汉华美生物工程有限公司,DEP由美国北卡罗来纳大学环境医学中心馈赠;酶标仪购自日本Enspire 公司,流式细胞仪购自美国 BD 公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)仪购自瑞士Roche公司。
1.2 实验方法
1.2.1 大鼠原代小胶质细胞的分离
参考文献[8]中的方法进行原代小胶质细胞的分离。将6只新生大鼠放入4 ℃乙醇中浸泡麻醉,然后用预冷的体积分数75%乙醇浸泡消毒,无菌条件下开颅,快速取脑,置于预冷Hanks缓冲液中,在组织显微镜下仔细剔除脑膜和血管;迅速移入含25 g·L-1胰蛋白酶的离心管中,用巴氏吸管多次吹打脑组织至匀浆状,37 ℃水浴锅中消化20 min,加入含体积分数10%胎牛血清的 DMEM 完全培养基终止消化;细胞筛过滤后,4 ℃下250×g离心 5 min,之后将离心沉淀的细胞吹打制成单细胞悬液,接种于提前包被好Matrigel的T75培养瓶中,于37 ℃、含体积分数5%CO2恒温培养箱中培养7~9 d,拍打法收集小胶质细胞,用 CD11b 抗体标记收集到的细胞并于流式细胞仪上进行鉴定。
1.2.2 细胞培养
将大鼠原代小胶质细胞和BV2细胞按1×108L-1分别接种于 T25培养瓶中,培养瓶中加入含体积分数 10%胎牛血清和体积分数1%青链霉素的DMEM,于37 ℃、含体积分数5% CO2湿润培养箱中培养。每天观察细胞生长情况,待细胞达到70%~80%融合时,用胰蛋白酶消化传代。
1.2.3 CCK-8法检测大鼠原代小胶质细胞和BV2细胞的细胞活力
收集用胰蛋白酶消化后的大鼠原代小胶质细胞和BV2细胞,用含体积分数10%胎牛血清的DMEM制成单细胞悬液,以每孔(1.0~1.5)×108L-1接种于96孔板中,每孔100 μL。将细胞分为空白组、对照组和染毒组。将96孔板放入CO2培养箱中培养36 h,空白组细胞加入用细胞培养液稀释的CCK-8试剂;对照组细胞加入未经DEP刺激(0.0 mg·L-1DEP)的细胞培养液和CCK-8试剂;染毒组细胞分别用12.5、25.0、50.0 mg·L-1DEP悬液染毒24 h,每孔再加入10 μL CCK-8试剂温育1 h;然后用酶标仪检测波长450 nm处各孔的吸光度(absorbance,A)值。细胞活力=(染毒组A值-空白组A值)/(对照组A值-空白组A值)×100%。实验重复4次,取均值。
1.2.4 流式细胞仪检测大鼠原代小胶质细胞和BV2细胞中ROS水平
将原代小胶质细胞和BV2细胞以每孔1×105个细胞接种于12孔板中,37 ℃ 培养36 h后加入ROS探针(按1:1 000用无血清培养基稀释2,7-二氯荧光素二乙酸酯,终浓度为10 μmol·L-1),继续培养45 min,然后分别向孔内加入0.0、12.5、25.0、50.0 mg·L-1DEP悬液染毒6 h。用25 g·L-1胰蛋白酶200 μL消化细胞,加入500 μL磷酸盐缓冲液(phosphate buffered saline,PBS)终止消化,1 000 r·min-1离心5 min,弃上清并加入500 μL PBS重悬后立即上流式细胞仪测定细胞平均荧光强度(mean fluorescence intensity,MFI),以MFI值代表ROS水平。实验重复3次,取均值。
1.2.5 Western blot检测染毒后BV2细胞中Iba-1蛋白表达水平
将染毒后的BV2细胞以每孔1×105个细胞接种于12孔板。用放射免疫沉淀裂解液裂解BV2细胞,每孔加入裂解液400 μL于冰上裂解30 min,然后12 000 r·min-1离心15 min,取上清,用二喹啉甲酸法进行蛋白定量,加入5×loading后100 ℃煮蛋白10 min。按照说明书提前配制好分离胶和浓缩胶,胶凝固后进行蛋白上样,经过电泳、转膜、体积分数为5%脱脂牛奶封闭、一抗4 ℃ 过夜、洗膜、二抗孵育和洗膜后,上机显影,观察条带变化。并用Image J软件分析条带灰度值,以Iba1蛋白条带灰度值与内参β-actin条带灰度值的比值作为Iba1蛋白相对表达量。 实验重复3次,取均值。
1.2.6 qRT-PCR法检测BV2细胞中TNF-α和IL-10 mRNA 表达水平
采用TRIzol裂解法提取BV2细胞内总RNA,测定RNA在230、260、280 nm处的A值,计算其浓度和纯度后用反转录试剂盒将mRNA反转录为cDNA。β-actin上游引物序列为5′-AGGCGACAGCAGTTGGTTGGA-3′,下游引物序列为5′-TTGGGAGGGTGAGGGACTTCCT-3′;TNF-α上游引物序列为5′-CGCTCTTCTGTCTACTGAACTTCGG-3′,下游引物序列为5′-GTGGTTTGTGAGTGTGAGGGTCTG-3′;IL-10上游引物序列为5′-TGCCAAGCCTTATCGGAAATGATCC-3′,下游引物序列为5′-AGCCGCATCCTGAGGGTCTTC-3′。qRT-PCR反应体系20.0 μL,2×Universal SYBR qPCR Mix 10.0 μL,上下游引物各 0.2 μL,DNA模板1.0 μL,加水补齐20.0 μL。 反应程序:95 ℃ 预变性2 min;95 ℃ 15 s,60 ℃ 30 s,共40个循环;95 ℃ 15 s,60 ℃ 60 s,95 ℃ 1 s。以β-actin为内参基因,采用2-ΔΔCt法计算TNF-α、IL-10 mRNA的相对表达量。实验重复3次,取均值。
1.2.7 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测大鼠原代小胶质细胞培养液上清中TNF-α蛋白表达水平
将大鼠原代小胶质细胞按每孔(1~2)×105个接种于12孔培养板中,于37 ℃培养箱中温育36 h后,分别加入0.0、12.5、25.0、50.0 mg·L-1的DEP悬液染毒24 h。将培养液收集到EP管中,4 ℃,3 000 r·min-1离心15 min,取上清,采用ELISA试剂盒检测培养液上清中TNF-α蛋白水平。实验重复3次,取均值。
1.2.8 抗氧化剂NAC干预后大鼠原代小胶质细胞和BV2细胞中ROS水平检测
将大鼠原代小胶质细胞和BV2细胞按每孔1×105个接种于12孔板中,培养36 h后,吸出培养液,将12孔板平均分为对照组、DEP染毒组、NAC处理组、NAC+DEP组。对照组和DEP染毒组细胞用DMEM培养,NAC处理组和NAC+DEP组细胞给予5 mmol·L-1NAC预处理2~4 h;之后加入ROS探针(按1:1 000用无血清培养基稀释2′,7′-二氯二氢荧光素二乙酸酯,终浓度为10 μmol·L-1),温育45 min;对照组和NAC处理组加入DMEM培养基继续培养,DEP染毒组和NAC+DEP组加入DEP悬液(DEP终浓度为50 mg·L-1)染毒6 h。按“1.2.4”项中的方法上流式细胞仪检测细胞MFI。实验重复3次,取均值。
1.2.9 抗氧化剂NAC干预后BV2细胞内TNF-α和IL-10 mRNA表达水平检测
将BV2细胞以每孔1×105个接种于12孔板中,培养36 h后,将培养液上清吸出,将12孔板平均分为对照组、DEP染毒组、NAC处理组、NAC+DEP组。对照组和DEP染毒组细胞用DMEM培养,NAC处理组和NAC+DEP组细胞给予5 mmol·L-1NAC预处理2~4 h;然后对照组和NAC处理组加入DMEM继续培养,DEP染毒组和NAC+DEP组加入DEP悬液(DEP终浓度为50 mg·L-1)染毒12 h。收集细胞,用TRIzol裂解法提取mRNA,将mRNA反转录成cDNA,采用qRT-PCR 法检测细胞内TNF-α和IL-10 mRNA表达水平,方法同“1.2.6”项。实验重复6次,取均值。
1.2.10 抗氧化剂NAC干预后大鼠原代小胶质细胞中TNF-α蛋白表达检测
将大鼠原代小胶质细胞以每孔(1~2)×105个接种于12孔板中,置于37 ℃培养箱培养36 h后,吸出培养液上清,将12孔板平均分为对照组、DEP染毒组、NAC处理组、NAC+DEP组。对照组和DEP染毒组细胞用DMEM培养,NAC处理组和NAC+DEP组细胞给予5 mmol·L-1NAC预处理2~4 h;对照组和NAC处理组加入DMEM继续培养,DEP染毒组和NAC+DEP组加入DEP悬液(DEP终浓度为50 mg·L-1)染毒24 h。收集细胞培养液,3 000 r·min-1离心15 min,取上清,采用ELISA法检测上清液中TNF-α蛋白水平。实验重复3次,取均值。
1.3 统计学处理

2 结果
2.1 不同浓度DEP对小胶质细胞活力的影响
12.5、25.0、50.0 mg·L-1染毒组原代小胶质细胞的活力显著低于对照组,差异有统计学意义(P<0.05)。50.0 mg·L-1染毒组BV2细胞的活力显著低于对照组,差异有统计学意义(P<0.05);12.5、25.0 mg·L-1染毒组BV2细胞的活力与对照组比较差异无统计学意义(P>0.05)。结果见表1。
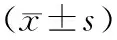
表1 不同浓度DEP组小胶质细胞活力的比较Tab.1 Comparison of cell activity of microglia among different concentration of DEP group
2.2 不同浓度DEP对小胶质细胞中ROS的影响
12.5、25.0、50.0 mg·L-1染毒组原代小胶质细胞中ROS水平显著高于对照组,差异有统计学意义(P<0.05)。25.0、50.0 mg·L-1染毒组BV2细胞中ROS水平显著高于对照组,差异有统计学意义(P<0.05);12.5 mg·L-1染毒组与对照组BV2细胞中ROS水平比较差异无统计学意义(P>0.05)。结果见表2。
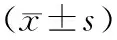
表2 不同浓度DEP组小胶质细胞中ROS水平比较Tab.2 Comparison of ROS level in microglia among different concentration of DEP group
2.3 不同浓度DEP对BV2细胞中Iba1蛋白表达的影响
12.5、25.0、50.0 mg·L-1染毒组BV2细胞中Iba1蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05);随着DEP浓度的增加,Iba-1蛋白表达呈升高趋势。结果见图1和表3。
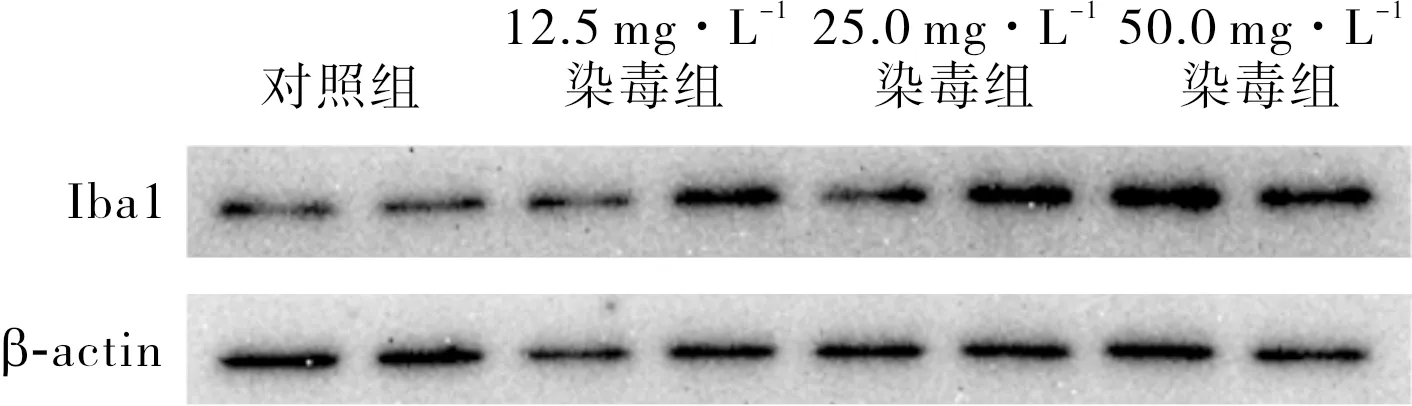
图1 不同浓度DEP组BV2细胞中Iba-1蛋白表达水平Fig.1 Expression level of Iba1 protein in BV2 cells in different concentration of DEP group
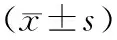
表3 不同浓度DEP组BV2细胞中Iba1蛋白相对表达量比较Tab.3 Comparison of relative expression of Iba1 protein in BV2 cells among different concentration of DEP group
2.4 不同浓度DEP组BV2细胞中TNF-α、IL-10 mRNA相对表达量比较
12.5、25.0、50.0 mg·L-1染毒组BV2细胞中TNF-α mRNA相对表达量显著高于对照组,差异有统计学意义(P<0.05);50.0 mg·L-1染毒组BV2细胞中IL-10 mRNA相对表达量显著高于对照组,差异有统计学意义(P<0.05); 12.5、25.0 mg·L-1染毒组与对照组BV2细胞中IL-10 mRNA相对表达量比较差异无统计学意义(P>0.05)。结果见表4。
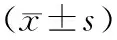
表4 不同浓度DEP组BV2细胞中TNF-α、IL-10 mRNA相对表达量比较Tab.4 Comparison of relative expression of TNF-α and IL-10 mRNA in BV2 cells among different concentration of DEP group
2.5 不同浓度DEP对大鼠原代小胶质细胞中TNF-α蛋白表达的影响
12.5、25.0、50.0 mg·L-1染毒组大鼠原代小胶质细胞中TNF-α蛋白表达量显著高于对照组,差异有统计学意义(P<0.05),见表5。
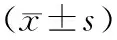
表5 不同浓度DEP组对大鼠原代小胶质细胞中TNF-α蛋白表达水平的比较Tab.5 Comparison of expression level of TNF-α protein in primary microglia of rats among different concentration of DEP group
2.6 NAC对DEP暴露后小胶质细胞内ROS水平的影响
DEP染毒组原代小胶质细胞和BV2细胞中ROS水平显著高于对照组,差异有统计学意义(P<0.05);NAC处理组原代小胶质细胞中ROS水平显著低于对照组,差异有统计学意义(P<0.05);NAC处理组与对照组BV2细胞中ROS水平比较差异无统计学意义(P>0.05);NAC+DEP组原代小胶质细胞和BV2细胞中ROS水平显著低于DEP染毒组,差异有统计学意义(P<0.05)。结果见表6。
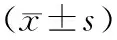
表6 不同NAC预处理组小胶质细胞中ROS水平的比较Tab.6 Comparison of ROS levels in microglia among different NAC pretreated group
2.7 NAC对DEP暴露后BV2细胞中TNF-α、IL-10 mRNA相对表达量的影响
DEP染毒组BV2细胞中TNF-α、IL-10 mRNA相对表达量显著高于对照组,差异有统计学意义(P<0.05);NAC处理组与对照组BV2细胞中TNF-α、IL-10 mRNA相对表达量比较差异无统计学意义(P>0.05);NAC+DEP组BV2细胞中TNF-α mRNA相对表达量显著低于DEP染毒组,差异有统计学意义(P<0.05);NAC+DEP组 与DEP染毒组BV2细胞中IL-10 mRNA相对表达量比较差异无统计学意义(P>0.05)。结果见表7。
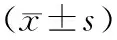
表7 不同NAC预处理组BV2细胞中TNF-α、IL-10mRNA相对表达量比较Tab.7 Comparison of relative expression of TNF-α and IL-10 mRNA in BV2 cells among different NAC pretreated group
2.8 NAC对DEP暴露后大鼠原代小胶质细胞中TNF-α蛋白表达的影响
DEP染毒组原代小胶质细胞中TNF-α蛋白表达水平显著高于对照组,差异有统计学意义(P<0.05);NAC处理组与对照组原代小胶质细胞中TNF-α蛋白表达水平比较差异无统计学意义(P>0.05);NAC+DEP组原代小胶质细胞中TNF-α蛋白表达水平显著低于DEP染毒组,差异有统计学意义(P<0.05)。结果见表8。
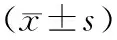
表8 不同NAC预处理组大鼠原代小胶质细胞中TNF-α蛋白表达水平比较Tab.8 Comparison of the expression of TNF-α protein in primary microglia of rats among different NAC pretreatment group
3 讨论
空气污染物是一种复杂的化学混合物,来源广泛,包括发动机排放、煤炭燃烧、生物质燃烧、火山喷发和二次光化学产物[9]。有研究表明,空气污染与慢性呼吸系统疾病、心血管疾病和代谢障碍的发生发展有关[10-11]。COSTA等[12]研究发现,空气污染还与中枢神经系统不良反应的风险增加有关。DEP是主要的城区污染物,DEP染毒浓度根据已有研究确定[13],本研究采用DEP染毒大鼠原代小胶质细胞和小鼠小胶质细胞,探讨DEP对2种细胞中炎症因子表达的影响及其潜在机制。
小胶质细胞是脑实质的髓系细胞,具有免疫前哨细胞的功能,是疾病发生时中枢神经系统炎症介质的主要来源[4,14],其炎症反应是包括阿尔兹海默病在内的许多神经退行性疾病的核心机制[15]。小胶质细胞可在体内多种因素(如Aβ和促炎细胞因子)的刺激下被激活[16],也可以被环境污染物激活,如柴油尾气颗粒物[17]等。Iba-1表达增加是小胶质细胞激活的标志,本研究结果证实,DEP染毒后BV2细胞中Iba-1的表达升高,且呈剂量依赖性,说明小胶质细胞可以被DEP激活。有研究发现,暴露于DEP后,小胶质细胞内产生的ROS有所升高[18],而小胶质细胞是大脑中ROS的主要来源,这就将空气污染与中枢神经系统疾病联系起来。
空气污染会导致神经炎症和氧化应激,有研究报道,大鼠吸入DEP 1个月后可使其额叶皮层中促炎细胞因子TNF-α mRNA表达增加,进一步证明DEP暴露可引发神经炎症[19]。有研究显示,呼吸道灌注DEP可增加大鼠脑组织中TNF-α的表达[10]。本研究结果显示, DEP暴露可使小胶质细胞中TNF-α表达增加,即小胶质细胞活化。
为探讨氧化应激是否在炎症因子表达中发挥作用,本研究采用抗氧化剂NAC预处理小胶质细胞,结果发现,NAC可以抑制小胶质细胞因染毒DEP而导致的炎症因子TNF-α mRNA和蛋白的升高,说明氧化应激在小胶质细胞炎症反应中发挥着重要作用。TNF-α的产生部分依赖于核因子-κb(nuclear factor kappa-B,NF-κB)通路,ROS与NF-κB信号通路有多种相互作用,NF-κB依赖基因的转录影响细胞内ROS水平,反过来,NF-κB活性水平也受ROS水平的调节,ROS能够以多种方式在多个位置同时发挥作用调节NF-κB通路[20],这可能是氧化应激调节炎症细胞因子的机制之一。DEP所致IL-10的升高并不受氧化应激抑制剂NAC的影响,说明IL-10的产生过程可能不受氧化应激的影响,具体机制还有待进一步研究。
4 结论
DEP暴露后小胶质细胞氧化应激以及炎症因子表达增加,氧化应激在DEP诱导的TNF-α表达过程中发挥重要作用。本研究为进一步阐明颗粒污染物的神经毒性作用及其机制,制定干预空气污染诱发神经退行性变的有效措施提供重要依据。

