刺玫瑰组织培养研究
张文杰,任杰,刘志泰,李岩,胡展森,刘小花,巴金磊
(1.承德市农林科学院,河北 承德 067060;2.承德市农村土地承包经营权流转管理服务中心,河北 承德 067000)
刺玫瑰是承德市的市花,为蔷薇科蔷薇属直立灌木,高约1.5 m,羽状复叶,花色艳丽,香气四溢,花期6—8 月,果期8—10 月。刺玫瑰中含有多种维生素和矿物质,不但具有观赏价值,更具有药用和食用价值,其种子、花瓣可提炼玫瑰精油、果酱和玫瑰酒。因此,积极探索刺玫瑰快繁技术是大力发展玫瑰产业、助力乡村振兴的重要途径。
1 材料与方法
1.1 试验材料
供试材料取自承德市农林科学院承德县石灰窑基地栽培的2 年生以上的刺玫瑰。
1.2 外植体接种
于晴天中午,取生长良好、健康、无病虫害刺玫瑰当年生枝条的上部嫩茎,迅速带回实验室。剪除叶柄及叶片,切成2~3 个芽的小段置于烧杯上,用流动的自来水冲洗20~30 min。在超净工作台上,烧杯中加入75%酒精摇动杀菌10 s,无菌水冲洗4~5 次,后用0.1%升汞消毒6 min,无菌水冲洗4~5 次,之后用无菌滤纸吸干水分,准备接种[1]。
1.3 初代培养
1.3.1 培养基激素种类与配比对组培苗初代培养的影响。基本培养基为MS+白砂糖30 g/L+琼脂6 g/L,pH 5.8~6.0,附加6-BA、NAA 和GA3,共12 个处理(表1),每个处理10瓶,每瓶2 株,重复3 次。接种材料均为生长状况一致的刺玫瑰无菌苗,培养条件:培养温度为25℃左右,光照强度为2 500 lx,光照时间为12 h/d。生长30 d 后调查组培苗的启动率及平均芽长[2]。
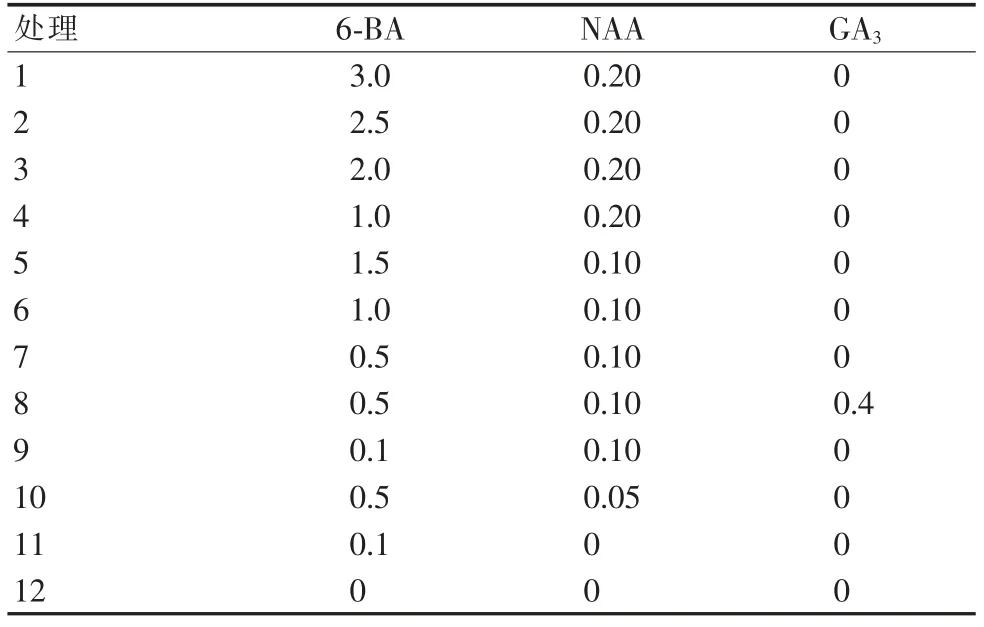
表1 初代培养基中不同激素组合mg/L
1.3.2 外植体取材时间对组培苗初代繁殖的影响。外植体取材时间的选择对于组培有着重要的影响。每月20 日取材,以MS 为基本培养基,附加30 g/L 蔗糖、6 g/L 琼脂和6-BA 1.5 mg/L、NAA 0.10 mg/L 的生长调节剂。观察芽体萌发生长情况,并及时记录。培养条件:培养温度为25℃左右,光照强度为2 500 lx,光照时间为12 h/d[3]。
1.4 继代培养
基本培养基为MS+ 白砂糖30 g/L+ 琼脂6 g/L,pH 5.8~6.0,附加6-BA、NAA、GA3,共11 个处理(表2),每个处理10 瓶,每瓶2 株,重复3 次。接种材料均为生长状况一致的刺玫瑰无菌苗,培养条件:培养温度为25℃左右,光照强度为2 500 lx,光照时间为12 h/d。生长30 d 后调查组培苗的增殖系数、愈伤组织数量。
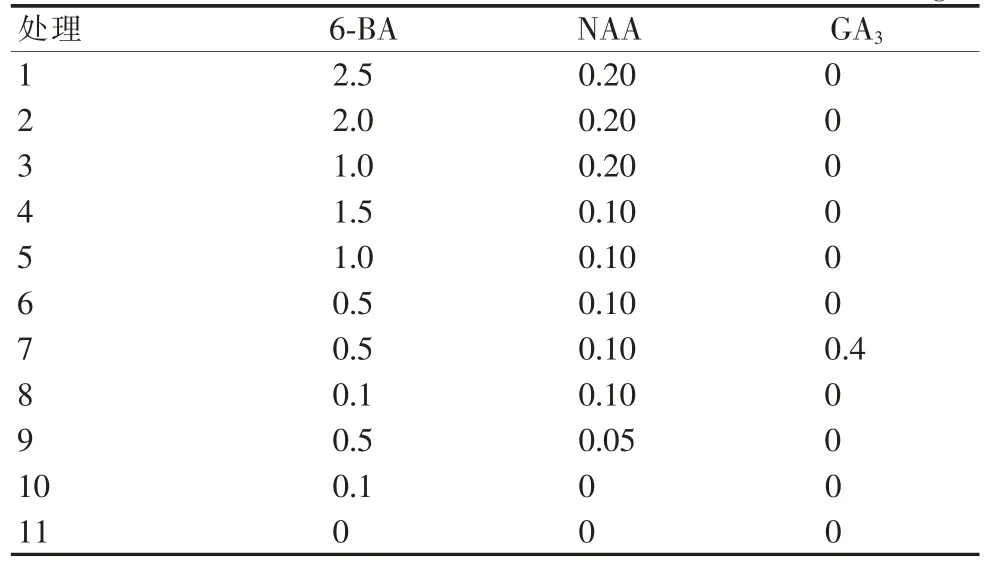
表2 继代培养基中不同激素组合mg/L
1.5 生根培养
基本培养基为1/2 MS+白砂糖25 g/L,分别附加0.5、1.0、1.5 mg/L IBA,MS 不加激素,4 个处理。接种材料选取同一苗龄的继代苗单株,株高1.5 cm 以上,生长状况一致。培养30 d 后调查组培苗的生根情况。
2 结果与分析
2.1 初代培养
植物激素的浓度和组合对植物的生长、器官分化起着至关重要的作用。由表3 可知,不同激素浓度对刺玫瑰的不定芽分化有着不同影响。当NAA 浓度为0.20 mg/L时,随着6-BA 浓度的降低,平均芽长也随之提高,可见6-BA 浓度较高影响刺玫瑰分化。当NAA 浓度为0.10 mg/L时,随着6-BA 浓度的降低,平均芽长也随之下降。因此,最适宜刺玫瑰初代培养的培养基为MS+6-BA 1.5 mg/L+NAA 0.10 mg/L,其平均芽长达到最大。
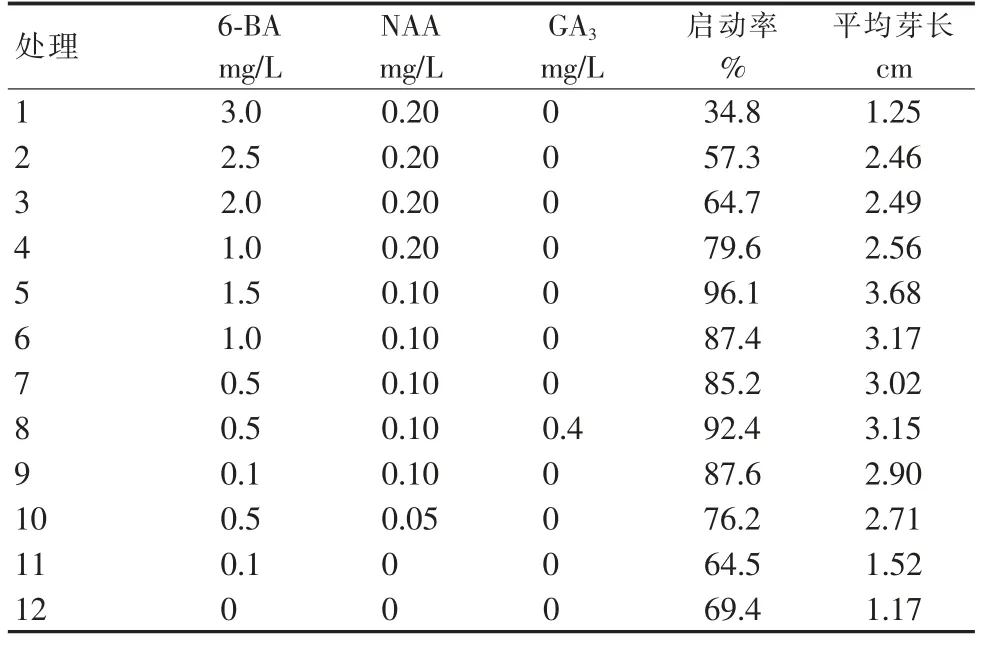
表3 初代培养基中不同激素组合生长情况
2.2 不同取材时间对污染率的影响
刺玫瑰在承德地区4 月底发芽,10 月中旬夜间温度低于0℃出现冻害,因此该文讨论时间为5—9 月。由图1可以看出,5—9 月,外植体污染率逐渐上升。具体表现为5月接种,污染率最低,仅为5.20%;6 月接种污染率增至6.40%;7 月接种污染率急剧上升为26.40%,是5 月的5.08倍;8 月、9 月接种污染率继续上升,9 月接种污染率达全年最高,为37.40%,是5 月的7.71 倍。试验中观察到5—8月,外植体的污染以细菌性污染为主,随着气温的上升和阴雨气候的增加,有效增加了外植体的污染率。9 月由于气温下降,细胞活性下降,细菌污染率降低,霉菌污染升高,枝条逐渐进入衰退期。综合分析取材时间对外植体污染率的影响,发现5 月是刺玫瑰取材的最佳时期。
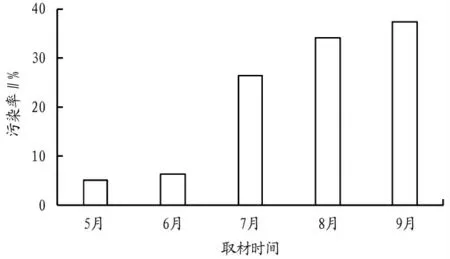
图1 不同取材时间对污染率的影响
2.3 继代培养
由表4 可知,在MS+6-BA 2.0 mg/L+NAA 0.20 mg/L 的培养基下,刺玫瑰继代培养增殖系数最高,丛生芽粗壮,叶片深绿,为最佳的继代培养基。愈伤组织对于组培苗的快速分化有着重要作用,刺玫瑰的无菌丛生芽经过一定的激素诱导能产生愈伤组织,愈伤组织迅速膨大,白黄色,后期利用MS+TDZ 2 mg/L+IBA 0.5 mg/L 进行愈伤组织诱导,其出愈率不高,褐化率较高,后期还需进一步研究。
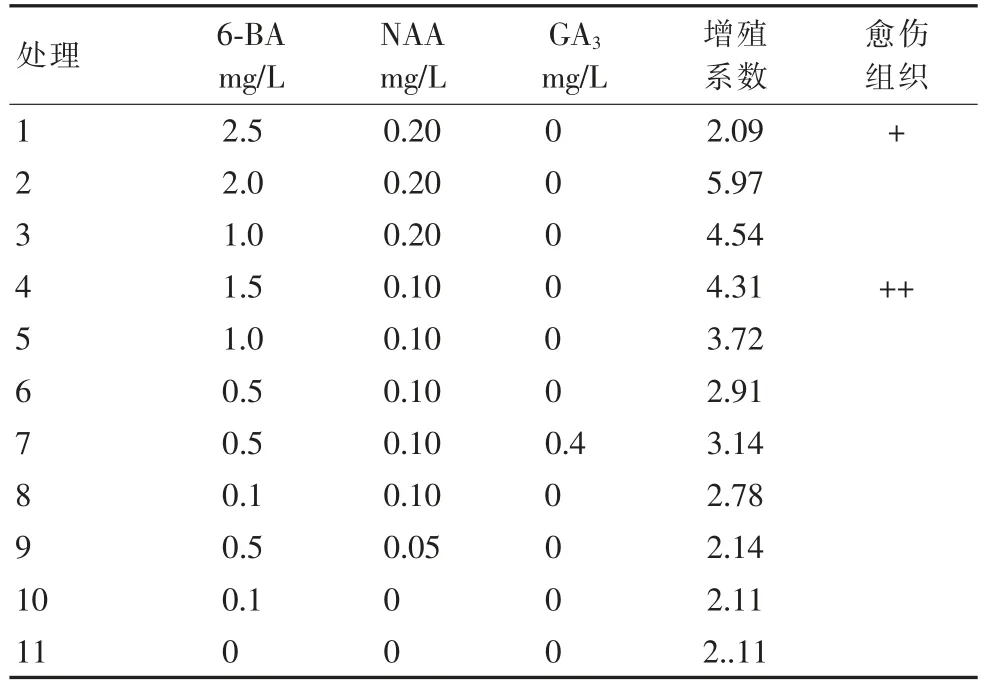
表4 继代培养基中不同激素组合生长情况
2.4 生根培养
由表5 可知,附加1.0~1.5 mg/L IBA 均能获得较高的生根率,考虑生根条数的差异,1/2 MS+IBA 1.0 mg/L 的生根率最高。在刺玫瑰的生根培养基中,无激素MS 空白培养基也能诱导生根。

表5 生根培养基中不同激素组合生长情况
3 讨论
刺玫瑰组培苗在培养过程中易产生玻璃化和黄化现象,可能与培养瓶中湿度过大或激素浓度过高有关,需迅速转接至新的培养基里,因此,探索最适宜的培养基浓度还需进一步试验[4]。组培苗可以保证种苗形态一致,有利于工厂化生产,从而助力承德地区发展乡土花卉。

