不同处理对濒危植物千果榄仁种子发芽的影响*
余 潇,赵振宁,邓莉兰
(1.西南林业大学园林园艺学院,云南 昆明 650224;2.西南林业大学林学院,云南 昆明 650224)
千果榄仁(TerminaliamyriocarpaVan Huerck et Muell.-Arg.),又名大马缨子花、千红花树,为使君子科诃子属的常绿高大乔木[1],是国家二级重点保护野生植物,一般多散生于河岸和沟谷地带的热带雨林、季雨林及南亚热带季风常绿阔叶林中.千果榄仁材质优良,生长快,是一种值得发展的速生造林树种[2],常与团花树、八宝树、南酸枣一起组成当地习见的林内上层高大乔木[3],适宜在我国西南部中低海拔山地、丘陵,土壤较湿润的地区造林[2].由于常年乱砍滥伐及毁林开荒,树种资源破坏极大,目前千果榄仁已临近濒危.千果榄仁木材坚硬,可作车船和建筑用材.近年来,千果榄仁也逐渐被试种应用到园林景观中,其满树繁花,花色是明艳的红色,特别惹人瞩目,具有较高的观赏应用价值.千果榄仁所表现出的优良特性,导致其种苗供不应求,如何大量繁育优质种苗成为千果榄仁产业发展的关键.
目前,千果榄仁的人工繁育仍处于起步阶段[4],而千果榄仁大量的种苗需求与种苗紧缺之间的矛盾迫切需要建立种苗快速繁育体系,种子繁殖作为千果榄仁繁殖的主要方法之一,是一种高效、绿色、经济的种苗培育方式.基于此,本研究以千果榄仁种子为材料,通过对种子进行休眠破除处理和常温储藏后,探讨不同外源激素赤霉素(GA3)、萘乙酸(NAA)和培养温度对种子发芽的影响,旨在为千果榄仁种子繁殖提供实践依据.
1 材料与方法
1.1 试验材料
供试材料种子分别采自于云南省瑞丽市户育乡班岭村(北纬24°6′50.63″,东经97°58′41.75″,海拔886 m)及云南省镇沅县哀牢山国家级自然保护区(北纬N23°56′8.00″,东经E101°25′38.58″,海拔1 792 m).种子的采收时间为千果榄仁种子后熟的2~3月份[4],采集后将所有种子混合,去除种子中的杂质,风干备用.
1.2 千果榄仁种子发芽率测定
千果榄仁种子发芽率的测定分室外和室内试验两部分.室内试验开始前,先将种子平均分成2份,用质量分数为0.1%的高锰酸钾溶液对种子进行消毒处理[5].消毒后,2份种子采用不同的储藏方式储藏,一份种子采取休眠破除处理,即将种子放置在4 ℃左右冰箱内30 d;另一份则置于常温环境下储藏30 d.
(1)室外试验(空白对照CK1):室外试验在培养基(培养基质为泥炭土、珍珠岩和蛭石3种基质按质量比1∶1∶1混合,并用多菌灵消毒)上进行.首先测定千果榄仁的千粒重,其次根据测定的千粒重称取种子,每1万粒种子为1组,将种子均匀播种在穴盘(660 mm×335 mm)中,设3组重复.密切观察,15 d后测定每穴盘的出苗量,并计算单位面积的发芽率[5],公式为
γ= (n/N)×100%.
其中:γ为发芽率,n为发芽的种子数量,N为供检测种子的总粒数.
(2)室内试验:试验采用多因素随机试验设计,先将生长调节剂(GA3,NAA)配制为5个质量浓度梯度组(20,40,60,80,100 mg/L),同时设置1个蒸馏水空白对照组(CK2),空白对照组种子为未经休眠破除处理和生长调节剂处理的种子.再分别用不同质量浓度的GA3和NAA溶液将经过休眠破除处理和常温储藏的种子浸泡1 d,空白对照组种子用蒸馏水浸泡1 d.最后把种子放置在有湿润滤纸的培养皿中进行播种试验.播种试验处理分为4种,即恒温培养条件下,培养不同质量浓度生长调节剂浸泡过并经休眠破除处理的种子;变温培养条件下,培养不同质量浓度生长调节剂浸泡过并经休眠破除处理的种子;恒温培养条件下,培养不同质量浓度生长调节剂浸泡过且经常温储藏的种子;变温培养条件下,培养不同质量浓度生长调节剂浸泡过且经常温储藏的种子.恒温培养条件下,设置温度25 ℃,相对湿度80%,光照强度6 100~6 200 lux,每个处理组的试验种子为100粒,重复3次[5];变温培养条件下,1:00—8:00设置温度15 ℃,8:00—20:00设置温度25 ℃,20:00—1:00设置温度15 ℃,相对湿度80%,光照强度6 100~6 200 lux.每个生长调节剂处理组和蒸馏水空白对照组的试验种子为100粒,重复3次[5].每天对种子进行消毒处理并增加生长供水,密切观察,做好记录,从种子萌芽开始直到发芽完成,计算种子发芽率,发芽率计算公式与室外试验一致.
1.3 数据分析
采用Excel 2018对试验数据进行初步整理,使用SPSS 22.0软件进行单因素方差分析(One-way ANOVA),显著水平设为0.05,利用Origin 2020软件进行绘图.
2 结果
2.1 千果榄仁播种繁殖影响因子
为更清楚了解到不同处理因素及组合对千果榄仁种子发芽率的影响,对千果榄仁种子发芽影响因子进行多因素方差分析.从表1可知,生长调节剂种类、质量浓度、种类/质量浓度、种类/质量浓度/培养温度对千果榄仁种子发芽率的影响极显著(P<0.01),质量浓度/培养温度、种类/质量浓度/储藏方式、种类/培养温度/储藏方式对千果榄仁种子的发芽率影响显著(P<0.05).而培养温度、储藏方式、种类/培养温度、种类/储藏方式、质量浓度/储藏方式、培养温度/储藏方式、质量浓度/培养温度/储藏方式、种类/质量浓度/培养温度/储藏方式对千果榄仁种子的发芽率影响不显著(P>0.05).在本试验条件下,对千果榄仁种子播种繁殖生根率的影响因素进行排序,由大到小依次为生长调节剂种类、质量浓度、培养温度、储藏方式.

表1 不同处理对千果榄仁种子发芽率的影响因子分析Table 1 Impact Factors for Germination Rate of T. myriocarpa Seeds Treated in Different Conditions
2.2 生长调节剂对种子发芽率的影响
种子经过休眠破除处理,在恒温培养条件下,不同质量浓度生长调节剂处理的种子发芽率如图1(a)所示.在此条件下,不同质量浓度GA3,NAA处理对种子发芽率有明显的影响.在GA3处理下,质量浓度为40 mg/L时,种子发芽率最高,为40%,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了36.76%,33.9%;质量浓度为20 mg/L时,种子发芽率最低,为10.6%,分别较CK1,CK2升高了7.36%,4.5%.在NAA处理下,质量浓度为60 mg/L时,种子发芽率最高,为27.8%,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了24.56%,21.7%;质量浓度为100 mg/L时,发芽率最低,为9.8%,分别较CK1,CK2升高了6.56%,3.7%.
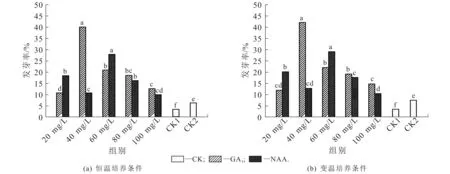
图中同一生长调节剂不同小写字母表示同一生长剂不同组别间差异显著(P<0.05).图1 不同培养条件下生长调节剂对千果榄仁种子发芽率的影响(休眠破除处理种子)Fig. 1 Effect of Exogenous Hormone on Germination Rate of T. myriocarpa Seeds inHibernation and Different Culture Conditions
种子经过休眠破除处理,在变温培养条件下,不同质量浓度生长调节剂处理的种子发芽率如图1(b)所示.
在此条件下,不同质量浓度GA3,NAA处理对种子发芽率有明显的影响.在GA3处理下,质量浓度为40 mg/L时,种子发芽率最高,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了38.76%,34.7%;质量浓度为20 mg/L时,种子发芽率最低,分别较CK1,CK2升高了8.56%,4.5%.在NAA处理下,质量浓度为60 mg/L时,种子发芽率最高,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了25.76%,21.7%;质量浓度为100 mg/L时,发芽率最低,分别较CK1,CK2升高了7.06%,3%.
种子经过常温储藏,在恒温培养条件下,不同质量浓度生长调节剂处理的种子发芽率如图2(a)所示.在此条件下,不同质量浓度GA3处理对种子发芽率有明显的影响.5种不同质量浓度梯度中,质量浓度为40 mg/L时,种子发芽率最高,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了24.96%,22.6%;而质量浓度为20 mg/L时,种子发芽率最低,分别较CK1,CK2升高了6.06%,3.7%.NAA处理下,质量浓度为60 mg/L时,种子发芽率最高,为19.1%,发芽率显著高于质量浓度为100 mg/L的NAA处理和CK1,CK2,但与质量浓度为40 mg/L处理间差异不具有统计学意义(P>0.05).
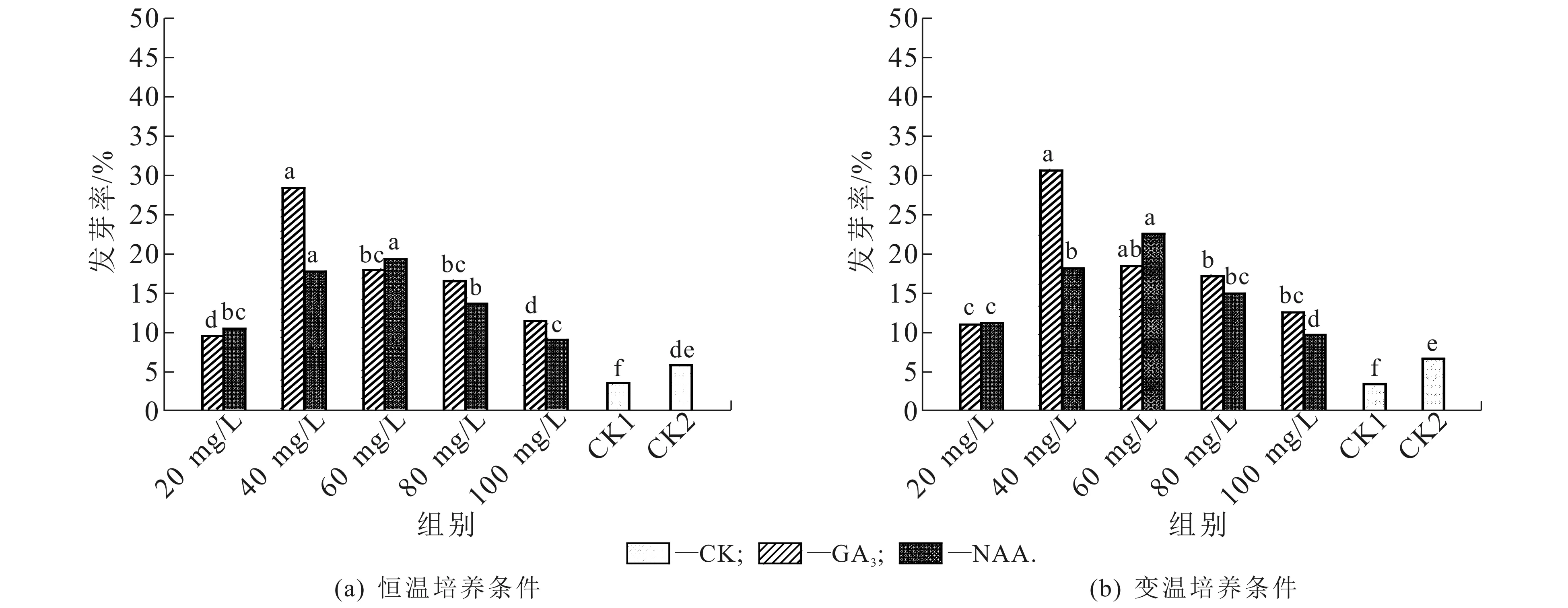
图中同一生长调节剂不同小写字母表示同一生长剂不同组别间差异显著(P<0.05).图2 不同培养条件下生长调节剂对千果榄仁种子发芽率的影响(常温储藏种子)Fig. 2 Effect of Exogenous Hormone on Germination Rate of T. myriocarpa Seeds in Indoor Temperature Preservation and Different Culture Conditions
种子经过常温储藏,在变温培养条件下,不同质量浓度生长调节剂处理的种子发芽率如图2(b)所示.在此条件下,不同质量浓度GA3,NAA处理对种子发芽率有明显的影响.在GA3处理下,5种不同质量浓度中,质量浓度为40 mg/L时,种子发芽率最高,为30.5%,显著高于同一调节剂下的其他处理(P<0.05),分别较CK1,CK2升高了27.26%,24%;质量浓度为20 mg/L时,种子发芽率最低,为10.8%,分别较CK1,CK2升高了7.56%,4.3%.在NAA处理下,质量浓度为60 mg/L时,种子发芽率最高(22.4%),显著高于NAA的其他处理(P<0.05),分别较CK1,CK2升高了19.16%,15.9%;质量浓度为100 mg/L时,种子发芽率最低(9.5%),分别较CK1,CK2升高了6.26%,3%.
2.3 培养温度对种子发芽率的影响
种子经过低温休眠破除处理,在相同质量浓度生长调节剂条件下,培养温度对种子发芽率的影响如图3(a)所示.在GA3溶液中,变温培养条件下的种子发芽率总是高于恒温培养条件下的发芽率,但二者发芽率差异无统计学意义.无论是变温培养还是恒温培养,GA3溶液质量浓度为40 mg/L时,种子发芽率最高,说明此时的千果榄仁种子具有较高的种子活力.种子在NAA溶液处理下,变温培养的发芽率均高于恒温培养的发芽率,在NAA溶液的质量浓度为20 mg/L和40 mg/L时,变温培养和恒温培养的种子发芽率差异值较大,差异值分别为2%和2.5%.随着溶液质量浓度升高,差异值逐渐变小,尤其在质量浓度为100 mg/L时,说明高质量浓度的NAA溶液不利于种子的萌发.综上,经休眠破除处理后的种子在相同质量浓度生长调节剂作用下,变温培养比恒温培养更有利于种子萌发.

图3 培养温度对休眠破除处理种子、常温储藏种子发芽率的影响Fig. 3 Influence of Culture Temperature on Germination Rate of T. myriocarpa Seeds in Hibernation and Indoor Temperature Preservation
种子经过常温储藏处理,在相同质量浓度生长调节剂条件下,培养温度对种子发芽率的影响如图3(b)所示.在GA3溶液中,变温培养的种子发芽率高于恒温培养的种子发芽率,恒温、变温对种子发芽率的影响差异无统计学意义(P>0.05).变温、恒温培养条件下,均呈现出GA3溶液质量浓度为40 mg/L时,种子发芽率最高.在低质量浓度(20~40 mg/L)NAA溶液处理下,恒温、变温对种子发芽率影响不明显(P>0.05),而在NAA溶液质量浓度达到60 mg/L时,变温培养种子发芽率与恒温培养种子发芽率表现出显著差异(P<0.05),发芽率差异值为3.3%.随着NAA溶液质量浓度从60 mg/L升至100 mg/L,变温、恒温培养的种子发芽率差异逐渐减小.从相同质量浓度GA3和NAA溶液,不同培养温度表现出的发芽率差异证明温度波动在千果榄仁种子萌芽过程中有较大的促进作用,种子经过常温保存,相同质量浓度生长调节剂处理,变温培养更有利于提高种子发芽率.
2.4 休眠破除处理对种子发芽率的影响
恒温培养条件下,休眠破除处理、常温储藏对千果榄仁种子发芽率的影响如图4(a)所示.GA3溶液中,休眠破除处理的种子发芽率均高于常温储藏的种子发芽率.当GA3溶液质量浓度为40 mg/L时,休眠破除处理的种子发芽率与常温储藏的种子发芽率表现出极显著差异(P<0.01),差异值为11.8%.NAA溶液中,种子发芽率基本呈现出休眠破除处理高于常温储藏,NAA溶液质量浓度为40 mg/L时,休眠破除处理的种子发芽率明显低于常温储藏的种子发芽率,其原因还需进一步研究探讨.当NAA溶液质量浓度为20,40,60 mg/L时,经休眠破除处理和常温储藏的种子发芽率表现出极显著差异(P<0.01),差异值分别为8.1%,6.9%,8.7%.在恒温培养条件下,CK2经休眠破除处理的种子发芽率为6.1%,经常温保存处理的种子发芽率为5.6%.
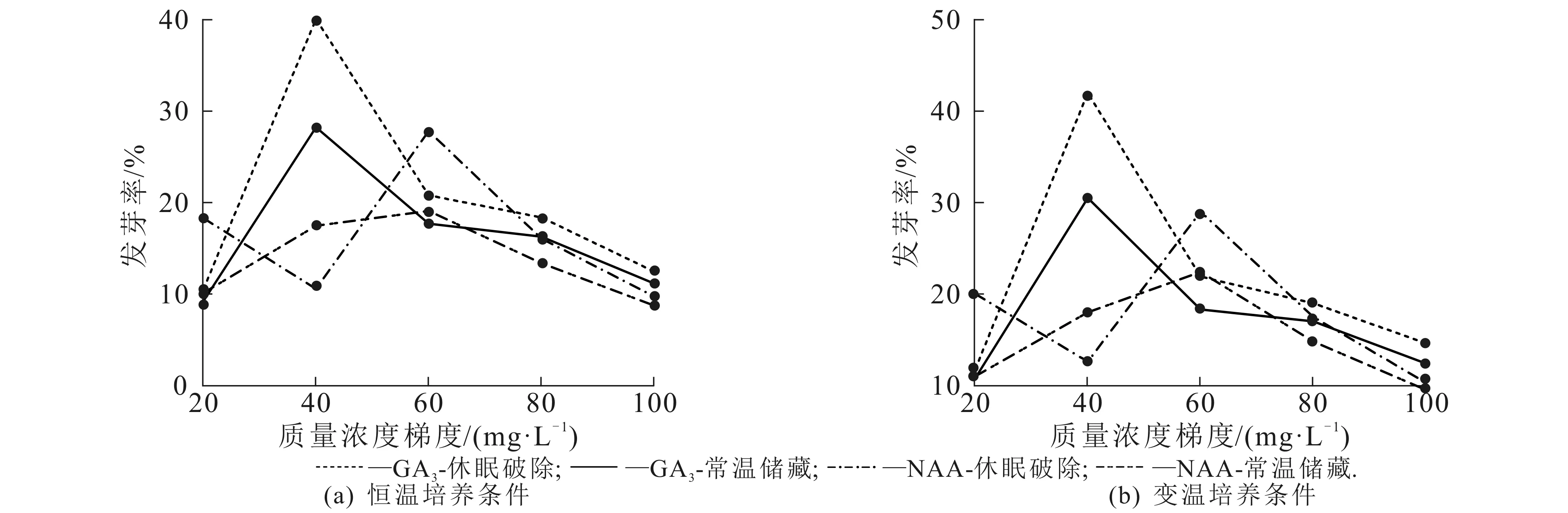
图4 不同培养条件下休眠破除处理与常温储藏对种子发芽率的影响Fig. 4 Influence of Hibernation and Indoor Temperature Preservation on Germination Rate of T. myriocarpa Seeds in Different Culture Conditions
在相同质量浓度生长调节剂处理,变温培养条件下,休眠破除处理与常温储藏对千果榄仁种子发芽率的影响如图4(b)所示.由图4(a),(b)可知,变温培养条件与恒温培养条件下种子发芽率表现出相同的变化趋势及特征.在变温培养条件下,CK2经休眠破除处理的种子发芽率为7.3%,常温储藏处理的种子发芽率为6.5%.结合上述试验数据,可以证明休眠破除处理对千果榄仁种子出芽率的提高有较大促进作用.在同一质量浓度生长调节剂处理,恒温或变温培养条件下,千果榄仁种子发芽率基本呈现出休眠破除处理高于常温储藏.
2.5 种子最适发芽条件
(1)千果榄仁种子在GA3溶液处理下最适发芽条件
千果榄仁种子在相同质量浓度的GA3溶液处理下,种子发芽率由大到小依次为休眠破除处理变温培养、休眠破除处理恒温培养、常温储藏变温培养、常温储藏恒温培养.千果榄仁种子储藏的不同方法对其发芽率有明显影响,休眠破除处理有利于种子发芽.GA3溶液处理下,种子发芽率最高的GA3质量浓度为40 mg/L,种子经休眠破除处理变温培养后,发芽率超过40%.
(2)千果榄仁种子在NAA溶液处理下最适发芽条件
千果榄仁种子在相同质量浓度的NAA溶液处理下,种子发芽率由大到小依次为休眠破除处理变温培养、休眠破除处理恒温培养、常温储藏变温培养、常温储藏恒温培养.千果榄仁种子储藏方法不同,对其发芽率有明显影响,休眠破除处理促进了种子萌发.NAA溶液中,种子发芽率最高时的质量浓度是60 mg/L,休眠破除处理变温培养的种子发芽率为29%.
3 讨论
目前,千果榄仁的人工繁育尚处于起步阶段,繁育技术研究的欠缺限制了千果榄仁资源的开发利用.植物生长调节剂在促进种子快速度过休眠期及种子萌发等方面发挥着极其重要的作用,它能够调节种子内部一系列蛋白质及酶的代谢过程,通过信号的传导对种子内的各种生理变化做出相应的反应[6-7],从而有效调控种子的休眠及萌发.本研究中,植物生长调节剂对于千果榄仁种子育苗具有极大的促进作用,可显著提升种子活性,进而提高种子发芽率.无论是GA3溶液,还是NAA溶液,其不同质量浓度梯度的播种发芽率结果均显示,质量浓度过高的生长调节剂并不利于种子发芽,种子的发芽率与生长调节剂的质量浓度不成正比关系,低质量浓度的生长调节剂对于提高千果榄仁种子发芽率具有更好的处理效果.
从进化的观点来看,休眠是植物种子延迟繁殖、增大物种适合度的一种生态策略[8].种子萌发与休眠生态学显示,休眠是种子内在的固有特性之一,低温春化作用是打破植物种子休眠的重要暗示[9].本研究结果显示,在相同质量浓度生长调节剂处理,恒温或变温培养条件下,千果榄仁种子发芽率基本呈现出休眠破除处理高于常温储藏.许多植物的种子在成熟时是休眠的.本研究结果与张志朦等[10]研究结果相似,该研究探究了不同浓度生长调节剂对马甲子种子萌发的影响,发现生长调节剂可促进层积的种子萌发,但对未层积过的种子发芽起到轻微的抑制作用.结合前人研究结果,千果榄仁种子可能不具有深度生理休眠特性,经过低温处理后休眠水平降低,萌发率提高[8].
关于培养温度对植物种子发芽的影响在其他植物研究中报道较多,但对千果榄仁种子发芽的研究较少.恒温和变温培养对植物种子的萌芽时间、出芽势、出芽率、出芽高峰日、生长指数、出苗率等具有较大影响.新疆野生蒲公英种子的发芽率研究结果显示,在生长过程中有足够水分和养分供应的前提下,温度因素对种子的发芽时间起着决定性作用[11].培养温度的日温变化对种子出芽高峰日的出芽势、出芽率和生长指数具有显著影响,经过多重比较发现在15~25 ℃温度变化区间培养种子,可显著提高种子生长指数[12].种子在萌发过程中进行着活跃的代谢反应,有生理试验研究认为,相较于恒温培养,变温培养与细胞膜系统的修复和种子的吸胀速度等生理指标具有极大的相关性[10].种子在一定的温度范围内会随着温度升高而加快萌发进程,但过低或过高的温度会改变膜的透性、膜结合的活性、酶的性质,进而影响种子萌发[13].本研究中,变温培养条件下千果榄仁种子发芽率均高于恒温培养条件下种子发芽率,说明变温对千果榄仁种子萌发有促进作用,有利于提高千果榄仁种子的出苗率及活力指数.

